- 727.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020届天津市南开中学高三第四次月考化学试卷(线上考试)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cu-64
一、单项选择题(共36分)
1.中国传统诗词中蕴含着许多化学知识,下列分析不正确的是( )。
A. “日照香炉生紫烟,遥看瀑布挂前川”,“紫烟”指“香炉”中碘升华的现象
B. “千淘万漉虽辛苦,吹尽狂沙始到金”,金性质稳定,可通过物理方法得到
C. “爆竹声中一岁除,春风送暖入屠苏”,爆竹的燃放涉及氧化还原反应
D. “榆荚只能随柳絮,等闲缭乱走空园”,“柳絮”的主要成分为纤维素
【答案】A
【解析】
【详解】A.“紫烟”是水产生的雾气,它是水蒸发产生的水蒸气遇冷液化而形成的小液滴,是一种液化现象,不是碘升华,故A错误;
B.自然界中金单质的密度比较大,且化学性质稳定,可通过物理方法得到,故B正确;
C.“爆竹”中含黑火药,燃放过程中有新物质二氧化碳、二氧化硫等生成,属于化学变化,故C正确;
D.“柳絮”的主要成分和棉花的相同,都是纤维素,故D正确。答案选A。.
【点睛】本题体现了化学与生产、生活的密切关系,难度不大,注意知识的迁移应用、化学基础知识的积累是解题的关键。
2.下列说法正确的是
A. 刚落下的酸雨随时间增加酸性逐渐增强,是由于雨水中溶解了CO2
B. 用浸泡过高锰酸钾溶液的硅藻土保鲜水果
C. 氧化性:HC1O>稀H2SO4,故非金属性:Cl>S
D. 将饱和FeCl3溶液煮沸至红褐色,可制得氢氧化铁胶体
【答案】B
【解析】
【详解】A.酸雨中含有亚硫酸,亚硫酸可被氧化生成硫酸,溶液酸性增强,并不是雨水中溶解了CO2的缘故,故A错误;
B.乙烯是水果催熟剂,乙烯可与高锰酸钾溶液反应,所以除去乙烯达到水果保鲜的目的,故B正确;
- 17 -
C.非金属性强弱的判断,依据最高价氧化物对应水化物酸性强弱,不是氧化性的强弱且HClO不是Cl元素的最高价含氧酸,不能做为判断的依据,故C错误;
D.制备氢氧化铁胶体,应在沸水中滴加氯化铁溶液,继续加热至溶液呈红褐色,如在饱和氯化铁溶液煮沸,铁离子的水解程度较大,生成氢氧化铁沉淀,故D错误。
故选B。
3.下列叙述正确的是
A. 某温度下,一元弱酸HA的Ka越小,则NaA的Kh(水解常数)越小
B. 铁管镀锌层局部破损后,铁管仍不易生锈
C. 反应活化能越高,该反应越易进行
D. 不能用红外光谱区分C2H5OH和CH3OCH3
【答案】B
【解析】
【分析】
本题是对化学理论进行的综合考查,需要对每一个选项的理论表述进行分析,转化为对应的化学原理,进行判断。
【详解】A.根据“越弱越水解”的原理,HA的Ka越小,代表HA越弱,所以A-的水解越强,应该是NaA的Kh(水解常数)越大。选项A错误。
B.铁管镀锌层局部破损后,形成锌铁原电池,因为锌比铁活泼,所以锌为负极,对正极铁起到了保护作用,延缓了铁管的腐蚀。选B正确。
C.反应的活化能越高,该反应进行的应该是越困难(可以简单理解为需要“翻越”的山峰越高,“翻越”越困难)。选项C错误。
D.红外光谱是用来检测有机物中的官能团或特定结构的,C2H5OH和CH3OCH3的官能团明显有较大差异,所以可以用红外光谱区分,选项D错误。
【点睛】反应的活化能是指普通分子达到活化分子需要提高的能量,则活化能越大,说明反应物分子需要吸收的能量越高(即,引发反应需要的能量越高),所以活化能越大,反应进行的就越困难。从另一个角度理解,课本中表述为,活化能越大,反应的速率应该越慢,这样也可以认为活化能越大,反应越困难。
4.设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A. 14g聚丙烯中含C-H键总数目为2NA
B. 常温下,pH=13的NaOH溶液中含有的OH-数目为0.1NA
- 17 -
C. 100mL12mol·L-1浓硝酸与过量Cu反应转移电子的数目为0.6NA
D. 电解精炼铜时,若阳极质量减少64g,则阴极得到电子的数目为2NA
【答案】A
【解析】
【详解】A. 聚丙烯的最简式为CH2,14g聚丙烯中含H:,所有H均与C以单键相连,所以C-H键总数目为2NA,A选项正确;
B. 没有提供体积,无法计算OH-数目,B选项错误;
C. 100mL12mol·L-1浓硝酸中HNO3的物质的量为:100×10-3L×12mol·L-1=1.2mol。与过量Cu反应,先:Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑ + 2H2O,参加反应的HNO3数目和转移电子的数目的关系为2:1;硝酸变稀后:3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑ + 4H2O,参加反应的HNO3数目和转移电子的数目的关系为4:3。所以,转移电子的数目为0.6NA和0.9NA之间,C选项错误;
D. 电解精炼铜时,阳极溶解的除了Cu还有比Cu活泼的金属,所以若阳极质量减少64g,则阴极得到电子的数目不为2NA,选项D错误;
答案选A。
【点睛】电解精炼铜时,粗铜作阳极,Cu和比Cu活泼的金属氧化溶解,比铜不活泼的成分形成阳极泥;纯铜作阴极,只有Cu析出。两极电子得失相等,但固体的质量变化不相等。
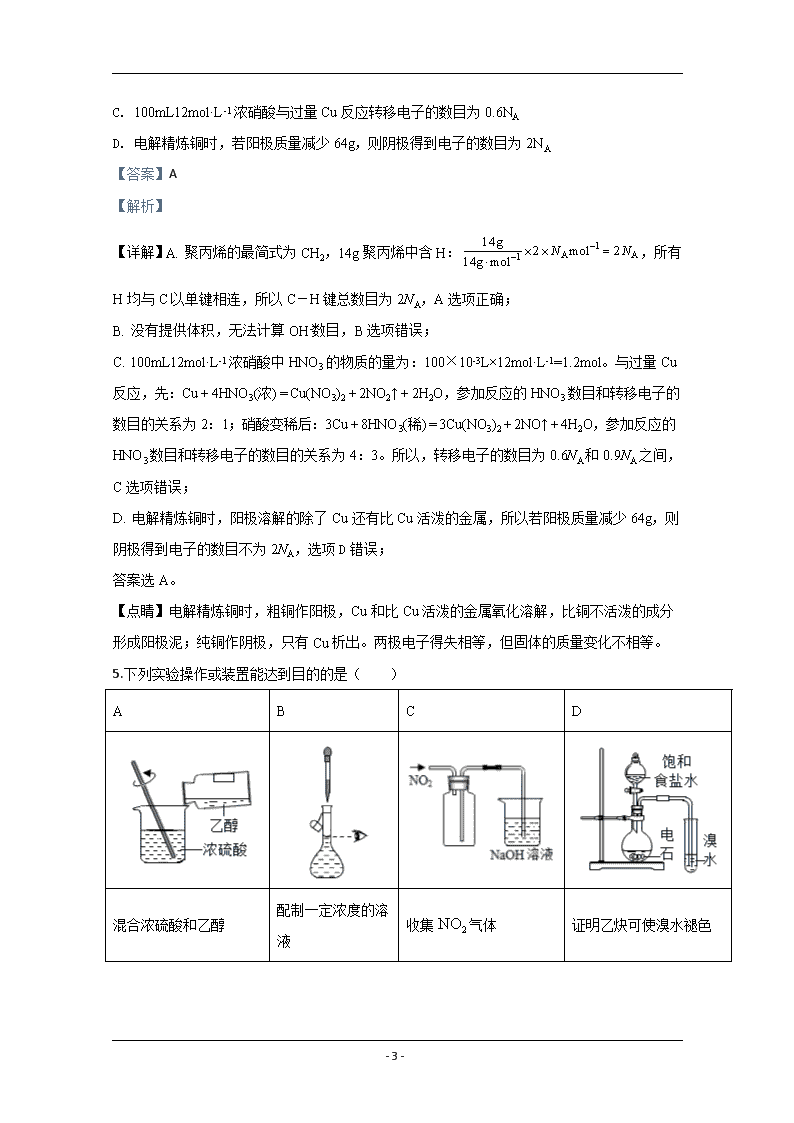
5.下列实验操作或装置能达到目的的是( )
A
B
C
D
混合浓硫酸和乙醇
配制一定浓度的溶液
收集气体
证明乙炔可使溴水褪色
- 17 -
A. A B. B C. C D. D
【答案】B
【解析】
【分析】
A、乙醇的密度小于浓硫酸;
B、容量瓶上的刻度与凹液面的最低处相切;
C、二氧化氮的密度大于空气;
D、乙炔中的杂质也能使溴水褪色。
【详解】A、乙醇的密度小于浓硫酸,混合时应将浓硫酸沿烧杯壁倒入乙醇中,边倒边搅拌,若顺序相反则容易引起液体飞溅,故A不能达到目的;
B、容量瓶上的刻度与凹液面的最低处相切,胶头滴管垂直位于容量瓶的正上方,故B能达到目的;
C、二氧化氮密度大于空气,集气瓶中的导气管应长进短出,故C不能达到目的;
D、乙炔中的H2S等杂质也能使溴水褪色,应先通过一个盛碱液的洗气瓶将杂质除去,故D不能达到目的;
故选B。
【点睛】本题考查实验装置和基本操作,易错点D,学生易忽略实验室用电石制乙炔中的H2S等还原性杂质也能使溴水褪色。
6.下列说法中正确的是( )
A. 气体单质中,一定有σ键,可能有π键
B. PCl3分子是非极性分子
C. 邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点高
D. ClO4-的VSEPR模型与离子的空间立体构型一致
【答案】D
【解析】
【详解】A. 稀有气体是单原子分子,没有σ键,A选项错误;
B. PCl3分子中心原子P为sp3杂化,有一对孤对电子,所以分子构型为三角锥形,是极性分子,B选项错误;
C. 邻羟基苯甲醛的羟基和醛基形成分子内氢键,而对羟基苯甲醛形成分子间氢键,所以邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低,C选项错误;
- 17 -
D. ClO4-的价层电子对数为(7+1)÷2=4,所以ClO4- VSEPR模型为正四面体;中心原子Cl没有孤对电子,配位原子均为O,所以其空间立体构型也为正四面体,D选项正确;
答案选D。
【点睛】分子间氢键加强了分子之间的作用力,使物质熔、沸点升高,而分子内氢键不能加强分子之间的作用力。
7.[Zn(CN)4]2-在水溶液中可与HCHO发生反应生成[Zn(H2O)4]2+和HOCH2CN,下列说法错误的是( )
A. Zn2+基态核外电子排布式为[Ar]3d10
B. 1molHCHO分子中含有σ键的数目为3mol
C. HOCH2CN分子中碳原子轨道的杂化类型是sp3
D. [Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,结构可表示为
【答案】C
【解析】
【详解】A. Zn原子序数为30,位于ⅡB族,所以,Zn2+基态核外电子排布式为[Ar]3d10,A选项正确;
B. 1分子HCHO含2个C-H键和1个C=O键,共有3个σ键,所以,1molHCHO分子中含有σ键的数目为3mol,B选项正确;
C. HOCH2CN分子中与羟基相连的C为sp3杂化,-CN(-C≡N)中的C为sp杂化,C选项错误;
D. [Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,Zn为sp3杂化,配位原子形成正四面体,所以,[Zn(CN)4]2-结构可表示为,D选项正确;
答案选C。
【点睛】一般,两原子间形成的共价键,有且只有1个σ键,如:C=O双键含1个σ键、1个π键,C≡N叁键含1个σ键、2个π键。
8.向新制氯水中加入少量下列物质,能增强溶液漂白能力的是( )
A. 碳酸钙粉末 B. 稀硫酸 C. 氯化钙溶液 D.
- 17 -
二氧化硫水溶液
【答案】A
【解析】
【分析】
在氯水中存在反应Cl2+H2O⇌H++Cl-+HClO,若反应使溶液中次氯酸浓度增大,则溶液漂白性会增强,据此分析解答。
【详解】A.由于酸性HCl>H2CO3>HClO,向溶液中加入碳酸钙粉末反应反应2HCl+CaCO3=CaCl2+CO2↑+H2O,使化学平衡正向进行,导致次氯酸浓度增大,溶液漂白性增强,故A正确;
B.加入稀硫酸使溶液中氢离子浓度增大平衡逆向进行,次氯酸浓度减小,溶液漂白性减弱,故B错误;
C.加入氯化钙溶液不发生反应,溶液对氯水起到稀释作用,平衡正向进行但次氯酸浓度减小,漂白性减弱,故C错误;
D.加入二氧化硫的水溶液,二氧化硫有还原性,能被氯气氧化,平衡逆向进行,次氯酸浓度减小,漂白性减弱,故D错误。
答案选A。
【点晴】本题考查了氯气、次氯酸、氯水性质分析,主要是化学平衡影响因素的理解应用,掌握基础是解题关键。在氯水中存在反应Cl2+H2O⇌H++Cl-+HClO,若反应使溶液中次氯酸浓度增大,则溶液漂白性会增强。
9.肉桂酸()是一种合成有机光电材料的中间体。关于肉桂酸的下列说法正确的是
A. 分子式为C9H9O2
B. 不存在顺反异构
C. 可发生加成、取代、加聚反应
D. 与安息香酸()互同系物
【答案】C
【解析】
【详解】A.根据肉桂酸的结构式可知分子式为:,A错误;
B.肉桂酸双键碳所连的两个原子团均不同,故存在顺反异构,B错误;
- 17 -
C.肉桂酸中苯环和碳碳双键可以发生加成反应,羧基可以发生取代反应,碳碳双键可以发生加聚反应,C正确;
D.肉桂酸中含碳碳双键,安息香酸中不含,故两者不是同系物,D错误;
答案选C。
【点睛】若有机物只含有碳氢两种元素,或只含有碳氢氧三种元素,那该有机物中的氢原子个数肯定是偶数,即可迅速排除A选项。同系物结构要相似,即含有相同的官能团,肉桂酸和安息香酸含有官能团不同,排除D选项。
10.分子式为C5H12O,能与钠反应,且不含手性碳原子的有机化合物共有( )
A. 8种 B. 7种 C. 6种 D. 5种
【答案】D
【解析】
【详解】能与钠反应,说明C5H12O含1个-OH,为戊醇,根据碳链异构、-OH位置异构,可写出8种异构体:①②③④⑤⑥⑦⑧,其中②、⑤、⑦含手性碳原子(用“*”标记)。所以,分子式为C5H12O,能与钠反应,且不含手性碳原子的有机化合物共有5种,D选项正确;
答案选D。
【点睛】一般,同分异构体的书写,可从碳链异构、官能团异构、官能团位置异构三方面考虑。另外,还要注意是否考虑空间异构及题给的限定条件。
11.N2O5在一定温度下可发生反应:2N2O5(g)4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s
0
500
1000
1500
c(N2O5)/(mol·L-1)
5.00
3.52
2.50
2.50
- 17 -
下列说法正确的是( )
A. 500s内NO2的生成速率为2.96×10-3mol/(L·s)
B. T1温度下该反应平衡时N2O5的转化率为29.6%
C. 平衡后,其他条件不变,将容器体积变为原来的,则c(N2O5)<5.00mol/L
D. T1、T2温度下的平衡常数分别为K1、K2,若T1>T2,则K1>K2
【答案】D
【解析】
【分析】
由表中数据可知,T1温度时,向密闭容器中通入N2O5气体, 500s之前未达平衡,1000s后已达平衡。在此认识基础上,根据该反应的特点及题给数据,可对各选项作出判断。
【详解】A. 500s内NO2的生成速率为(5.00-3.52) mol·L-1÷500s×2=5.92×10-3mol/(L·s),A选项错误;
B. T1温度下该反应平衡时N2O5的浓度为2.50mol/L,转化率为(5.00-2.50) mol·L-1÷5.00mol/L=50%,B选项错误;
C. 平衡后,其他条件不变,将容器体积变为原来的,平衡向逆向移动,则c(N2O5)>2×2.50mol/L=5.00mol/L,C选项错误;
D. 该反应ΔH>0,为吸热反应,升高温度,平衡常数增大,所以,若T1、T2温度下的平衡常数分别为K1、K2,且T1>T2,则K1>K2,D选项正确;
答案选D。
【点睛】可逆反应的平衡常数受温度的影响:放热反应的平衡常数随温度的升高而减小,吸热反应的平衡常数随温度的升高而增大。
12.在25℃时,将两个铜电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,阴极逸出amol气体,同时有wgNa2SO4·10H2O晶体析出,若温度不变,剩余溶液的溶质质量分数是( )
A. % B. % C. % D. %
【答案】C
- 17 -
【解析】
【分析】
根据题意,电解的电极反应为:阳极:Cu – 2e- =Cu2+,阴极:2H+ + 2e- = H2 ↑,总反应:Cu + 2H2O Cu(OH)2 + H2 ↑。反应消耗了溶液中的H2O,析出晶体后的溶液仍为饱和溶液,且浓度与原溶液相等,则溶液损失的部分与原溶液浓度相同,也与剩余溶液的溶质质量分数相同。根据产生的气体的物质的量计算出消耗的H2O结合析出的晶体的质量便可计算剩余溶液的溶质质量分数。
【详解】根据分析,电解消耗的H2O的质量为:amol×2×18g∙mol-1 =36ag,wgNa2SO4·10H2O晶体中Na2SO4的质量为:,则剩余溶液的溶质质量分数为,C选项正确;
答案选C。
【点睛】温度不变时,饱和溶液析出晶体后的溶液仍为饱和溶液,原饱和溶液、析出晶体后的溶液和溶液减少的部分的关系:浓度相同,但质量不一定相同。
二、填空题(共64分)
13.铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
Ⅰ.铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如图:
(1)写出反应1中涉及的任意一个化学方程式____;
(2)滤液Ⅰ中加入CaO生成的沉淀是____,已知气体A在标准状况下的密度为1.96g/L,写出A过量时,反应2的离子方程式____;
Ⅱ.以萤石(CaF2)和纯碱为原料制备冰晶石的流程如图:
- 17 -
(3)萤石(CaF2)的电子式____;
(4)若E为硫酸钙,D为最稳定的气态氢化物,则化合物C是____,写出由D制备冰晶石(Na3AlF6)的化学方程式____。
【答案】 (1). 2NaOH+SiO2=Na2SiO3+H2O或2NaOH+Al2O3=2NaAlO2+H2O (2). CaSiO3 (3). AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- (4). (5). H2SO4 (6). 12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O
【解析】
【分析】
I.铝土矿用NaOH溶液处理,Al2O3和SiO2溶解为NaAlO2和Na2SiO3,加CaO后Na2SiO3生成CaSiO3沉淀,过滤后的滤液通入酸性气体,使NaAlO2生成Al(OH)3沉淀,过滤出的Al(OH)3沉淀经煅烧得到Al2O3;Ⅱ.萤石(CaF2)和难挥发酸共热得到HF气体,HF气体和Na2CO3、Al(OH)3反应便得到冰晶石Na3AlF6。可在此基础上解各小题。
【详解】Ⅰ.(1)反应1为Al2O3和SiO2和NaOH溶液反应,生成NaAlO2和Na2SiO3,反应的化学方程式为:2NaOH+SiO2=Na2SiO3+H2O或2NaOH+Al2O3=2NaAlO2+H2O。
答案为:2NaOH+SiO2=Na2SiO3+H2O或2NaOH+Al2O3=2NaAlO2+H2O;
(2)滤液Ⅰ中含的Na2SiO3与加入的CaO反应生成CaSiO3沉淀;气体A在标准状况下的密度为1.96g/L,则A的摩尔质量为:M=ρVm=1.96g/L×22.4L∙mol-1=44g∙mol-1,气体A能与NaAlO2生成Al(OH)3沉淀,故A为CO2。反应2的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。
答案为:CaSiO3;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)CaF2是离子化合物,由F-和Ca2+构成,故CaF2的电子式为:。
答案为:;
(4)最稳定的气态氢化物是HF,则D为HF;若E为硫酸钙,化合物C是难挥发酸,则C是H2SO4;根据已知物质和质量守恒,可写出由D(HF)制备冰晶石(Na3AlF6)的化学方程式为:12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O。
答案为:H2SO4;12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O。
- 17 -
【点睛】气体的摩尔质量: ,可根据关系进行气体的摩尔质量和密度之间的互算。
14.化合物N具有镇痛、消炎等药理作用,其合成路线如下:
(1)A的系统命名为______________,E中官能团的名称为_______________________。
(2)A→B的反应类型为________,从反应所得液态有机混合物中提纯B的常用方法为____________。
(3)C→D的化学方程式为___________________________________________。
(4)C的同分异构体W(不考虑手性异构)可发生银镜反应;且1 mol W最多与2 mol NaOH发生反应,产物之一可被氧化成二元醛。满足上述条件的W有________种,若W的核磁共振氢谱具有四组峰,则其结构简式为________________。
(5)F与G的关系为________(填序号)。
a.碳链异构 b.官能团异构
c.顺反异构 d.位置异构
(6)M的结构简式为_________________________________________________。
(7)参照上述合成路线,以原料,采用如下方法制备医药中间体。
该路线中试剂与条件1为____________,X的结构简式为____________;试剂与条件2为____________,Y的结构简式为________________。
【答案】 (1). 1,6己二醇 (2). 碳碳双键、酯基 (3). 取代反应 (4). 减压蒸馏(
- 17 -
或蒸馏) (5). (6). 5 (7). (8). c (9). (10). HBr,△ (11). (12). O2/Cu或Ag,△ (13).
【解析】
【详解】(1)A为6个碳的二元醇,在第一个和最后一个碳上各有1个羟基,所以名称为1,6-己二醇。明显E中含有碳碳双键和酯基两个官能团。
(2)A→B的反应是将A中的一个羟基替换为溴原子,所以反应类型为取代反应。反应后的液态有机混合物应该是A、B混合,B比A少一个羟基,所以沸点的差距应该较大,可以通过蒸馏的方法分离。实际生产中考虑到A、B的沸点可能较高,直接蒸馏的温度较高可能使有机物炭化,所以会进行减压蒸馏以降低沸点。
(3)C→D的反应为C与乙醇的酯化,所以化学方程式为。注意反应可逆。
(4)C的分子式为C6H11O2Br,有一个不饱和度。其同分异构体可发生银镜反应说明有醛基;1 mol W最多与2 mol NaOH发生反应,其中1mol是溴原子反应的,另1mol只能是甲酸酯的酯基反应(不能是羧基,因为只有两个O);所以得到该同分异构体一定有甲酸酯(HCOO-)结构。又该同分异构体水解得到的醇应该被氧化为二元醛,能被氧化为醛的醇一定为-CH2OH的结构,其他醇羟基不可能被氧化为醛基。所以得到该同分异构体水解必须得到有两个-CH2OH结构的醇,因此酯一定是HCOOCH2-的结构,Br一定是-CH2Br的结构,此时还剩余三个饱和的碳原子,在三个饱和碳原子上连接HCOOCH2-有2种可能:,每种可能上再连接-CH2Br,所以一共有5种:。
- 17 -
其中核磁共振氢谱具有四组峰的同分异构体,要求有一定的对称性,所以一定是。
(5)F为,G为,所以两者的关系为顺反异构,选项c正确。
(6)根据G的结构明显得到N中画圈的部分为M,所以M为。
(7)根据路线中化合物X的反应条件,可以判断利用题目的D到E的反应合成。该反应需要的官能团是X有Br原子,Y有碳氧双键。所以试剂与条件1是HBr,△;将取代为,X为。试剂与条件2是O2/Cu或Ag,△;将氧化为,所以Y为。
【点睛】最后一步合成路线中,是不可以选择CH3CH2CHO和CH3CHBrCH3反应的,因为题目中的反应Br在整个有机链的一端的,不保证在中间位置的时候也能反应。
15.废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:
回答下列问题:
- 17 -
(1)反应Ⅰ是将Cu转化为Cu(NH3)42+,反应中H2O2的作用是_____。写出操作①的名称:_________。
(2)反应II是铜氨溶液中的Cu(NH3)42+与有机物RH反应,写出该反应的离子方程式:_______。操作②用到的主要仪器名称为_____,其目的是(填序号)_________。
a.富集铜元素
b.使铜元素与水溶液中的物质分离
c.增加Cu2+在水中的溶解度
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和______。若操作③使用下图装置,图中存在的错误是_____。
(4)操作④以石墨作电极电解CuSO4溶液。阴极析出铜,阳极产物是_______。操作⑤由硫酸铜溶液制胆矾的主要步骤是____________。
(5)流程中有三次实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是______。循环使用的NH4Cl在反应Ⅰ中的主要作用是________。
【答案】 (1). 作氧化剂 (2). 过滤 (3). Cu(NH3)42++2RH=2NH4++2NH3+CuR2 (4). 分液漏斗 (5). a b (6). RH (7). 分液漏斗尖端未紧靠烧杯内壁、液体过多 (8). O2、H2SO4 (9). 加热浓缩 冷却结晶 过滤 (10). H2SO4 (11). 防止由于溶液中的c(OH-)过高,生成Cu(OH)2沉淀
【解析】
【详解】(1)废电路板中加入双氧水、氨气、氯化铵溶液,得到铜氨溶液和残渣,分离难溶性固体和溶液采用过滤的方法,所以操作①为过滤。反应Ⅰ是将铜转化为铜氨溶液,铜元素的化合价升高,所以铜是还原剂,则双氧水为氧化剂,将铜氧化。
(2)反应Ⅱ是铜氨溶液中的铜氨离子与有机物RH反应,生成CuR2,同时生成NH4+和 NH3,方程式为:Cu(NH3)42++2RH=2NH4++2NH3+CuR2。分液的目的是富集铜元素,使铜元素与水溶液中的物质分离,所以a b正确。
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应相当于复分解反应,所以生成硫酸铜和RH
- 17 -
。互不相溶的液体采用分液的方法,分液时分液漏斗下端要紧靠烧杯内壁,且分液漏斗内部不能盛放太多溶液。
(4)以石墨为电极电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电,所以阳极上产生O2,同时有大量的氢离子生成,且硫酸根离子也向阳极移动在阳极积累,因此阳极产物还有硫酸,从溶液中获取晶体可通过加热浓缩、冷却结晶、过滤的方法。
(5)电解硫酸铜溶液时得到硫酸,在反应Ⅲ中用到的H2SO4,所以硫酸能循环使用。氯化铵电离出的铵根离子抑制一水合氨的电离,从而降低溶液的碱性, 防止由于溶液中的c(OH-)过高,生成Cu(OH)2沉淀。
16.SO2的含量是衡最大气污染的一个重要指标,工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。己知CH4和S的燃烧热(△H)分别为-890.3kJ/mol和-297.2kJ/mol,则CH4和SO2反应的热化学方程式为_____________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
①分析可知X为______(写化学式),0~t1时间段的温度为_____,0~t1时间段用SO2表示的化学反应速率为________。
②总反应化学方程式为_____________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
- 17 -
①该反应△H____0(填“>”或“<”)。
②算a点的平衡常数为_________。
(4)工业上可用Na2SO3溶液吸收法处理SO2,25℃时用1mo/L的Na2SO3溶液吸收SO2。当溶液pH=7时,溶液中各离子浓度的大小关系为________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8。
【答案】 (1). CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) △H=-295.9kJ/mol (2). H2S (3). 300℃ (4). 2×10-3/t1mol/(L·min) (5). 2H2+SO2S+2H2O (6). < (7). 36.45mol/L (8). c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
【解析】
【详解】(1)CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,可知热化学方程式:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol,②S(s)+O2(g)=SO2(g)△H=-297.2kJ/mol,根据盖斯定律,将①-②×2可得CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l)△H=-295.9kJ/mol,故答案为CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l)△H=-295.9kJ/mol;
(2)①根据图1可知,在300℃时,SO2和H2反应生成H2S,在100℃到200℃时,H2S和SO2反应生成S和水,故X为H2S;在图2中,0~t1时间段SO2和H2的浓度降低,H2S的浓度升高,故0~t1时间段温度为300℃;用SO2表示的化学反应速率v===×10−3 mol/(L·min),故答案为H2S;300℃;×10−3 mol/(L·min);
②根据分析可知,SO2和H2最终反应生成S和水,故化学方程式为2H2+SO2=S+2H2O,故答案为2H2+SO2=S+2H2O;
- 17 -
(3)①根据图像可知,平衡后升高温度,SO2的转化率降低,即平衡左移,此反应为放热反应,即△H<0,故答案为<;
②由于点a的二氧化硫的转化率为90%,故有:
故平衡常数K===36.45,故答案为36.45;
(4)Na2SO3溶液吸收SO2生成NaHSO3,离子方程式为SO32-+SO2+H2O=2HSO3-;25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中的溶质为Na2SO3和NaHSO3,故c(Na+)最大,c(H+)=c(OH-)=10-7mol/L,根据K2=6.2×10-8=可知=0.62,故c(HSO3-)>c(SO32-),则有:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),故答案为c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)。
【点睛】本题考查盖斯定律的应用、热化学方程式的书写和平衡常数的计算等,注意利用三段式来计算平衡常数。本题的易错点为(4),正确判断pH=7时,溶液中的溶质为Na2SO3和NaHSO3是解题的关键。
- 17 -