- 203.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学试卷
一、单选题(本大题共16小题,共31.0分)
1. 电子层序数为3时,该电子层的原子轨道数共有
A. 4个 B. 7个 C. 8个 D. 9个
2. 下列表达方式或说法正确的是
A. 的分子模型示意图:
B. 某R元素原子的电子排布图:
C. 键电子云模型:
D. 乙烯分子的球棍模型:
3. 下列说法正确的是
A. 基态原子的能量一定比激发态原子的能量高
B. 表示的是基态原子的电子排布
C. 日常生活中我们看到的许多可见光,如霓虹灯光、节日焰火,都与原子核外电子发生跃迁释放能量有关
D. 电子仅在激发态跃迁到基态时才会产生原子光谱
4. 下列说法或有关化学用语的表达正确的是
A. 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B. 基态Fe原子的外围电子排布图为
C. 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D. 根据原子核外电子排布的特点,Cu在周期表中属于s区元素
5. 下列有关电离能的说法,正确的是
A. 第一电离能越大的原子失电子的能力越强
B. 第一电离能是元素的原子失去核外第一个电子需要的能量
C. 同一周期中,主族元素原子第一电离能从左到右越来越大
D. 可通过一种元素各级电离能的数值,判断元素可能的化合价
6. 下列各组元素按电负性大小排列正确的是
A. B. C. D.
7. 普伐他汀是一种调节血脂的药物,其结构简式如图所示未表示出其空间构型。
下列关于普伐他汀的性质描述正确的是
A. 能与溶液发生显色反应
B. 该物质的分子式为
C. 能发生加成、取代、消去反应,能使酸性溶液褪色
D. 1mol该物质最多可与1molNaOH反应
1. 下列有关同分异构体数目的叙述不正确的是
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 与 互为同分异构体的芳香化合物有6种
C. 青蒿素 的一氯取代物有不含立体异构有7种
D. 菲的结构简式为,它与硝酸反应,可生成5种一硝基取代物
2. 某烃的结构简式为,它可能具有的性质是
A. 易溶于水,也易溶于有机溶剂
B. 既能使溴水褪色,又能使酸性溶液褪色
C. 能发生聚合反应,其产物可表示为
D. 能使溴水褪色,但不能使酸性溶液褪色
3. 下列操作中错误的是
A. 除去乙烷中的少量乙烯:通过盛有高锰酸钾溶液的洗气瓶
B. 除去苯中的少量苯酚:加入NaOH溶液,振荡,静置,分层后除去水层
C. 除去中的少量:通过盛有饱和溶液的洗气瓶
D. 提取溶解在水中的少量碘:加入,振荡,静置,分层后,取出有机层再蒸馏
二、双选题(本大题共4小题,共16.0分)
4. 下列试剂中,可以用来鉴别己烯、苯、乙醇和苯酚溶液的一种试剂是
A. 盐酸 B. 溴水 C. 三氯化铁溶液 D. 钠
5. 配合物可用于离子检验,下列说法不正确的是
A. 此配合物中存在离子键、配位键、极性键、非极性键
B. 配离子为,中心离子为,配位数为6,配位原子有C和N
C. 1mol配合物中键数目为
D. 该配合物为离子化合物,易电离,1mol配合物电离共得到阴阳离子
6. 下列分子式只表示一种纯净物的是
A. B. C. D. C
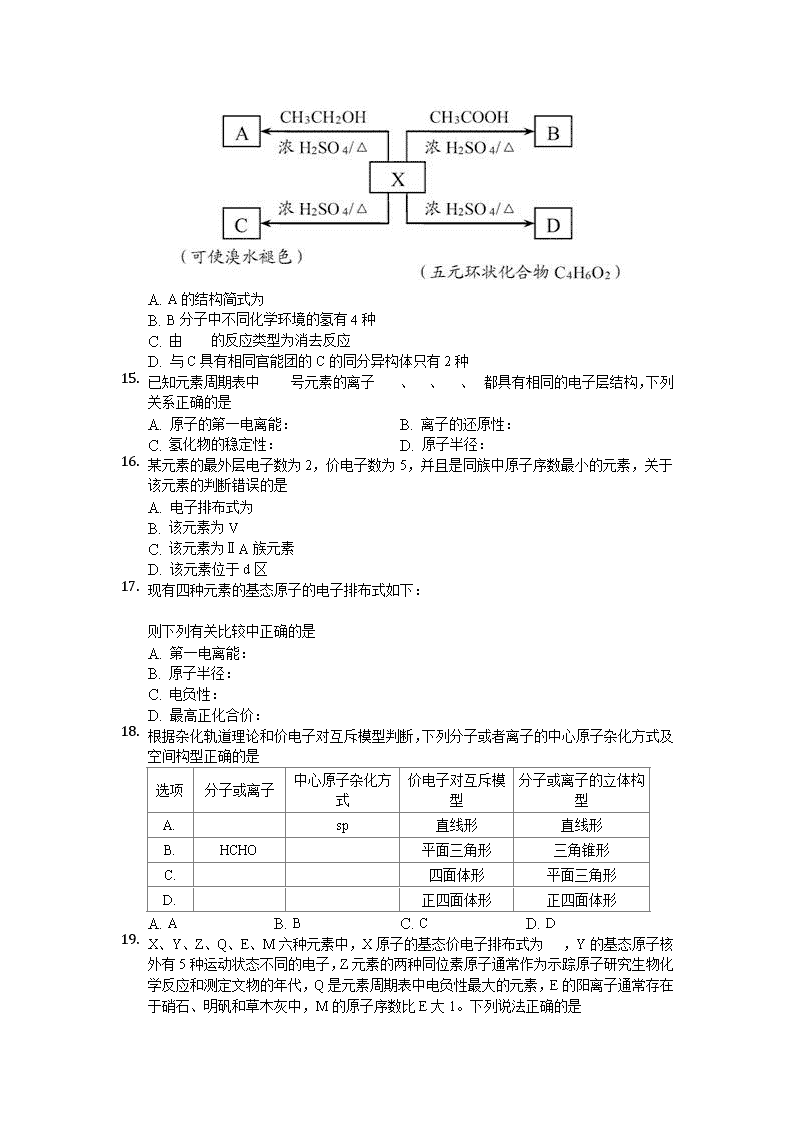
7. 有机化合物X在一定条件下具有如图所示的转化关系,若有1molX自身酯化且完全反应则可得到1molD。下列有关说法中正确的是
A. A的结构简式为
B. B分子中不同化学环境的氢有4种
C. 由的反应类型为消去反应
D. 与C具有相同官能团的C的同分异构体只有2种
1. 已知元素周期表中号元素的离子、、、都具有相同的电子层结构,下列关系正确的是
A. 原子的第一电离能: B. 离子的还原性:
C. 氢化物的稳定性: D. 原子半径:
2. 某元素的最外层电子数为2,价电子数为5,并且是同族中原子序数最小的元素,关于该元素的判断错误的是
A. 电子排布式为
B. 该元素为V
C. 该元素为ⅡA族元素
D. 该元素位于d区
3. 现有四种元素的基态原子的电子排布式如下:
则下列有关比较中正确的是
A. 第一电离能:
B. 原子半径:
C. 电负性:
D. 最高正化合价:
4. 根据杂化轨道理论和价电子对互斥模型判断,下列分子或者离子的中心原子杂化方式及空间构型正确的是
选项
分子或离子
中心原子杂化方式
价电子对互斥模型
分子或离子的立体构型
A.
sp
直线形
直线形
B.
HCHO
平面三角形
三角锥形
C.
四面体形
平面三角形
D.
正四面体形
正四面体形
A. A B. B C. C D. D
5. X、Y、Z、Q、E、M六种元素中,X原子的基态价电子排布式为,Y的基态原子核外有5种运动状态不同的电子,Z元素的两种同位素原子通常作为示踪原子研究生物化学反应和测定文物的年代,Q是元素周期表中电负性最大的元素,E的阳离子通常存在于硝石、明矾和草木灰中,M的原子序数比E大1。下列说法正确的是
A. 中阴离子中心原子的杂化方式为杂化
B. X、Y元素的第一电离能大小关系:
C. 的空间构型为平面三角形
D. 仅含离子键,可用于制备乙炔
1. 钡在氧气中燃烧时的得到一种钡的氧化物晶体,其结构立方体如图所示,有关说法正确的是
A. 该晶体属于分子晶体
B. 晶体的化学式为
C. 该晶体晶胞结构与CsCl相似
D. 与每个距离相等且最近的共有12个
三、填空题(本大题共1小题,共15.0分)
2. 磷、硫、氯、砷等是农药中的重要组成元素.回答下列问题:
基态砷原子价层电子的电子排布式为________,基态砷原子的核外有________个未成对电子.
生产农药的原料中P、S、Cl的第一电离能由大到小的顺序为________,电负性:由大到小的顺序为________.
羰基硫可用作粮食的熏蒸剂,其中碳原子的杂化轨道类型为________,中含有________ 键和________ 键,与COS键合方式相同且空间构型也相同的微粒是________写出一种即可.
与为同族元素的氢化物,可以形成或,而几乎不能形成类似的或,其原因是________.
因杀虫效率高、廉价易得而被广泛应用.已知AlP的熔点为,熔融状态下的AlP不导电,其晶胞结构如图所示.
磷化铝的晶体类型为________.
、B点的原子坐标如图所示,则C点的原子坐标为________.
磷化铝的晶胞参数为,阿伏加德罗常数的值为,则磷化铝的密度为________列出计算式.
四、简答题(本大题共1小题,共15.0分)
1. 溴代羰基化合物合成大位阻醚的有效方法可用于药物化学和化学生物学领域。用此法合成化合物J的路线如图:
已知:
回答下列问题:
中含有的含氧官能团的名称是______,用系统命名法命名A的名称是______。
所需试剂和反应条件为______。
由C生成D的化学反应方程式是______。
写出H的结构简式______,写出检验溶液中存在G的一种化学方法______。
的反应类型是______。F与C在CuBr和磷配体催化作用下1:1反应合成大位阻醚,写出其中一种有机产物的结构简式:______。
化合物X是E的同分异构体,分子中不含羧基,既能发生水解反应,又能与金属钠反应。符合上述条件的X的同分异构体有多种,其中能发生银镜反应,核磁共振氢谱有3组峰,峰面积之比为1:6:1的结构简式为______。