- 689.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
绍兴一中2016学年第一学期期中考试
高二化学试题卷
命 题:金建忠 校对:沈超华
说明:1.本试卷分Ⅰ选择题和Ⅱ非选择题两部分。考试时间90分钟,满分100分。
2.所有答案都写在答题卷上,本场考试不准使用计算器。
3.可能用到的相对原子质量:H-1 C-12 N-14 Cu-64
Ⅰ选择题(共50分)
一、选择题(每题只有一个选项符合题意,每小题2分,共50分)
1.下列措施不符合节能减排的是( )
A.大力发展火力发电,解决电力紧张问题
B.在屋顶安装太阳能热水器为居民提供生活用热水
C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
2.能源分类相关图如下图所示,下列四组选项中,全部符合图中阴影部分的能源是( )
A.煤炭、石油、潮汐能 B.水能、生物能、天然气
C.太阳能、风能、沼气 D.地热能、海洋能、核能
3.下列过程中ΔH小于零的是( )
A.Ba(OH)2与NH4Cl固体混合 B.氯化铵分解得氨气
C.碳酸钙分解得二氧化碳 D.实验室制备氢气
4.某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
mCeO2(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2mCeO2+xH2+xCO
下列说法不正确的是( )
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.右图中ΔH1=ΔH2+ΔH3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-===CO+2H2O
5.已知1 g H2完全燃烧生成水蒸气放出热量121 kJ,且O2中1 mol O===O键完全断裂时吸 收热量496 kJ,水蒸气中形成1 mol H—O键时放出热量463 kJ,则H2中1 mol H—H键断裂时吸收的热量为( )
A.920 kJ B.436 kJ C.557 kJ D.188 kJ
6.已知:
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+O2(g) ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的标准燃烧热为283 kJ
B.下图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-532 kJ·mol-1
D.CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
7.已知H2(g)、CO(g)、CH3OH(l)的燃烧热H分别是-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。下列有关叙述正确的是( )
A.甲醇不完全燃烧生成CO和液态水的热化学方程式:
CH3OH(l)+O2 (g)== CO(g)+2H2O(l) △H1=-1009.5kJ·mol-1
B.CH3OH(l)+1/2O2 (g)== CO2(g)+2H2 (g) △H1=-440.7kJ·mol-1
C.2H2O(g) == 2H2(g)+O2(g) △H1 =+571.6 kJ·mol-1
D.已知:S(s)+O2(g) = SO2(g) △H1 ;S(g)+O2(g) = SO2(g) △H2 ;则△H1>△H2
8.X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下 反应:X+2Y2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
A.33% B.40% C. 50% D.65%
9.某温度时,N2+3H22NH3的平衡常数K=a,则此温度下,NH3H2+N2的平衡常数为( )
A.a B.a C.a D.a-2
10.对处于平衡状态的反应2A(g)+B(g)2C(g) ΔH<0,下列叙述正确的是 ( )
A.升高温度,v正减小,v逆增大 B.增大A浓度的瞬间,v正增大,v逆不变
C.增大压强,v正增大,v逆减小 D.加入正催化剂,v正增大,v逆减小
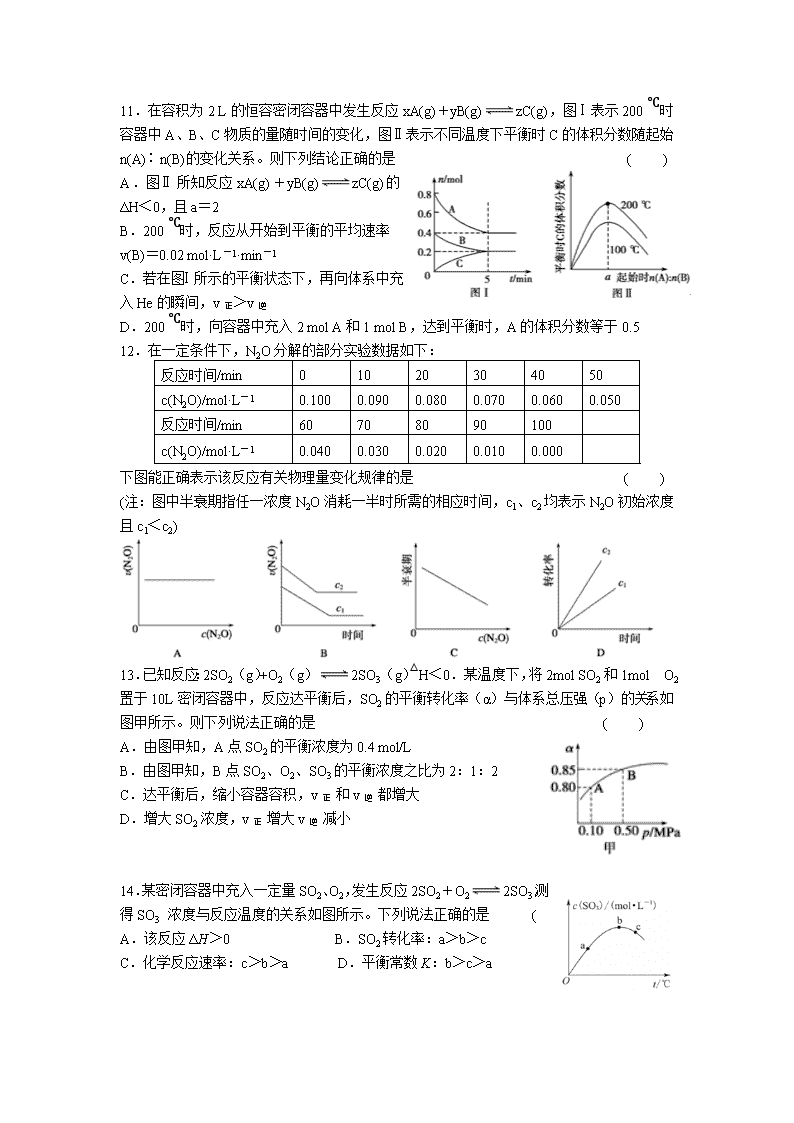
11.在容积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
A.图Ⅱ所知反应xA(g)+yB(g)zC(g)的ΔH<0,且a=2
B.200 ℃时,反应从开始到平衡的平均速率
v(B)=0.02 mol·L-1·min-1
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He的瞬间,v正>v逆
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数等于0.5
12.在一定条件下,N2O分解的部分实验数据如下:
反应时间/min
0
10
20
30
40
50
c(N2O)/mol·L-1
0.100
0.090
0.080
0.070
0.060
0.050
反应时间/min
60
70
80
90
100
c(N2O)/mol·L-1
0.040
0.030
0.020
0.010
0.000
下图能正确表示该反应有关物理量变化规律的是 ( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
13.已知反应:2SO2(g)+O2(g)2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 ( )
A.由图甲知,A点SO2的平衡浓度为0.4 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,v正 和v逆 都增大
D.增大SO2浓度,v正 增大v逆 减小
14.某密闭容器中充入一定量SO2、O2,发生反应2SO2+O22SO3,测得SO3浓度与反应温度的关系如图所示。下列说法正确的是 ( )
A.该反应ΔH>0 B.SO2转化率:a>b>c
C.化学反应速率:c>b>a D.平衡常数K:b>c>a
15.已知反应2CH3OH(g)CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
物质
CH3OH
CH3OCH3
H2O
浓度/mol·L-1
0.44
0.6
0.6
下列叙述中正确的是 ( )
A.该反应的平衡常数表达式为K=[c(CH3OCH3)×c(H2O)]/c(CH3OH)
B.此时正、逆反应速率的大小:v正<v逆
C.若经10 min后反应达到平衡,此时c(CH3OH)=0.04 mol·L-1
D.0~10min内平均反应速率v(CH3OH)=1.6 mol·(L·min)-1
16.下列各组离子在指定溶液中一定能大量共存的是( )
①pH = 0的溶液:Na+、Cl—、MnO4—、SO42—
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度c(H+)=10-12mol·L-1的溶液中:Cl-、CO32-、NO3-、NH4+、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
⑤使石蕊变红的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、I-、Cl-、S2-
A.②④ B.①③⑥ C.①②⑤ D.①②④
17.根据下图海水综合利用的工业流程图,判断下列说法正确的是( )
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D.从第③步到第⑤步的目的是为了制取并提纯Br2
18.右图表示水中c(H+)和c(OH-)的关系,下列判断错误的是 ( )
A.两条曲线间任意点均有c(H+)×c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
19. 室温下,下列说法中错误的是( )
A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-)
B.pH=5的下列溶液(①NH4Cl溶液②CH3COOH溶液;③稀盐酸)中由水电离出来的c(H+)水 ①>②>③
C.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
D.pH相同的下列三种溶液(①CH3COONa、②NaHCO3、③NaClO)中的c(Na+):
①>②>③
20.已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOHCH3COO-+H+ ΔH1>0 (K1=1.75×10-5)
CH3COO-+H2OCH3COOH+OH- ΔH2>0 ( K2=5.71×10-10 )
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
A.混合溶液pH>7 B.对混合溶液进行微热,K1增大、K2减小
C.调节混合溶液的pH至中性,则此时溶液中c(Na+)=c(CH3COO-)
D.温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO-)减小
21.工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是( )
已知: ①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A.碳棒上发生的电极反应:4OH— -4e—==O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
22.下列叙述正确的是
A.将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色
B.将一小块钠放入盛有水的烧杯中,钠在水面上游动,同时看到烧杯内的溶液变为红色
C.如右图,一段时间后给烧杯内的溶液中加入氢氧化钠溶液,可看到Fe电极附近有红褐色沉淀生成
D.向盛有少量Mg(OH)2沉淀悬浊液的试管中滴加氯化铵溶液,可看到沉淀溶解
23.下列反应的离子方程式书写不正确的是( )
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+H++ SO42- + NH4+= BaSO4↓+ NH3•H2O+H2O
B.将少量SO2气体通入NaClO溶液中:SO2+H2O+ ClO-=SO42-+Cl-+2H+
C.Na2CO3溶液中滴加几滴稀盐酸:CO32 + H+ = HCO3-
D. NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-= CaCO3↓+2H2O+ CO32-
24.将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如右图,则下列说法正确的是( )
A.阳极产物一定是Cl2,阴极产物一定是Cu
B.BC段表示在阴极上是H+放电产生了H2
C.AB、BC段阴极反应都为Cu2+ + 2e-= Cu
D.CD段表示阳极上OH一放电破坏了水的电离平衡,产生了H+
25.某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+ 和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
下列说法正确的是( )
A.原溶液中c(Fe3+)=0.2 mol·L-1
B.溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol·L-1
C.SO42ˉ、NH4+ 、Na+一定存在,CO32ˉ一定不存在
D.要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+
Ⅱ非选择题(共50分)
三、填空题
26.(8分)过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化KI的离子反应方程式:
(2)Na2O2 、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是_______(写电子式),
(3)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
已知:N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ mol-1
H2O2(l)=H2O(l)+1/2O2(g) △H=-98.64kJ mol-1
H2O(l)=H2O(g) △H=+44kJ mol-1
则反应N2H4(g)+2H2O2(l)= N2(g)+4H2O(g) 的 △H=____
(4)臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:
KI+O3+H2O→KOH+I2+O2(未配平) 回答问题:
①还原产物的化学式为
②配平后的化学方程式是
(4)O3 可由臭氧发生器(原理如图8所示)电解稀硫酸制得。
①图中阴极为 (填“A”或“B”)。
②若C处不通入O 2 ,D、E处分别收集到11.2L和有4.48L气体(标准状况下), 则E处收集的气体中O3所占的体积分数为 (忽略 O 3 的分解)。
③若C处通入O 2,则A极的电极反应式为: 。
27.(12分)(1)利用反应Cu+2FeCl3===CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:
①写出电极反应式:正极__________________________ ;负极_________________________。
②图中X溶液是________,Y溶液是________。
③原电池工作时,盐桥中的________(填“阳”或“阴”)离子向X溶液方向移动。
(2)控制适合的条件,将反应2Fe3++2I-2Fe2++I2,设计成如图所示的原电池。
请回答下列问题:
①反应开始时,乙中石墨电极上发生________(填“氧化”或“还原”)反应,电极反应式为________________。甲中石墨电极上发生______________反应,电极反应式为___________。
②电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨作________(填“正”或“负”)极,该电极的电极反应式为___________________________。
(3)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4
,若将该反应设计为原电池,其正极电极反应式为____________________________________。
28.(12分)(1)图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL, 如果刻度A为4,量简中液体的体积是________mL。
(2)图II表示50mL滴定管中液画的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)______________。
A. 是amL B.是(50-a)mL C. 一定大于amL D.一定大于(50-a)mL
(3)排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
(4)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+
滴定时,1mol (CH2)6N4H+与1mol H+相当,然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A 滴定管内液面的变化 B 锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如下表所示:
滴定次数
待测溶液的体积/mL
标准溶液的体积
滴定前刻度/mL
滴定后刻度/mL
1
25.00
1.02
21.03
2
25.00
2.00
21.99
3
25.00
0.20
20.20
若NaOH标准溶液的浓度为0.1010mo1·L-1,则该样品中氮的质量分数为 。
29.(8分)部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HClO
H2CO3
H2SO3
电离平衡常数(25 ℃)
Ka=1.77×10-4
Ka=4.0
×10-8
Ka1=4.3×10-7
Ka2=4.7×10-11
Ka1=1.54×10-2
Ka2=1.02×10-7
(1)在温度相同时,各弱酸的Ka值与酸性的相对强弱的关系为________________。
(2)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L
-1 NaHCO3溶液的pH由大到小的关系为______________________________。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO、CO、HSO、HCO浓度从大到小的顺序为________________________________________。
(4)下列离子方程式正确的是________(填字母)。
a.2ClO-+H2O+CO2===2HClO+CO b.2HCOOH+CO===2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-===2HCOOH+SO d.Cl2+H2O+2CO===2HCO+Cl-+ClO-
(5) 常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为_______________________________。
30.(10分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
温度(℃)
15.0
20.0
25.0
30.0
35.0
平衡总压强(kPa)
5.7
8.3
12.0
17.1
24.0
平衡气体总浓度
(×10-3mol/L)
2.4
3.4
4.8
6.8
9.4
①可以判断该分解反应已经达到化学平衡的是___________。
A. B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:__________________________。
③氨基甲酸铵分解反应的焓变△H____0,熵变△S___0(填>、<或=)。
(2)已知:NH2COONH4+2H2ONH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
④ 计算25℃时,0~6min氨基甲酸铵水解反应的平均速率___________________________。
绍兴一中2016学年第一学期高二期中考试化学试题答题纸
二、填空题(50分)
26.(8分)(1) (2)
(3) △H= (4)①还原产物的化学式为 ②
(4) ① 。② 。③ 。
27.(12分)(1)①正极__________________________ ;负极_________________________。
②X溶液是 ,Y溶液是 。③ ________
(2) ①_____,电极反应式为 。_____,
电极反应式为 ②_____,电极反应式为 。
(3)电极反应式为 。
28. (12分)(1) ______。(2) ______。(3) ______ 。(4)(1)① 。② 。
③ 。 ④ 由 色变成 色。(2) 。
29.(8分) (1) ________________ 。(2) ______________________ _。
(3) 。(4) ________ (5)
30.(10分)(1)①___________。 ② __________________________。
③ △H 0, △S 0。(2)
绍兴一中2016学年第一学期高二期中考试化学试题答案
一、选择题:(每题只有一个选项符合题意,每小题2分,共50分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
A
C
D
C
B
C
D
D
A
B
B
A
C
题号
14
15
16
17
18
19
20
21
22
23
24
25
答案
C
C
A
D
D
B
C
B
D
B
C
B
Ⅱ非选择题(共50分)
三、填空题
26.(8分)(1)H2O2+2I-+2H+==I2+2H2O
(2)BaO2 电子式
(3)-555.28kJ mol-1
① KOH ②O3+2KI+H2O=2KOH+I2+O2
(4)① A ② 50% ③O2+4H++4e-=2H2O
27.(12分)(1)①2Fe3++2e-===2Fe2+ Cu-2e-===Cu2+ ②FeCl3 CuCl2 ③阳 (2)①氧化 2I--2e-===I2 还原 2Fe3++2e-===2Fe2+ ②正 I2+2e-===2I- (3)O2+4e-+4H+===2H2O
28.(12分)
(1)3.2 (2)D (3)丙
(4)(1)①偏高 ②无影响 ③B ④无 粉红(或浅红) (2)18.85%
29.(8分).(1)Ka越大,酸性越强 (2)③>②>④>① (3)c(SO)>c(CO)>c(HCO)>c(HSO)
(4)bd (5)c(HCOO-)>c(Na+)>c(H+)>c(OH-)
30.(10分)(1)①BC; ②K=c2(NH3)·c(CO2)=(2c/3)2(1c/3)=1.6×10-8(mol·L-1)3
③ >,>。(2)⑤0.05mol·L-1·min-1;