- 265.00 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
五、化学反应与热量 选择题 练习
1、基本概念
(2010山东)10.下列与化学反应能量变化相关的叙述正确的是
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g) 2HCl(g)在光照和点燃条件下的△H不同
(2009上海)5.下列对化学反应的认识错误的是
A.会引起化学键的变化 B.会产生新的物质
C.必然引起物质状态的变化 D.必然伴随着能量的变化
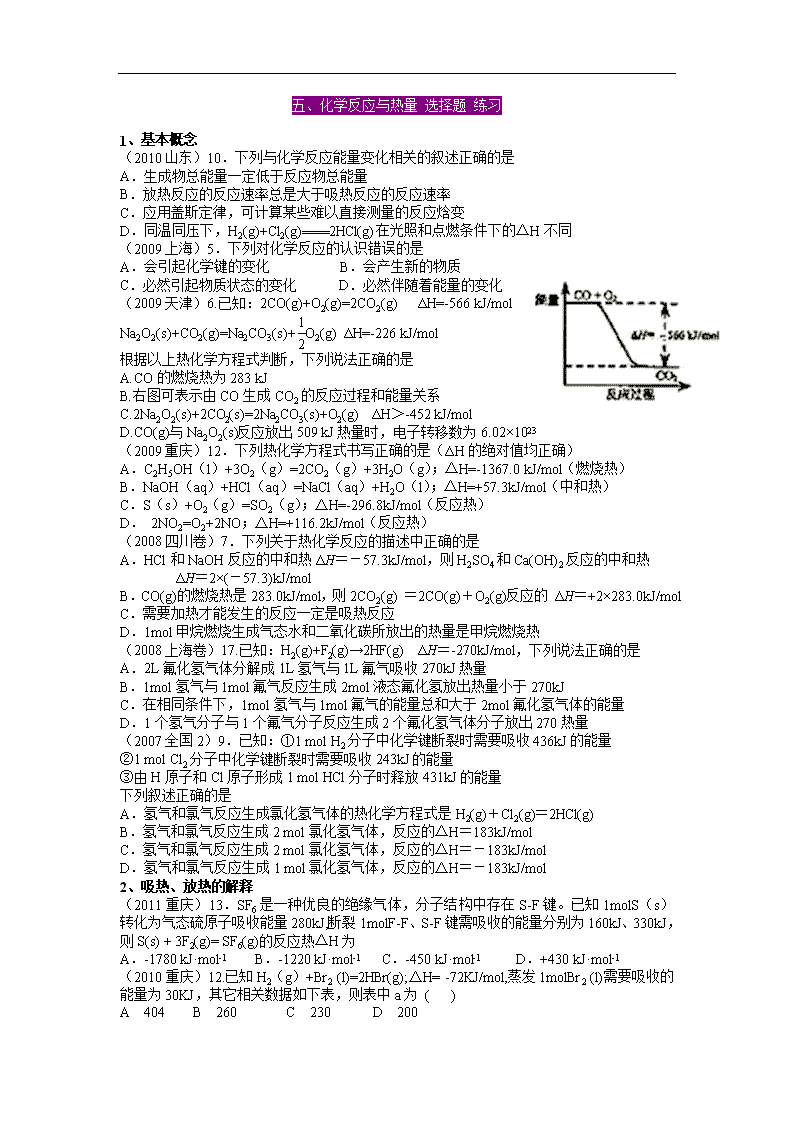
(2009天津)6.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
(2009重庆)12.下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)=SO2(g);△H=-296.8kJ/mol(反应热)
D. 2NO2=O2+2NO;△H=+116.2kJ/mol(反应热)
(2008四川卷)7.下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热
ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的 ΔH=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热
(2008上海卷)17.已知:H2(g)+F2(g)→2HF(g) ΔH=-270kJ/mol,下列说法正确的是
A.2L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270热量
(2007全国2)9.已知:①1 mol H2分子中化学键断裂时需要吸收436kJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431kJ的能量
下列叙述正确的是
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=183kJ/mol
C.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=-183kJ/mol
D.氢气和氯气反应生成1 mol氯化氢气体,反应的△H=-183kJ/mol
2、吸热、放热的解释
(2011重庆)13.SF6是一种优良的绝缘气体,分子结构中存在S-F键。已知1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F、S-F键需吸收的能量分别为160kJ、330kJ,则S(s) + 3F2(g)= SF6(g)的反应热△H为
A.-1780 kJ·mol-1 B.-1220 kJ·mol-1 C.-450 kJ·mol-1 D.+430 kJ·mol-1
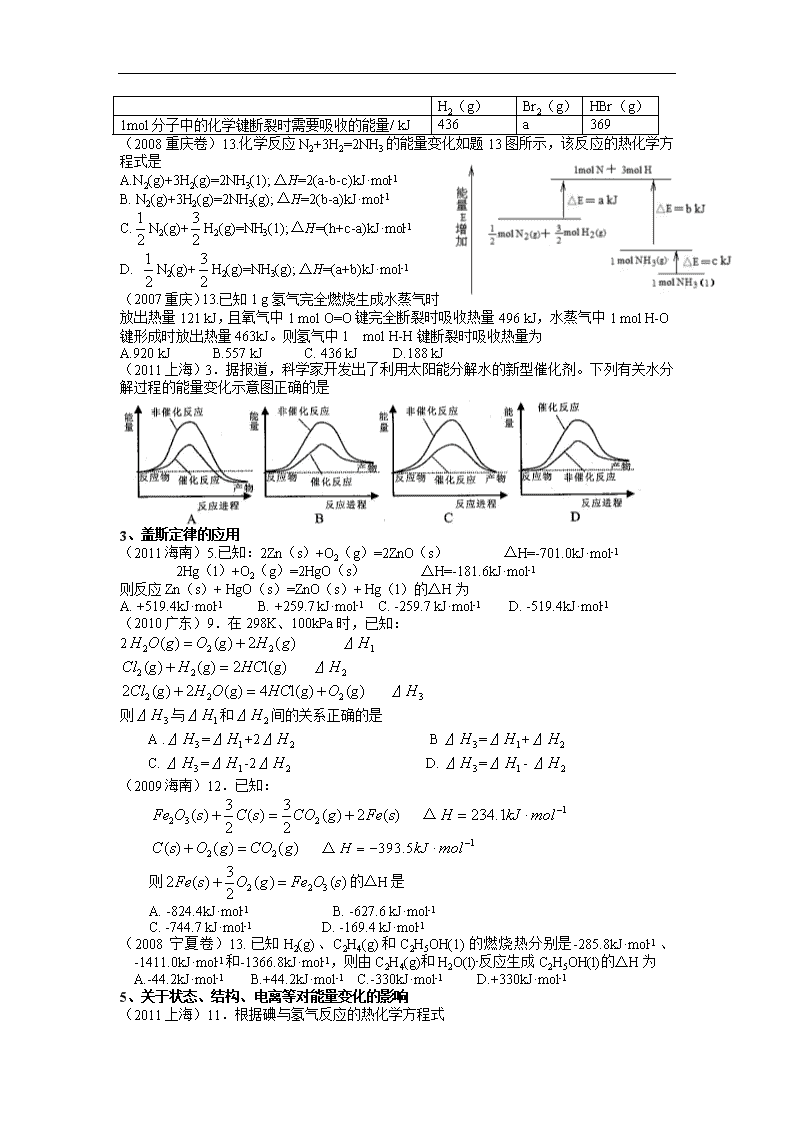
(2010重庆)12.已知H2(g)+Br2 (l)=2HBr(g);△H= -72KJ/mol,蒸发1molBr2 (l)需要吸收的能量为30KJ,其它相关数据如下表,则表中a为 ( )
A 404 B 260 C 230 D 200
H2(g)
Br2(g)
HBr(g)
1mol分子中的化学键断裂时需要吸收的能量/ kJ
436
a
369
(2008重庆卷)13.化学反应N2+3H2=2NH3的能量变化如题13图所示,该反应的热化学方程式是
A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)=2NH3(g); △H=2(b-a)kJ·mol-1
C.N2(g)+H2(g)=NH3(1); △H=(h+c-a)kJ·mol-1
D. N2(g)+H2(g)=NH3(g); △H=(a+b)kJ·mol-1
(2007重庆)13.已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463kJ。则氢气中1 mol H-H键断裂时吸收热量为
A.920 kJ B.557 kJ C. 436 kJ D.188 kJ
(2011上海)3.据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是
3、盖斯定律的应用
(2011海南)5.已知:2Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) △H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
A. +519.4kJ·mol-1 B. +259.7 kJ·mol-1 C. -259.7 kJ·mol-1 D. -519.4kJ·mol-1
(2010广东)9.在298K、100kPa时,已知:
2 ⊿
⊿
⊿
则⊿与⊿和⊿间的关系正确的是
A .⊿=⊿+2⊿ B ⊿=⊿+⊿
C. ⊿=⊿-2⊿ D. ⊿=⊿- ⊿
(2009海南)12.已知:
△·
△·
则的△H是
A. -824.4kJ·mol-1 B. -627.6 kJ·mol-1
C. -744.7 kJ·mol-1 D. -169.4 kJ·mol-1
(2008宁夏卷)13.已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)-反应生成C2H5OH(l)的△H为
A.-44.2kJ·mol-1 B.+44.2kJ·mol-1 C.-330kJ·mol-1 D.+330kJ·mol-1
5、关于状态、结构、电离等对能量变化的影响
(2011上海)11.根据碘与氢气反应的热化学方程式
(i) I2(g)+ H2(g) 2HI(g) △H=-9.48 kJ (ii) I2(s)+ H2(g)2HI(g) △H=+26.48 kJ
下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
(2010新课标)11.己知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ·mol-1;HCl(aq)与NaOH(aq)反应的△H=-55.6kJ·mol-1。则HCN在水溶液中电离的△H等于
A.-66.7kJ·mol-1 B.-43.5kJ·mol-1 C.+43.5kJ·mol-1 D. +66.7kJ·mol-1
(2007上海)14. 已知:CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l)△H=-2878kJ/mol
(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) △H=-2869kJ/mol 下列说法正确的是
A 正丁烷分子储存的能量大于异丁烷分子 B 正丁烷的稳定性大于异丁烷
C 异丁烷转化为正丁烷的过程是一个放热过程 D 异丁烷分子中的碳氢键比正丁烷的多
6、其它综合性问题
(2011北京)10.25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O △H=-414kJ·mol-1
②2Na(s)+ O2(g)=Na2O2 △H=-511kJ·mol-1 下列说法正确的是
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25℃、101kPa 下:Na2O2(s)+2 Na(s)= 2Na2O(s) △H =-317kJ/mol
(2011浙江)12.下列说法不正确的是
A.已知冰的熔化热为6.0kJ﹒mol-1,冰中氢键键能为20 kJ﹒mol-1,假设每摩尔冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键。
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为。若加入少量CH3COONa固体,则电离平衡CH3COOH CH3COO-+H+向左移动,а减小,Ka变小。
C.检测得环己烷(l)环己烯(l)和苯(l)的标准燃烧热分别为-3916kJ·mol-1、-3747kJ·mol-1和-3265kJ·mol-1,可以证明在苯分子中不存在独立的碳碳双键。
D.已知:2Fe2O3(s) + 3C(石墨)= 2Fe(s) +3CO(g) △H=-489.0kJ·mol-1
CO(g) + 1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1
C(石墨)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
则:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1641.0kJ·mol-1
(2009全国二)11. 已知:2H2(g)+ O2(g)=2H2O(l) ΔH= -571.6KJ· mol-1
CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH= -890KJ· mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是
A.1∶1 B.1∶3 C.1∶4 D.2∶3
答案
(2010山东)10.C(2009上海)5.C(2009天津)6.C(2009重庆)12.C
(2008四川卷)7.B(2008上海卷)17.C(2007全国2)9.C
(2011重庆)13.B(2010重庆)12.D(2008重庆卷)13.A(2007重庆)13.C
(2011上海)3.B
(2011海南)5. C(2010广东)9.A(2009海南)12.A(2008宁夏卷)13.A
(2011上海)11.D(2010新课标)11.C(2007上海)14. A
(2011北京)10.D(2011浙江)12.B(2009全国二)11.B