- 346.58 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时作业5 过滤和蒸发
时间:45分钟 满分:100分
一、选择题(每小题4分,共48分)
1.能用溶解、过滤、结晶的方法来分离的一组物质是( B )
A.NaCl和Na2SO4 B.CuO和KCl
C.BaSO4和CaCO3 D.NaNO3和NaOH
解析:A、D两项中两种物质均溶于水,无法用过滤法分离;B项中CuO不溶于水,KCl易溶于水,可通过溶解、过滤的方法分离,再蒸发滤液结晶可得KCl;C项中两种物质均不溶于水,无法用过滤法分离。
2.欲除去下列物质中的杂质(括号内物质为杂质),所用试剂不正确的是( B )
A.KNO3溶液(K2SO4):适量Ba(NO3)2溶液
B.CaCO3粉末(CaCl2):过量盐酸
C.Cu粉(Zn粉):过量盐酸
D.CO2(O2):灼热的铜网
解析:K2SO4+Ba(NO3)2===BaSO4↓+2KNO3,A正确;盐酸能够将CaCO3完全溶解,B错误;Zn+2HCl===ZnCl2+H2↑,Cu与盐酸不反应,故C正确;2Cu+O2△,2CuO,D正确。
3.某固体NaOH因吸收了空气中的CO2而含有杂质,现在要将该固体NaOH配制成较纯的溶液,则其主要的实验操作过程应是( C )
A.溶解、加适量BaCl2溶液、过滤
B.溶解、加适量CaCl2溶液、过滤
C.溶解、加适量Ca(OH)2溶液、过滤
D.溶解、加适量盐酸、加热
解析:NaOH固体因吸收了空气中的CO2而含有杂质Na2CO3,除去杂质Na2CO3但又不能引进新的杂质,故选加适量Ca(OH)2溶液,然后过滤,C项正确。
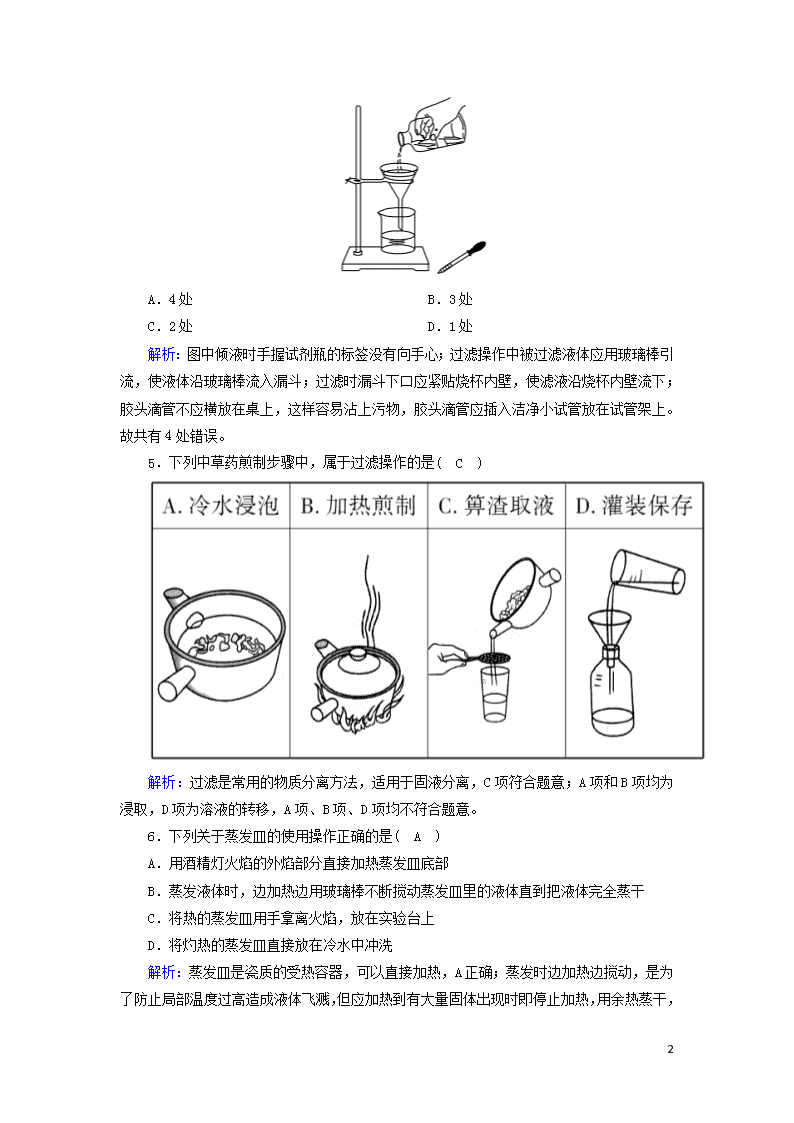
4.某学生发现滴瓶中的溶液有悬浮物,拟用如右图所示操作进行过滤,操作上错误的地方有( A )
8
A.4处 B.3处
C.2处 D.1处
解析:图中倾液时手握试剂瓶的标签没有向手心;过滤操作中被过滤液体应用玻璃棒引流,使液体沿玻璃棒流入漏斗;过滤时漏斗下口应紧贴烧杯内壁,使滤液沿烧杯内壁流下;胶头滴管不应横放在桌上,这样容易沾上污物,胶头滴管应插入洁净小试管放在试管架上。故共有4处错误。
5.下列中草药煎制步骤中,属于过滤操作的是( C )
解析:过滤是常用的物质分离方法,适用于固液分离,C项符合题意;A项和B项均为浸取,D项为溶液的转移,A项、B项、D项均不符合题意。
6.下列关于蒸发皿的使用操作正确的是( A )
A.用酒精灯火焰的外焰部分直接加热蒸发皿底部
B.蒸发液体时,边加热边用玻璃棒不断搅动蒸发皿里的液体直到把液体完全蒸干
C.将热的蒸发皿用手拿离火焰,放在实验台上
D.将灼热的蒸发皿直接放在冷水中冲洗
解析:
8
蒸发皿是瓷质的受热容器,可以直接加热,A正确;蒸发时边加热边搅动,是为了防止局部温度过高造成液体飞溅,但应加热到有大量固体出现时即停止加热,用余热蒸干,B错;热的蒸发皿不能用手拿,应用坩埚钳夹持,且热的蒸发皿直接放在实验台上,容易烫坏实验台,C错误;灼热的蒸发皿骤冷易炸裂,D错误。
7.NaCl和KNO3的溶解度与温度的关系如图所示。实验室提纯KNO3(含少量NaCl)的过程如图所示。下列叙述正确的是( C )
A.操作Ⅰ是过滤,将杂质分离除去
B.操作Ⅱ是蒸发浓缩、趁热过滤,除去NaCl杂质
C.操作Ⅲ是过滤、洗涤,将KNO3晶体从溶液中分离出来
D.操作Ⅰ~Ⅲ共需要两次过滤
解析:因为KNO3的溶解度随温度变化较大,NaCl的溶解度随温度变化较小,可经过加蒸馏水溶解、蒸发浓缩、冷却结晶、过滤、洗涤、干燥等一系列操作得到KNO3晶体。操作Ⅰ是溶解,错误;操作Ⅱ是蒸发浓缩、冷却结晶,目的是析出KNO3晶体,错误;操作Ⅲ是过滤、洗涤,目的是将KNO3晶体从溶液中分离出来,正确;操作Ⅰ~Ⅲ中只有Ⅲ需要过滤,错误。
8.对下列未知盐的稀溶液所含离子的检验中,作出的判断一定正确的是( A )
A.当加入氯化钡溶液时不产生沉淀,重新加入硝酸银溶液时,有不溶于稀硝酸的白色沉淀生成,可判定含有Cl-
B.加入硝酸钡溶液有白色沉淀生成,再加稀盐酸酸化沉淀不消失,可判定含有SO
C.加入NaOH溶液,有白色沉淀产生,可判定含有Mg2+
D.加入盐酸后有无色气体逸出,此气体能使澄清石灰水变浑浊,可判定含有CO
解析:A项中加氯化钡不产生沉淀,说明溶液中没有SO、SO、CO、PO、Ag+等,加入硝酸银产生白色沉淀,一定含有氯离子,A判断正确;B项中加硝酸钡产生白色沉淀,可能有SO、SO、CO、PO离子,加稀盐酸酸化沉淀不消失,排除了CO、PO离子,硫酸钡不溶于盐酸和硝酸,亚硫酸钡能溶于盐酸,也溶于硝酸,但该溶液中先加入了硝酸钡后加盐酸,溶液中就有了硝酸,可把亚硫酸钡氧化为不溶于硝酸的硫酸钡,因此该待测液中可能只含有SO
8
,也可能只含有SO,还可能既含有SO又含有SO,所以B项判断不正确;C项中加入NaOH溶液能产生白色沉淀的离子并非只有Mg2+,Al(OH)3、Zn(OH)2等也是白色难溶的物质,所以C项不正确;D项中也可能是含碳酸氢根离子所致,故判断含有CO是片面的,D项不正确。
9.提纯含有少量Ba(NO3)2杂质的KNO3溶液,可以使用的方法为( D )
A.加入过量的Na2CO3溶液,过滤,向滤液中滴加适量的稀硝酸
B.加入过量的K2SO4溶液,过滤,向滤液中滴加适量的稀硝酸
C.加入过量的Na2SO4溶液,过滤,向滤液中滴加适量的稀硝酸
D.加入过量的K2CO3溶液,过滤,向滤液中滴加适量的稀硝酸
解析:杂质离子为Ba2+,可加CO或SO,使之形成沉淀除去,但为了不引入新的杂质,需用钾盐,可选用K2CO3溶液,过量的K2CO3滴加适量稀硝酸可除去,若使用K2SO4,则在后续步骤中无法除去过量的K2SO4。
10.欲除去某溶液里混有的少量杂质,下列做法中不正确的是(括号内的物质为杂质)( B )
A.NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,加适量盐酸,加热
B.KNO3溶液(AgNO3):加入过量KCl溶液,过滤
C.NaCl溶液(Br2):加CCl4,萃取、分液
D.碘单质(NaCl):加热升华后,再凝华
解析:BaCl2和Na2CO3反应生成BaCO3沉淀,过滤后,过量的Na2CO3可与盐酸反应被除去,加热可除去剩余的HCl,A项正确;KCl过量,引入新杂质,应加入适量的KCl溶液,B项错误;Br2易溶于CCl4,可用萃取、分液的方法分离,C项正确;I2易升华,NaCl难分解,D项正确。
11.下列实验操作中,正确的是( D )
8
解析:A项,移开加热的蒸发皿要用坩埚钳夹持,否则会把手烫伤;B项,给试管加热,不能把试管口堵上,易发生危险;C项,向试管中滴加液体时,胶头滴管应竖直放在试管口的正上方,而不能插入到试管中;D项正确。
12.要除去下列四种物质中的少量杂质(括号内物质为杂质)。
甲:CaCO3(Na2CO3) 乙:NaOH(Na2CO3)
丙:KCl(KHCO3) 丁:炭粉(氧化铜)
可选用的试剂及操作方法有:
①加适量盐酸,搅拌,过滤
②加适量水,搅拌,过滤
③加适量盐酸,蒸发
④溶解,加适量石灰水,过滤,蒸发
下列组合正确的是( A )
A.甲—②,乙—④ B.乙—③,丙—③
C.丙—①,丁—② D.丙—③,丁—④
二、非选择题(共52分)
13.(10分)除去下列物质中混有的少量杂质(杂质不要求回收),把适当的试剂、操作方法的序号写在相应的括号内。
a.加适量盐酸、过滤 b.加适量水、过滤、蒸发 c.加适量水、过滤 d.加热(高温或灼烧) e.加适量盐酸、蒸发 f.冷却热的饱和溶液、过滤
(1)碳酸钙中混有少量的碳酸钠 ( c )
(2)氯化钾粉末中混有碳酸钾 ( e )
8
(3)氧化钙中混有少量的碳酸钙 ( d )
(4)二氧化锰中混有少量的炭粉 ( d )
(5)硝酸钾中混有少量的食盐 ( f )
解析:(1)中利用CaCO3不溶于水,Na2CO3易溶于水,加水,过滤干燥即可除杂。
(2)中KCl和K2CO3均易溶于水,故不能用过滤法分离;可用盐酸反应后,再将溶液蒸发即得到氯化钾晶体。
(3)中利用高温分解法,使CaCO3分解除去并生成CaO。
(4)中二者均不溶于水,可利用炭粉易燃方法,选用d。
(5)中利用二者溶解度随温度变化的差异,采用结晶法分离除杂。
14.(16分)为除去食盐固体中混有的少量CaCl2,得到纯净的食盐晶体,进行下面的实验。
(1)请把实验操作步骤或所需仪器填写在横线上。
(2)简要回答下列问题:
Ⅰ.实验步骤②的化学方程式为:
CaCl2+Na2CO3===CaCO3↓+2NaCl。
Ⅱ.实验步骤④中滴加某溶液至中性的目的是什么?
除去溶液中的CO。
8
Ⅲ.玻璃棒是一种常用仪器。在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的作用。
溶解时:搅拌,加速溶解;
过滤时:引流,使待滤液体沿玻璃棒流入漏斗,防止外洒;
蒸发时:搅拌,防止因局部过热,液滴或晶体飞溅。
Ⅳ.实验步骤⑤的操作方法是将所得溶液加热蒸发,当剩有少量水时停止加热,同时用玻璃棒不断搅拌,这样操作的理由是充分利用余热,防止温度过高使晶体飞溅。
解析:除去食盐固体中的CaCl2应选择Na2CO3溶液(除Ca2+),实验操作中不能使用K2CO3(引入了K+)等。实验操作流程为:
15.(14分)为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某同学设计如下实验方案:
(1)操作①为(加水)溶解。
(2)操作②~④加入的试剂可以为Ba(NO3)2、K2CO3、KOH[或KOH、Ba(NO3)2、K2CO3或Ba(NO3)2、KOH、K2CO3]。
(3)如何判断SO已除尽,简述实验操作:取少许滤液,向其中加入少量Ba(NO3)2溶液,若不变浑浊,表明SO已除尽。
(4)实验过程中产生的多次沉淀不需要(填“需要”或“不需要”)多次过滤,理由是生成的沉淀可一次性过滤,如果分步过滤会使操作复杂化。
(5)该同学设计的实验方案不严密(填“严密”或“不严密”),理由是调节溶液的pH不能用盐酸,应用硝酸,否则会引入Cl-。
解析:(1)实验要在溶液中进行,故首先要将试剂溶解。(2)SO可用Ba2+除去,Mg2+可用OH-除去。为了不引入新杂质,可分别选用Ba(NO3)2、KOH。过量的Ba(NO3)2可用K2CO3除去。Ba(NO3)2必须在加入K2CO3之前加入,而KOH可在加入Ba(NO3)2之前或在加入K2CO3之后或在Ba(NO3)2和K2CO3中间加入。(3)如果SO已除尽,则滤液中不含SO
8
,向滤液中加入可溶性钡盐,没有白色沉淀生成。(4)生成的沉淀可一次性过滤,如果分步过滤会使操作复杂化。(5)调节溶液的pH不能用盐酸,而应该用硝酸,否则会引入Cl-。
16.(12分)过滤与蒸发是常用的物质分离与提纯的方法,试用你掌握的有关知识完成下列问题:
(1)关于过滤操作的说法中,错误的是C。
A.玻璃棒下端要靠在三层滤纸处
B.滤纸边缘低于漏斗边缘,多余部分要剪去,并用水润湿贴紧,不留气泡
C.过滤时将液体沿玻璃棒注入漏斗,并使液面高于滤纸边缘
D.漏斗下端紧靠烧杯内壁
(2)实验室进行NaCl溶液蒸发时,一般有以下操作过程,其正确的操作顺序为B。
①放置酒精灯 ②固定铁圈位置 ③放上蒸发皿 ④加热搅拌 ⑤停止加热,用余热蒸干
A.②③④⑤① B.①②③④⑤
C.②③①④⑤ D.②①③④⑤
熄灭酒精灯停止加热的根据是C。
A.蒸发皿中恰好无水
B.蒸发皿中刚刚产生白色固体
C.蒸发皿中产生了较多的固体
(3)对黄海海水每次取20 g,严格按照过滤、蒸发、冷却、称量、计算的实验步骤规范操作,连续实验三次,算得平均值得固态盐a g。该海水中含氯化钠的质量分数为<(填“>”“<”或“=”)5a%。
解析:(1)玻璃棒下端要靠在三层滤纸处,目的是防止玻璃棒捅破滤纸,故A项正确;滤纸边缘低于漏斗边缘,并用水湿润,且不留气泡的原因是保证液体不从漏斗与滤纸之间流下,故B项正确,C项错误;漏斗下端紧靠烧杯内壁,其目的是防止液体溅出,故D项正确。
(2)在进行NaCl溶液蒸发时,根据题意应先放置酒精灯,然后根据酒精灯的高度来调整铁圈的位置,接下来放上蒸发皿,加入NaCl溶液进行加热,不断搅拌,当剩余少量液体时,停止加热,用余热蒸干。
因氯化钠的溶解度受温度影响不大,通过蒸发使氯化钠从溶液中析出,要待出现较多固体(实际上是大部分的水已蒸发)时停止加热,利用蒸发皿的余热使溶液蒸干。
(3)海水中还含有少量的CaCl2、MgCl2等易溶性的物质,在蒸发时,它们也与NaCl一同结晶析出,成为NaCl中的杂质。
8
相关文档
- 高中化学必修2同步巩固练习解析:第12021-07-0611页
- 四川省南充市2019-2020学年高二下2021-07-064页
- 2018届一轮复习人教版化学能与热能2021-07-0622页
- 2019-2020学年天津市静海区四校(第2021-07-066页
- 湖南省长沙市雅礼中学2019届高三下2021-07-0623页
- 辽宁省大连市长兴岛经济区长兴岛高2021-07-0619页
- 2019届高考化学一轮复习 有机物的2021-07-066页
- 2021高考化学一轮复习课时规范练202021-07-069页
- 广东省阳春市第一中学2019-2020学2021-07-0620页
- 2019-2020高中化学(人教版 选修4)练2021-07-067页