- 637.92 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020届新课标Ⅱ卷冲刺高考考前预热卷(一)
化学试题卷
考生注意:
1.本卷共100分,考试时间50分钟。
2. 答卷前,考生务必将自己的姓名、考生号、考场号和座位号填写在答题卡上。
3. 不得在本卷上答题,请将答案填写在答题卡指定区域。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 P 31 S 32 Cl 35.5 Cu 64 Zn 65
一、选择题:本大题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.宋应星所著《天工开物》被外国学者誉为“17世纪中国工艺百科全书”。下列说法不正确的是( )。
A.“凡白土曰垩土,为陶家精美启用”中的“陶”是一种传统硅酸盐材料
B.“凡火药,硫为纯阳,硝为纯阴”中的“硫”指的是硫黄,“硝”指的是硝酸
C.“烧铁器淬于胆矾水中,即成铜色也”该过程中反应的类型为置换反应
D.“每红铜六斤,入倭铅四斤,先后入罐熔化,冷定取出,即成黄铜”中的黄铜是合金
8.下列分子中的所有碳原子不可能在同一平面上的是( )。
A. B.
C. D.
9.设NA代表阿伏加德罗常数的值,N表示粒子数。下列叙述正确的是( )
A.2.24 L CH4中含有的C—H键数为0.4NA
B.将1 mol Cl2通入水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA
C.将CO2通过Na2O2使其质量增加a g时,反应转移的电子数为aNA/44
D.3.0 g含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA
10. A、B、C均为短周期元素,在周期表中所处的相对位置如图所示,B的气态氢化物是工业上合成硝酸的重要原料。下列有关说法正确的是( )。
A.B和C两原子间可以形成离子键
B.A的氧化物在常温下为气体
C.原子半径:A>B>C
D.最高价氧化物对应水化物的酸性:B>A
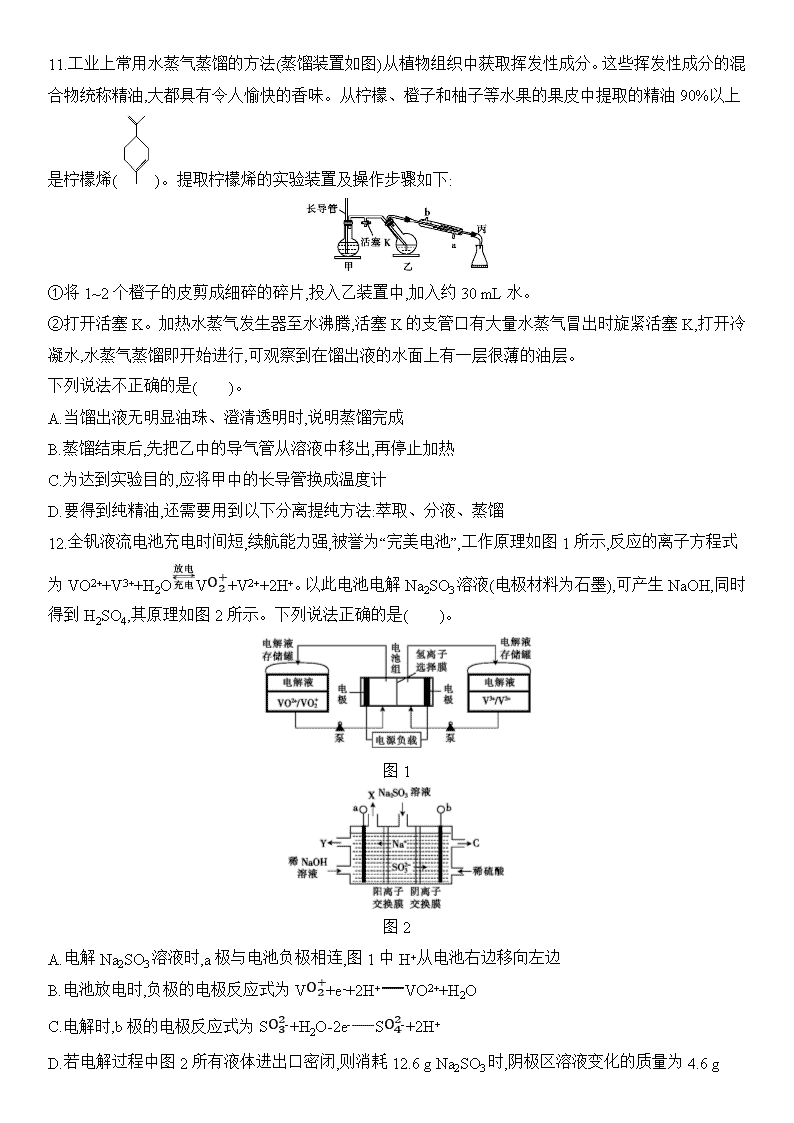
11.工业上常用水蒸气蒸馏的方法(蒸馏装置如图)从植物组织中获取挥发性成分。这些挥发性成分的混合物统称精油,大都具有令人愉快的香味。从柠檬、橙子和柚子等水果的果皮中提取的精油90%以上是柠檬烯()。提取柠檬烯的实验装置及操作步骤如下:
①将1~2个橙子的皮剪成细碎的碎片,投入乙装置中,加入约30 mL水。
②打开活塞K。加热水蒸气发生器至水沸腾,活塞K的支管口有大量水蒸气冒出时旋紧活塞K,打开冷凝水,水蒸气蒸馏即开始进行,可观察到在馏出液的水面上有一层很薄的油层。
下列说法不正确的是( )。
A.当馏出液无明显油珠、澄清透明时,说明蒸馏完成
B.蒸馏结束后,先把乙中的导气管从溶液中移出,再停止加热
C.为达到实验目的,应将甲中的长导管换成温度计
D.要得到纯精油,还需要用到以下分离提纯方法:萃取、分液、蒸馏
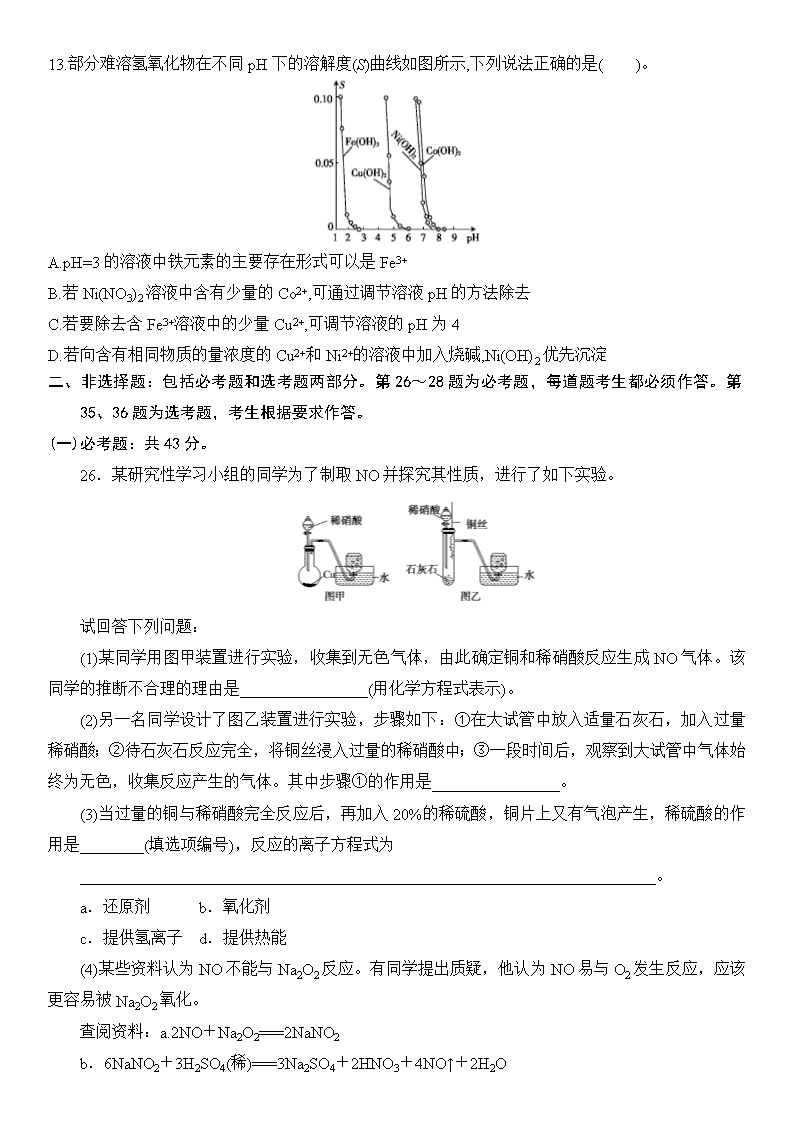
12.全钒液流电池充电时间短,续航能力强,被誉为“完美电池”,工作原理如图1所示,反应的离子方程式为VO2++V3++H2OVO2++V2++2H+。以此电池电解Na2SO3溶液(电极材料为石墨),可产生NaOH,同时得到H2SO4,其原理如图2所示。下列说法正确的是( )。
图1
图2
A.电解Na2SO3溶液时,a极与电池负极相连,图1中H+从电池右边移向左边
B.电池放电时,负极的电极反应式为VO2++e-+2H+VO2++H2O
C.电解时,b极的电极反应式为SO32-+H2O-2e-SO42-+2H+
D.若电解过程中图2所有液体进出口密闭,则消耗12.6 g Na2SO3时,阴极区溶液变化的质量为4.6 g
13.部分难溶氢氧化物在不同pH下的溶解度(S)曲线如图所示,下列说法正确的是( )。
A.pH=3的溶液中铁元素的主要存在形式可以是Fe3+
B.若Ni(NO3)2溶液中含有少量的Co2+,可通过调节溶液pH的方法除去
C.若要除去含Fe3+溶液中的少量Cu2+,可调节溶液的pH为4
D.若向含有相同物质的量浓度的Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀
二、非选择题:包括必考题和选考题两部分。第26~28题为必考题,每道题考生都必须作答。第35、36题为选考题,考生根据要求作答。
(一)必考题:共43分。
26.某研究性学习小组的同学为了制取NO并探究其性质,进行了如下实验。
试回答下列问题:
(1)某同学用图甲装置进行实验,收集到无色气体,由此确定铜和稀硝酸反应生成NO气体。该同学的推断不合理的理由是________________(用化学方程式表示)。
(2)另一名同学设计了图乙装置进行实验,步骤如下:①在大试管中放入适量石灰石,加入过量稀硝酸;②待石灰石反应完全,将铜丝浸入过量的稀硝酸中;③一段时间后,观察到大试管中气体始终为无色,收集反应产生的气体。其中步骤①的作用是________________。
(3)当过量的铜与稀硝酸完全反应后,再加入20%的稀硫酸,铜片上又有气泡产生,稀硫酸的作用是________(填选项编号),反应的离子方程式为
________________________________________________________________________。
a.还原剂 b.氧化剂
c.提供氢离子 d.提供热能
(4)某些资料认为NO不能与Na2O2反应。有同学提出质疑,他认为NO易与O2发生反应,应该更容易被Na2O2氧化。
查阅资料:a.2NO+Na2O2===2NaNO2
b.6NaNO2+3H2SO4(稀)===3Na2SO4+2HNO3+4NO↑+2H2O
c.酸性条件下,NO能被MnO氧化成NO
该同学利用图丙中装置来探究NO与Na2O2的反应(装置可重复使用)。
①装置连接的顺序为:A→________,装置E的作用是
________________________________________________________________________。
②充分反应后,检验D装置中是否生成了NaNO2的实验操作是
________________________________________________________________________
________________________________________________________________________。
27. “低碳经济”备受关注,CO2的有效开发利用成为科学家研究的重要课题。
(1)已知:CO2(g)+2H2(g)C(s)+2H2O(g)
ΔH=-90.0 kJ·mol-1;H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1;C(s)的燃烧热ΔH=-394.0 kJ·mol-1。
则表示H2燃烧热的热化学方程式为______________________。
(2)在0.1 MPa、Ru/TiO2催化下,将H2和CO2按投料比n(H2):n(CO2)=4:1置于恒压密闭容器中发生反应:
反应Ⅰ CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH1
反应Ⅱ CO2(g)+H2(g)CO(g)+H2O(g) ΔH2
测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示。
(选择性:转化的CO2中生成CH4或CO的百分比)
①反应Ⅰ的ΔH1________(填“>”“<”或“=”)0;理由是________________。
②温度过低或过高均不利于反应Ⅰ的进行,原因是________________。
③350 ℃时,反应Ⅰ的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
④为减少CO在产物中的比率,可采取的措施有________(列举一条)。
(3)为探究反应Ⅰ的反应速率与浓度的关系,向恒容密闭容器中通入浓度均为1.0 mol·L-1的H2与CO2。根据相关数据绘制出反应速率与浓度的关系曲线:v正~c(CO2)和v逆~c(H2O)。
则曲线v正~c(CO2)对应的是图3中的曲线________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为________(填字母,下同)。曲线乙对应的平衡点可能为________。
28.氮化钙(Ca3N2)是一种重要的化学试剂。某化学兴趣小组拟制备氮化钙并测定产品纯度。
已知:①氮化钙极易与水反应;②实验室在加热条件下用饱和NaNO2溶液和饱和(NH4)2SO4溶液混合制备N2;③焦性没食子酸溶液用于吸收少量O2。
I.制备氮化钙。
他们选择下列装置设计实验(装置可重复使用):
(1)实验室将钙保存在________中(填物质名称)。氮化钙中所含化学键类型是________________。
(2)气体从左至右,装置连接顺序为________。(填代号)
(3)写出A中发生反应的化学方程式:
________________________________________________________________________。
(4)用化学方法检验氮化钙(Ca3N2)产品中是否混有Ca,设计实验方案:
________________________________________________________________________
________________________________________________________________________。
Ⅱ.测定产品纯度。
利用如图装置测定氮化钙产品纯度(杂质不产生气体,氨气不溶于煤油)。
(5)当产品与蒸馏水完全反应后,冷却至室温、调平液面、读数。调平液面的操作是
________________________________________________________________________。
(6)取产品质量为w g,开始量气管读数为V1 mL,最终量气管读数为V2 mL(折合成标准状况),则该样品纯度为________________________(用代数式表示)。如果开始仰视刻度线,终点时俯视刻度线,则测得结果________(填“偏高”“偏低”或“无影响”)。
(二)选考题:共15分。请考生从给出的2道化学题中任选一题作答。如果多做,则按第一题计分。
35.[化学——选修3:物质结构与性质](15分)
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为 。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成之比为1∶3的化合物E,E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566 nm,F的化学式为 ;晶胞中A原子的配位数为 ;列式计算晶体F的密度(g·cm-3): 。
36.[化学——选修5:有机化学基础](15分)
福莫特罗是一种治疗哮喘病的药物,它的关键中间体(G)的合成路线如下:
回答下列问题:
(1)F的分子式为________,反应①的反应类型为________。
(2)反应④的化学方程式为
________________________________________________________________________。
(3)C能与FeCl3溶液发生显色反应,C的结构简式为________,D中的含氧官能团为________。
(4)B的同分异构体(不含立体异构)中能同时满足下列条件的共有________种。
a.能发生银镜反应
b.能与NaOH溶液发生反应
c.含有苯环结构
其中核磁共振氢谱显示为4组峰,且峰面积比为3:2:2:1的是________(填结构简式)。
(5)参照G的合成路线,设计一种以为起始原料(无机试剂任选)制备的合成路线
________________________________________________________________________。
参考答案
7
8
9
10
11
12
13
B
B
D
D
C
C
C
26.(1)3NO2+H2O===2HNO3+NO
(2)石灰石与稀硝酸反应生成的CO2可将装置中的空气排出,防止对实验造成干扰
(3)c(2分) 3Cu+8H++2NO===3Cu2++2NO↑+4H2O
(4)①B→C→B→D→E 吸收NO防止污染 ②取装置D中反应后的少量固体于试管中,加入稀硫酸,若产生无色气体,且该无色气体在试管口上方变为红棕色,则证明生成了NaNO2
27.(1)H2(g)+O2(g)===H2O(l)
ΔH=-286.0 kJ·mol-1
(2)①< 反应Ⅰ在350 ℃达到平衡状态后,随温度升高CO2的平衡转化率降低,所以该反应是放热反应 ②温度过低,化学反应速率慢;温度过高,反应Ⅰ向逆反应方向进行且CH4的选择性减小 ③2.89×104(MPa)-2 ④降低温度或增大压强
(3)乙 D C
28.Ⅰ.(1)煤油(1分) 离子键
(2)A、D、C、B、C
(3)2NaNO2+(NH4)2SO4Na2SO4+2N2↑+4H2O
(4)取少量产品溶于足量的蒸馏水中,将产生的气体依次通过足量的浓硫酸、赤热的氧化铜粉末,若黑色粉末变成红色,则原产品中含有钙,否则不含钙)
Ⅱ.(5)上下移动水准瓶
(6)% 偏低
35 (1)O 1s22s22p63s23p3{或[Ne]3s23p3}
(2)O3 O3相对分子质量较大,范德华力大 分子晶体 离子晶体
(3)三角锥形 sp3
(4)V形 4 2Cl2+2Na2CO3+H2OCl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3Cl2O+CO2+2NaCl)
(5)Na2O 8 4×62 g·mol-1(0.566×10-7cm)3×6.02×1023mol-1=2.27 g·cm-3
36:
(1)C15H12NO4Br 取代反应
(2)
(3) 硝基、羟基、羰基
(4)17
(5)