- 67.07 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
Z
高中化学必修 2 知识点归纳总结
第一单元 原子核外电子排布与元素周期律
一、原子结构
质子( Z 个)
原子核 注意:
中子( N个) 质量数 (A) =质子数 (Z) +中子数 (N)
1. 原子数 A X 原子序数 =核电荷数 =质子数 =原子的核外电子
核外电子( Z 个)
★熟背前 20 号元素,熟悉 1~20 号元素原子核外电子的排布:
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca
2. 原子核外电子的排布规律: ①电子总是尽先排布在能量最低的电子层里; ②各电子层最多
容纳的电子数是 2n2
;③最外层电子数不超过 8 个(K 层为最外层不超过 2 个),次外层不超
过 18 个,倒数第三层电子数不超过 32 个。
电子层: 一(能量最低) 二 三 四 五 六 七
对应表示符号: K L M N O P Q
3. 元素、核素、同位素
元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。 ( 对于原子来说 )
二、元素周期表
1. 编排原则:
①按原子序数递增的顺序从左到右排列
②将电子层数相同...... 的各元素从左到右排成一横行 ..。(周期序数=原子的电子层数)
③把最外层电子数相同........ 的元素按电子层数递增的顺序从上到下排成一纵行 ..。
主族序数=原子最外层电子数
2. 结构特点:
核外电子层数 元素种类
第一周期 1 2 种元素
短周期 第二周期 2 8 种元素
周期 第三周期 3 8 种元素
元 (7 个横行) 第四周期 4 18 种元素
素 (7 个周期) 第五周期 5 18 种元素
周 长周期 第六周期 6 32 种元素
期 第七周期 7 未填满(已有 26 种元素)
表 主族:Ⅰ A~Ⅶ A共 7 个主族
族 副族:Ⅲ B~Ⅶ B、Ⅰ B~Ⅱ B,共 7 个副族
(18 个纵行) 第Ⅷ族:三个纵行,位于Ⅶ B 和Ⅰ B 之间
(16 个族) 零族:稀有气体
三、元素周期律
1. 元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)
随着核电荷数的递增而呈周期性变化的规律。 元素性质的周期性变化实质是元素原子核外电 ..........
2
子排布的周期性变........ 化 .的必然结果。
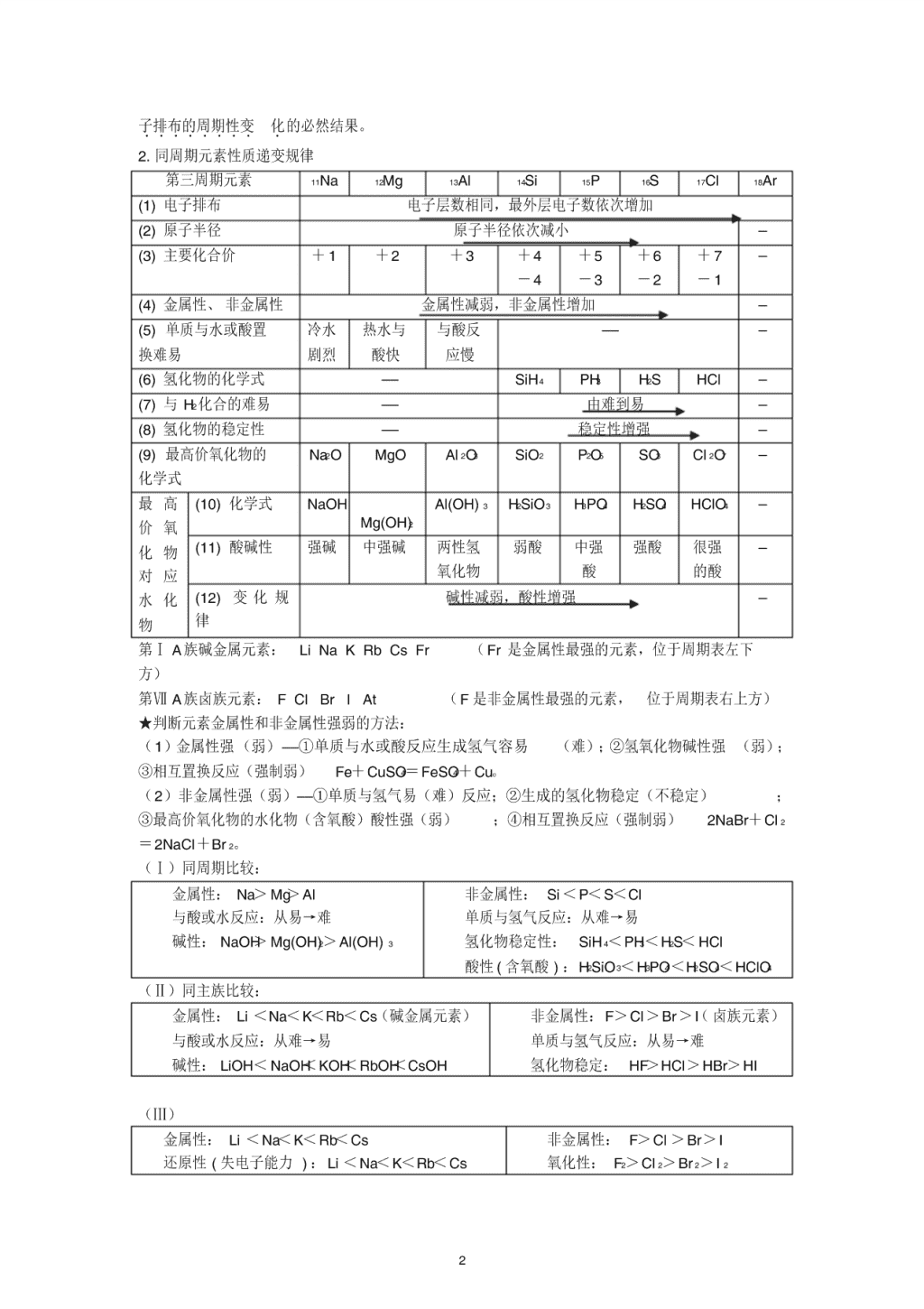
2. 同周期元素性质递变规律
第三周期元素 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
(1) 电子排布 电子层数相同,最外层电子数依次增加
(2) 原子半径 原子半径依次减小 —
(3) 主要化合价 + 1 +2 +3 +4
-4
+5
-3
+6
-2
+ 7
- 1
—
(4) 金属性、 非金属性 金属性减弱,非金属性增加 —
(5) 单质与水或酸置
换难易
冷水
剧烈
热水与
酸快
与酸反
应慢
—— —
(6) 氢化物的化学式 —— SiH4 PH3 H2S HCl —
(7) 与 H2 化合的难易 —— 由难到易 —
(8) 氢化物的稳定性 —— 稳定性增强 —
(9) 最高价氧化物的
化学式
Na2O MgO Al 2O3 SiO2 P2O5 SO3 Cl 2O7 —
最 高
价 氧
化 物
对 应
水 化
物
(10) 化学式 NaOH
Mg(OH)2
Al(OH) 3 H2SiO3 H3PO4 H2SO4 HClO4 —
(11) 酸碱性 强碱 中强碱 两性氢
氧化物
弱酸 中强
酸
强酸 很强
的酸
—
(12) 变 化 规
律
碱性减弱,酸性增强 —
第Ⅰ A族碱金属元素: Li Na K Rb Cs Fr (Fr 是金属性最强的元素,位于周期表左下
方)
第Ⅶ A族卤族元素: F Cl Br I At (F 是非金属性最强的元素, 位于周期表右上方)
★判断元素金属性和非金属性强弱的方法:
(1)金属性强 (弱)——①单质与水或酸反应生成氢气容易 (难);②氢氧化物碱性强 (弱);
③相互置换反应(强制弱) Fe+CuSO4=FeSO4+Cu。
(2)非金属性强(弱)——①单质与氢气易(难)反应;②生成的氢化物稳定(不稳定) ;
③最高价氧化物的水化物(含氧酸)酸性强(弱) ;④相互置换反应(强制弱) 2NaBr+Cl 2
=2NaCl+Br 2。
(Ⅰ)同周期比较:
金属性: Na> Mg>Al
与酸或水反应:从易→难
碱性: NaOH> Mg(OH)2>Al(OH) 3
非金属性: Si <P<S<Cl
单质与氢气反应:从难→易
氢化物稳定性: SiH 4<PH3<H2S< HCl
酸性 ( 含氧酸 ) :H2SiO3<H3PO4 <H2SO4<HClO4
(Ⅱ)同主族比较:
金属性: Li <Na<K<Rb<Cs(碱金属元素)
与酸或水反应:从难→易
碱性: LiOH< NaOH<KOH<RbOH<CsOH
非金属性: F>Cl>Br>I( 卤族元素)
单质与氢气反应:从易→难
氢化物稳定: HF>HCl>HBr>HI
(Ⅲ)
金属性: Li <Na<K<Rb<Cs
还原性 ( 失电子能力 ) : Li <Na<K<Rb<Cs
非金属性: F>Cl >Br>I
氧化性: F2>Cl 2>Br 2>I 2
3
氧化性 ( 得电子能力 ) :Li +>Na+ >K+>Rb+>Cs
+
还原性: F-<Cl -<Br -<I -
酸性 ( 无氧酸 ) :HF<HCl<HBr< HI
比较粒子 (包括原子、离子 ) 半径的方法 (“三看” ) :(1)先比较电子层数,电子层数多的半
径大。
(2)电子层数相同时,再比较核电荷数,核电荷数多的半径反而小。
元素周期表的应用
1、元素周期表中共有个 7 周期, 3 是短周期, 3 是长周期。其中第 7 周
期也被称为不完全周期。
2、在元素周期表中, ⅠA-ⅦA 是主族元素,主族和 0 族由短周期元素、 长周
期元素 共同组成。 ⅠB - ⅦB 是副族元素,副族元素完全由长周期元素 构成。
3、元素所在的周期序数 = 电子层数 ,主族元素所在的族序数 = 最外层电子数, 元素周
期表是元素周期律的具体表现形式。在同一周期中,从左到右,随着核电荷数的递增,原子
半径逐渐减小, 原子核对核外电子的吸引能力逐渐增强, 元素的金属性逐渐减弱, 非金属性
逐渐增强 。在同一主族中,从上到下,随着核电荷数的递增,原子半径逐渐增大 ,电子
层数逐渐增多, 原子核对外层电子的吸引能力逐渐 减弱 ,元素的金属性逐渐增强, 非金属
性逐渐 减弱 。
4、元素的结构决定了元素在周期表中的位置,元素在周期表中位置的反映了原子的结构和
元素的性质特点。我们可以根据元素在周期表中的位置,推测元素的结构,预测 元素的性
质 。元素周期表中位置相近的元素性质相似,人们可以借助元素周期表研究合成有特定
性质的新物质。例如,在金属和非金属的分界线附近寻找 半导体 材料,在过渡元素中
寻找各种优良的 催化剂 和耐高温、耐腐蚀 材料。
第二单元 微粒之间的相互作用
化学键是直接相邻两个或多个原子或离子间强烈的相互作用。
1. 离子键与共价键的比较
键型 离子键 共价键
概念 阴阳离子结合成化合物的静电作用
叫离子键
原子之间通过共用电子对所形成的相互
作用叫做共价键
成键方式 通过得失电子达到稳定结构 通过形成共用电子对达到稳定结构
成键粒子 阴、阳离子 原子
成键元素 活泼金属与活泼非金属元素之间
(特殊: NH4Cl 、NH4NO3 等铵盐只由
非金属元素组成,但含有离子键)
非金属元素之间
离子化合物:由离子键构成的化合物叫做离子化合物。 (一定有离子键,可能有共价键)
共价化合物:原子间通过共用电子对形成分子的化合物叫做共价化合物。 (只有共价键一定
没有离子键)
极性共价键(简称极性键) :由不同种原子形成, A-B型,如, H-Cl 。
共价键
非极性共价键(简称非极性键) :由同种原子形成, A-A型,如, Cl -Cl 。
2. 电子式:
用电子式表示离子键形成的物质的结构与表示共价键形成的物质的结构的不同点: (1)
电荷: 用电子式表示离子键形成的物质的结构需标出阳离子和阴离子的电荷; 而表示共价键
形成的物质的结构不能标电荷。 (2)[ ] (方括号) :离子键形成的物质中的阴离子需用方
括号括起来,而共价键形成的物质中不能用方括号。
3、分子间作用力定义把分子聚集在一起的作用力。由分子构成的物质,分子间作用力是影
4
响物质的熔沸点和 溶解性 的重要因素之一。
4、水具有特殊的物理性质是由于水分子中存在一种被称为氢键的分子间作用力。水分子间
的 氢键 ,是一个水分子中的氢原子与另一个水分子中的氧原子间所形成的分子间作
用力,这种作用力使得水分子间作用力增加,因此水具有较高的 熔沸点。其他一些能形成
氢键的分子有 HF H 2O NH 3 。
项目 离子键 共价键 金属键
概念 阴阳之间的强烈相
互作用
原子通过共用电子对形成的强烈
相互作用
形成化合物 离子化合物 金属单质
判断化学键方法
形成晶体 离子晶体 分子晶体 原子晶体 金属晶体
判断晶体方法
熔沸点 高 低 很高 有的很高有的很低
融化时 破坏作用
力
离子键 物理变化分子间作
用力 化学变化 共价
键
共价键 金属键
硬度导电性
第三单元 从微观结构看物质的多样性
同系物 同位素 同分异构体 同素异形体
概念
组成相似,结构上相
差一个或多个“ CH2”
原子团的有机物
质子数相同中子
属不同的原子互
成称同位素
分 子 式 相 同 结 构
不同的化合物
同一元素形成的不同种
单质
研究
对象
有机化合物之间 原子之间 化合物之间 单质之间
相似点 结构相似通式相同 质子数相同 分子式相同 同种元素
不同点
相差 n 个 CH2原子团
( n≥1)
中子数不同 原子排列不同 组成或结构不同
代表物 烷烃之间 氕、氘、氚 乙醇与二甲醚
正丁烷与异丁烷
O2 与 O3 金刚石与石墨
专题二 化学反应与能量变化
第一单元 化学反应的速率与反应限度
1、化学反应的速率
(1)概念:化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量 (均
5
取正值)来表示。 计算公式: v(B) =
( )c B
t
=
( )n B
V t?
①单位: mol/(L · s) 或 mol/(L · min)
②B 为溶液或气体,若 B 为固体或纯液体不计算速率。
③以上所表示的是平均速率,而不是瞬时速率。
④重要规律: (i )速率比=方程式系数比 (ii )变化量比=方程式系数比
(2)影响化学反应速率的因素:
内因:由参加反应的物质的结构和性质决定的(主要因素) 。
外因:①温度:升高温度,增大速率
②催化剂:一般加快反应速率(正催化剂)
③浓度:增加 C反应物的浓度 ,增大速率(溶液或气体才有浓度可言)
④压强:增大压强,增大速率(适用于有气体参加的反应)
⑤其它因素:如光(射线) 、固体的表面积(颗粒大小) 、反应物的状态(溶剂) 、原
电池等也会改变化学反应速率。
2、化学反应的限度——化学平衡
(1)在一定条件下,当一个可逆反应进行到正向反应速率与逆向反应速率相等时,反
应物和生成物的浓度不再改变,达到表面上静止的一种“平衡状态” ,这就是这个反应所能
达到的限度,即化学平衡状态。
化学平衡的移动受到温度、 反应物浓度、 压强等因素的影响。 催化剂只改变化学反应速
率,对化学平衡无影响。
在相同的条件下同时向正、 逆两个反应方向进行的反应叫做可逆反应。 通常把由反应物
向生成物进行的反应叫做正反应。而由生成物向反应物进行的反应叫做逆反应。
在任何可逆反应中,正方应进行的同时,逆反应也在进行。可逆反应不能进行到底,即
是说可逆反应无论进行到何种程度, 任何物质 (反应物和生成物) 的物质的量都不可能为 0。
(2)化学平衡状态的特征:逆、动、等、定、变。
①逆:化学平衡研究的对象是可逆反应。
②动:动态平衡,达到平衡状态时,正逆反应仍在不断进行。
③等:达到平衡状态时,正方应速率和逆反应速率相等,但不等于 0。即 v 正= v 逆≠ 0。
④定:达到平衡状态时,各组分的浓度保持不变,各组成成分的含量保持一定。
⑤变:当条件变化时,原平衡被破坏,在新的条件下会重新建立新的平衡。
(3)判断化学平衡状态的标志:
① V A(正方向) =VA(逆方向)或 nA(消耗) =nA(生成)(不同方向同一物质比较)
②各组分浓度保持不变或百分含量不变
③借助颜色不变判断(有一种物质是有颜色的)
④总物质的量或总体积或总压强或平均相对分子质量不变 (前提: 反应前后气体的总物质的
量不相等的反应适用,即如对于反应 xA+yB zC,x+y≠z )
第二单元 化学反应中的热量
1、在任何的化学反应中总伴有能量的变化。
原因: 当物质发生化学反应时, 断开反应物中的化学键要吸收能量, 而形成生成物中的
化学键要放出能量。 化学键的断裂和形成是化学反应中能量变化的主要原因。 一个确定的化
学反应在发生过程中是吸收能量还是放出能量, 决定于反应物的总能量与生成物的总能量的
相对大小。 E 反应物总能量> E 生成物总能量, 为放热反应。 E 反应物总能量< E 生成物总能
量,为吸热反应。