- 113.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2017-2018学年新疆石河子第二中学高二上学期第一次月考试卷(化学)
一、选择题(每小题3分,共54分)
1. 下列措施不符合节能减排的是 ( )
A.大力发展火力发电,解决电力紧张问题
B.在屋顶安装太阳能热水器为居民提供生活用热水
C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
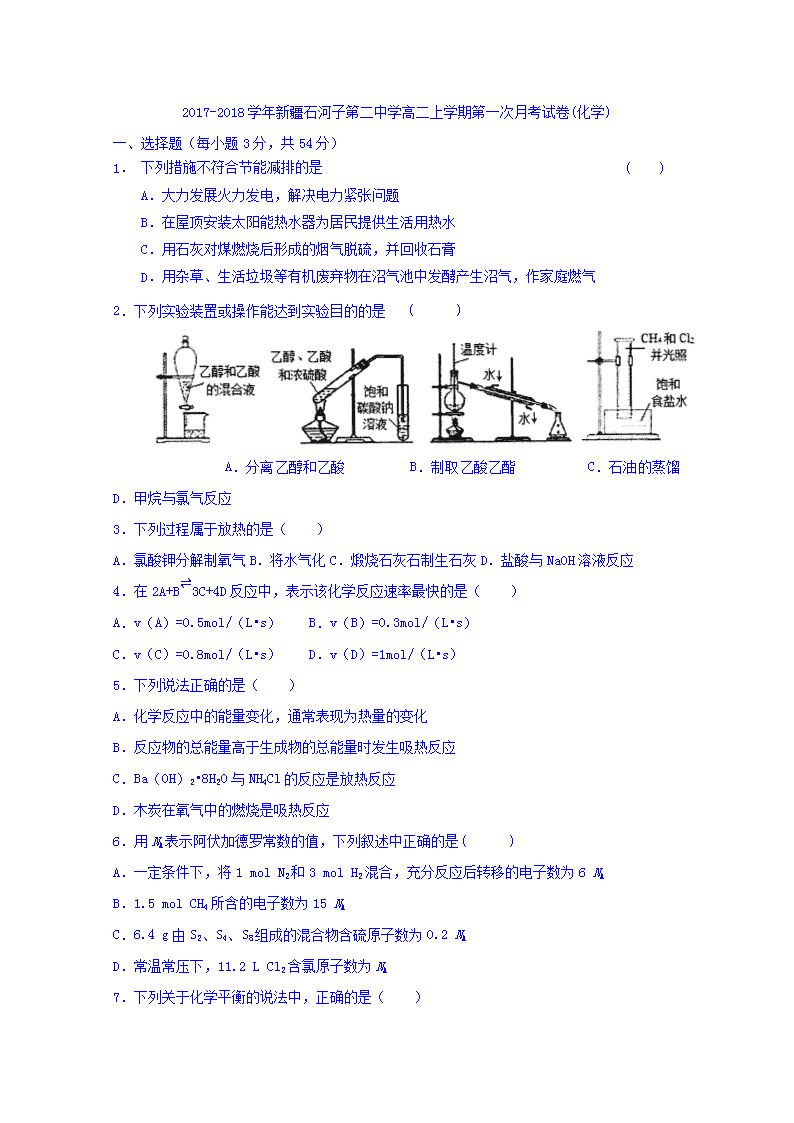
2.下列实验装置或操作能达到实验目的的是 ( )
A.分离乙醇和乙酸 B.制取乙酸乙酯 C.石油的蒸馏 D.甲烷与氯气反应
3.下列过程属于放热的是( )
A.氯酸钾分解制氧气B.将水气化C.煅烧石灰石制生石灰D.盐酸与NaOH溶液反应
4.在2A+B⇌3C+4D反应中,表示该化学反应速率最快的是( )
A.v(A)=0.5mol/(L•s) B.v(B)=0.3mol/(L•s)
C.v(C)=0.8mol/(L•s) D.v(D)=1mol/(L•s)
5.下列说法正确的是( )
A.化学反应中的能量变化,通常表现为热量的变化
B.反应物的总能量高于生成物的总能量时发生吸热反应
C.Ba(OH)2•8H2O与NH4Cl的反应是放热反应
D.木炭在氧气中的燃烧是吸热反应
6.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6 NA
B.1.5 mol CH4所含的电子数为15 NA
C.6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA
D.常温常压下,11.2 L Cl2含氯原子数为NA
7.下列关于化学平衡的说法中,正确的是( )
A.当达到化学平衡时,反应物已完全转化为生成物
B.化学平衡是一定条件下的平衡,当条件改变时,平衡可能会遭到破坏
C.当达到化学平衡时,反应混合物中各成分的浓度相等
D.当达到化学平衡时,正逆反应均已停止
8.下列能用勒夏特列原理解释的是( )
A.高温及加入催化剂都能使合成氨的反应速率加快
B.红棕色的NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡时的混合气体加压后颜色变深
9.下列离子方程式书写正确的是( )
A.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑
B.铁与盐酸反应: Fe + 2H+ ══ Fe3+ + H2 ↑
C.用小苏打治疗胃酸过多: H+ +HCO3-══ H2O + CO2↑
D.Ba(OH)2与稀H2SO4反应: Ba2++OH-+H++SO42-══ BaSO4↓+H2O
10.下列反应过程中,△H>0且△S>0的是( )
A.NH3(g)+HCl(g)=NH4Cl(s) B.CaCO3(s)=CaO(s)+CO2(g)
C.4Al(s)+3O2(g)=2A12O3(s) D.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(1)
11.根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=﹣Q1 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=﹣Q2 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(g)△H=﹣Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3
12.一定温度下,可逆反应N2(g)+3H2(g)⇌2NH3(g)达到平衡状态标志的是( )
A.A、B、C的分子数之比为1:3:2
B.单位时间内生成amol N2,同时生成amolNH3
C.每断裂1molN≡N,同时断裂3molH﹣H
D.每生成1mol N≡N,同时生成6molN﹣H
13.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A.加热B.不用稀硫酸,改用98%的浓硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
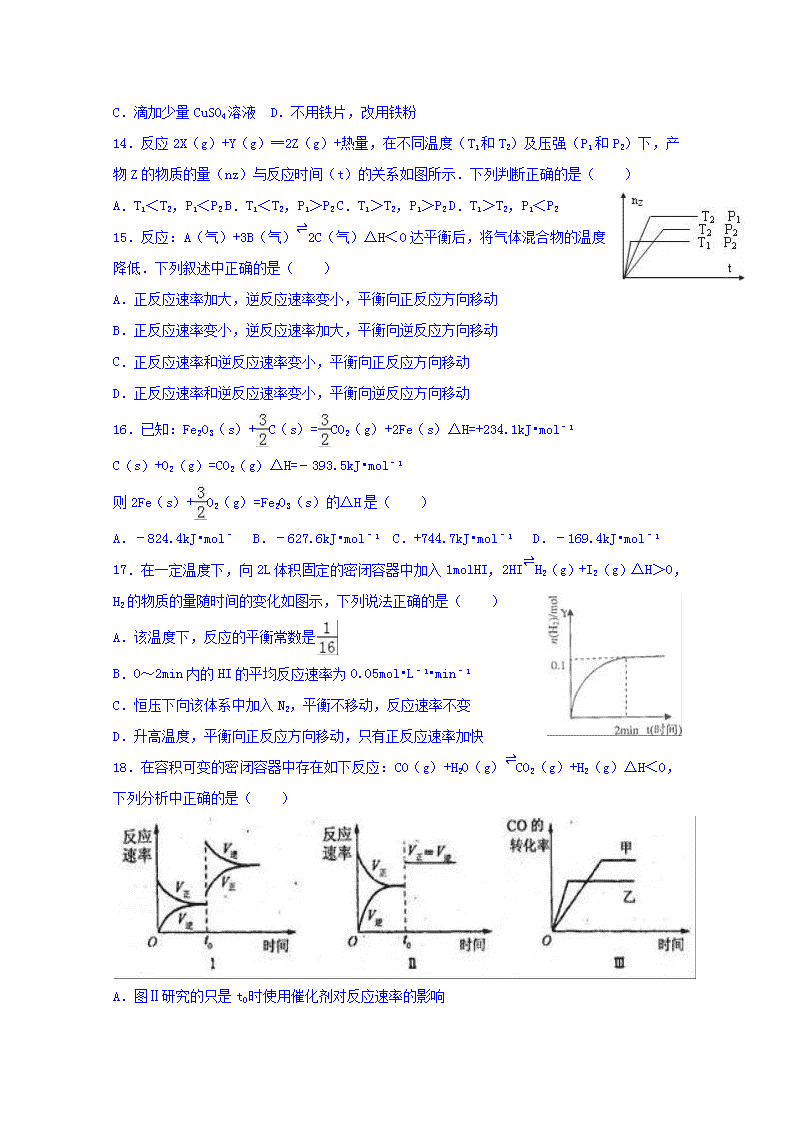
14.反应2X(g)+Y(g)═2Z(g)+热量,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )
A.T1<T2,P1<P2 B.T1<T2,P1>P2 C.T1>T2,P1>P2 D.T1>T2,P1<P2
15.反应:A(气)+3B(气)⇌2C(气)△H<0达平衡后,将气体混合物的温度降低.下列叙述中正确的是( )
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率和逆反应速率变小,平衡向正反应方向移动
D.正反应速率和逆反应速率变小,平衡向逆反应方向移动
16.已知:Fe2O3(s)+C(s)=CO2(g)+2Fe(s)△H=+234.1kJ•mol﹣1
C(s)+O2(g)=CO2(g)△H=﹣393.5kJ•mol﹣1
则2Fe(s)+O2(g)=Fe2O3(s)的△H是( )
A.﹣824.4kJ•mol﹣ B.﹣627.6kJ•mol﹣1 C.+744.7kJ•mol﹣1 D.﹣169.4kJ•mol﹣1
17.在一定温度下,向2L体积固定的密闭容器中加入1molHI,2HI⇌H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确的是( )
A.该温度下,反应的平衡常数是
B.0~2min内的HI的平均反应速率为0.05mol•L﹣1•min﹣1
C.恒压下向该体系中加入N2,平衡不移动,反应速率不变
D.升高温度,平衡向正反应方向移动,只有正反应速率加快
18.在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H<0,下列分析中正确的是( )
A.图Ⅱ研究的只是t0时使用催化剂对反应速率的影响
B.图Ⅰ研究的是t0时缩小容器体积对反应速率的影响
C.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
D.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
二、填空题(共46分)
19.(6分)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
(1)、反应开始到10s,用Z表示的反应速率 -----------------(2分)
(2)、反应开始到10s时,Y的转化率为------------------(2分)。
(3)、反应的化学方程式为:------------------(2分)。
20(10分).已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l)△H=﹣570kJ/mol
②2H2O(g)=2H2(g)+O2(g)△H=+483.6kJ/mol
③2CO(g)=2C(s)+O2(g)△H=+220.8kJ/mol
④2C(s)+2O2(g)=2CO2(g)△H=﹣787kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是 (2分)(填写序号)
(2)H2的燃烧热为 (2分)
(3)燃烧10g H2生成液态水,放出的热量为 (2分)
(4)C(s)的燃烧热的热化学方程式为 (2分)
(5)H2O(g)=H2O(l)△H= (2分)
21(8分).对于反应3X(g)+Y(g)═Z(g)△H〈0,在其他条件不变时,改变其中一个条件平衡是否移动(填“不移动”“向左”或“向右”):
(1)升高温度: ;(2分)(2)缩小容器的体积: (2分);
(3)体积不变的条件下,加入X: ;(2分)(4)加入催化剂: .(2分)
22.(6分)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式______________________________________.(3分)
(2)1 molN2(g) 与适量H2(g) 起反应生成NH3(g) ,放出92.2kJ热量______________________________________.(3分)
23.下表是稀硫酸与某金属反应的实验数据(8分):
实验
序号
金属质量
/g
金属
状态
c(H2SO4)
/mol•L﹣1
V(H2SO4)
/mL
金属消失
的时间/s
1
0.10
粉末
0.5
50
50
2
0.10
丝
0.8
50
200
3
0. 10
粉末
0.8
50
25
4
0.10
丝
1.0
50
125
分析上述数据,回答下列问题:
(1)实验1和3表明, (1分)对反应速率有影响,能表明这种影响因素的实验还有 (1分).(填实验序号)结论: _______________________.(2分)
(2)本实验中影响反应速率的其他因素还有 ,(1分)其实验序号是 ,(1分)结论 _______________________.(2分)
24.计算(8分)
在恒温恒压下,向体积为2 L密闭容器中充入4mol SO2和2mol O2,发生如下反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0。2min后,反应达到平衡,生成SO3为2mol。
求:(1)0~2 min内v(SO3)?(2分)
(2)平衡后容器中SO2的浓度?(3分)
(3)在此温度下该反应的平衡常数?(3分)
石河子第二中学高二年级第一次月考试卷(化学)
一、选择题(每小题3分,共54分)
题号
1
2
3
4
5
6
7
8
9
答案
A
D
D
B
A
B
B
B
C
题号
10
11
12
13
14
15
16
17
18
答案
B
A
D
B
C
C
A
B
C
二、填空题(共46分)
19.(6分)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
(1)、反应开始到10s,用Z表示的反应速率 0.079(2分)
(2)、反应开始到10s时,Y的转化率为-79%-(2分)。
(3)、反应的化学方程式为:X+Y=2Z(2分)。
20(10分).已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l)△H=﹣570kJ/mol
②2H2O(g)=2H2(g)+O2(g)△H=+483.6kJ/mol
③2CO(g)=2C(s)+O2(g)△H=+220.8kJ/mol
④2C(s)+2O2(g)=2CO2(g)△H=﹣787kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是 1 4(2分)(填写序号)
(2)H2的燃烧热为 285 kJ/mol (2分)
(3)燃烧10g H2生成液态水,放出的热量为 1425 kJ (2分)
(4)C(s)的燃烧热的热化学方程式为 (2分)
(5)H2O(g)=H2O(l)△H= -86.4 kJ(2分)
21(8分).对于反应3X(g)+Y(g)═Z(g)△H〈0,在其他条件不变时,改变其中一个条件平衡是否移动(填“不移动”“向左”或“向右”):
(1)升高温度: 向左 ;(2分)(2)缩小容器的体积:向右 (2分);
(3)体积不变的条件下,加入X:向右 ;(2分)(4)加入催化剂: 不移动 .(2分)
22.(6分)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ
热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式______________________________________.(3分)
(2)1 molN2(g) 与适量H2(g) 起反应生成NH3(g) ,放出92.2kJ热量______________________________________.(3分)
23.下表是稀硫酸与某金属反应的实验数据(8分):
分析上述数据,回答下列问题:
(1)实验1和3表明, 浓度 (1分)对反应速率有影响,能表明这种影响因素的实验还有 2.4 (1分).(填实验序号)结论: ___浓度大,速率大____________________.(2分)
(2)本实验中影响反应速率的其他因素还有 接触面积 ,(1分)其实验序号是 2.3,(1分)结论 ____________面积大,速率大___________.(2分)
24.计算(8分)
在恒温恒压下,向体积为2 L密闭容器中充入4mol SO2和2mol O2,发生如下反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0。2min后,反应达到平衡,生成SO3为2mol。
求:(1)0~2 min内v(SO3)?(2分)0.5 mol/(L•min)
(2)平衡后容器中SO2的浓度?(3分)1 mol/L
(3)在此温度下该反应的平衡常数?(3分)4