- 279.66 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题能力训练9 化学实验基础知识与基本技能
(时间:45分钟 满分:100分)
一、选择题(共7小题,每小题6分,共42分。每小题只有1个选项符合题意)
1.下列说法正确的是( )
A.不慎将酸溅到眼中,应立即用碱液冲洗,边洗边眨眼睛
B.酸式滴定管、碱式滴定管、锥形瓶都是实验室常见的玻璃仪器,它们在使用时都要水洗、润洗
C.除去硬脂酸钠溶液中甘油的方法是往溶液中加入饱和食盐水,过滤
D.常温下,准确称取14.8 g Ca(OH)2,配制100 mL 2.0 mol·L-1的Ca(OH)2溶液
答案:C
解析:A项,不慎将酸溅到眼中,应立即用大量水冲洗,边洗边眨眼睛;B项,锥形瓶不需润洗;C项,加入饱和食盐水,可使硬脂酸钠析出,然后过滤,正确;D项,常温下,Ca(OH)2微溶,不可能配制2.0 mol·L-1的溶液。
2.为实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的是( )
选项
实验目的
主要仪器
试剂
A
分离Br2和CCl4混合物
分液漏斗、烧杯
Br2和CCl4混合物、蒸馏水
B
鉴别葡萄糖和蔗糖
试管、烧杯、酒精灯
葡萄糖溶液、蔗糖溶液、银氨溶液
C
实验室制取H2
试管、带导管的橡皮塞
锌粒、稀硝酸
D
测定NaOH溶液浓度
滴定管、锥形瓶、烧杯
NaOH溶液、0.100 0 mol·L-1盐酸
答案:B
解析:Br2和CCl4互溶,无法通过分液的方法将二者分离,可以采用蒸馏法进行分离,A项错误;葡萄糖分子中有5个羟基和1个醛基,可以用鉴别醛基的方法进行鉴别,加入的试剂可以是银氨溶液或者新制Cu(OH)2等,而蔗糖中没有醛基,B项正确;硝酸具有强氧化性,当与金属反应时不会产生氢气,会随着浓度的变化生成NO2、NO等气体,C项错误;酸碱中和滴定要有指示剂,D项错误。3.下列说法正确的是( )
A.酸碱中和滴定实验中,锥形瓶用蒸馏水洗涤后,需要干燥
B.用湿润的pH试纸测量稀氢氧化钠溶液的pH,测量值偏小
C.可用焰色反应鉴别氯化钠和碳酸钠
D.浓硝酸保存在棕色橡胶塞的试剂瓶中
答案:B
4.下列有关试剂的保存方法,错误的是( )
A.浓硝酸保存在无色玻璃试剂瓶中
B.氢氧化钠溶液保存在带有橡皮塞的玻璃试剂瓶中
C.少量的钠保存在煤油中
D.新制的氯水通常保存在棕色玻璃试剂瓶中
答案:A
解析:浓硝酸见光易分解,应保存在棕色试剂瓶中,A错误;磨口玻璃塞处的二氧化硅易与NaOH溶液反应,生成具有黏性的硅酸钠,使瓶塞不能打开,故盛NaOH溶液的试剂瓶应用橡皮塞,B正确;钠易与空气中的氧气、水蒸气反应,与煤油不反应且其密度比煤油大,保存在煤油中可隔绝空气,防止钠变质,C正确;氯水中的次氯酸见光分解而导致氯水变质,应盛放于棕色试剂瓶中避光保存,D正确。
5.下列有关实验操作的叙述错误的是( )
- 6 -
A.过滤操作中,漏斗的尖端应接触烧杯内壁
B.从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁
C.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
D.向容量瓶中转移液体时,导流用玻璃棒可以接触容量瓶内壁
答案:B
解析:过滤时漏斗的尖端接触烧杯内壁,能防止液体飞溅,A项正确;从滴瓶中取用试剂时,为了防止滴管尖嘴被污染,不能接触试管内壁,应垂直悬空于试管上方滴入,B项错误;滴定接近终点时,滴定管的尖嘴接触锥形瓶内壁可以使悬挂的溶液流入锥形瓶,减小误差,C项正确;向容量瓶中转移溶液时,玻璃棒下端要靠在刻度线以下的容量瓶内壁上,D项正确。
6.下列实验设计能够成功的是( )
A.检验亚硫酸钠样品是否变质:
样品白色沉淀沉淀不溶解说明样品已变质
B.除去粗盐中含有的硫酸钙杂质
粗盐 精盐
C.检验某溶液中是否含有Fe2+
溶液溶液颜色无变化溶液变红色溶液中含有Fe2+
D.证明酸性条件下H2O2的氧化性比I2强:
NaI溶液 溶液变蓝色氧化性:H2O2>I2
答案:C
解析:加入硝酸钡溶液,再加入稀盐酸,相当于引入了稀硝酸,可将BaSO3氧化为BaSO4,沉淀也不溶解,A项错误;先加Na2CO3溶液,再加足量的BaCl2溶液,则过量的Ba2+无法除去,B项错误;将I-氧化为I2的物质也可能是稀硝酸,D项错误。
7.下列除杂方案错误的是( )
选项
被提纯的物质
杂质
除杂试剂
除杂方法
A
NaNO3
CaCO3
蒸馏水
溶解、过滤、蒸发
B
NH4Cl(aq)
Fe3+(aq)
NaOH溶液
过滤
C
Cl2(g)
HCl(g)
饱和食盐水、浓硫酸
洗气
D
Na2CO3(s)
NaHCO3(s)
—
灼烧
答案:B
解析:碳酸钙不溶于水,溶解后过滤,再蒸发即可得到纯净的NaNO3,A项正确;除去NH4Cl中的Fe3+,当加入NaOH溶液时,被提纯的物质NH4Cl也能与NaOH发生反应,我们可加入氨水调节pH至7~8,发生反应的离子方程式为Fe3++3NH3·H2OFe(OH)3↓+3NH4+,B项错误;HCl易溶于水,而氯气难溶于饱和食盐水,所以可用饱和NaCl溶液除去Cl2中的少量HCl,然后再通过浓硫酸对Cl2进行干燥,C项正确;NaHCO3不稳定,加热时分解生成Na2CO3,所以可用加热固体的方法除去Na2CO3固体中的NaHCO3杂质,D项正确。
二、非选择题(共3小题,共58分)
8.(2018全国Ⅱ)(20分)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图,回答下列问题:
- 6 -
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂,其光解反应的化学方程式为2K3[Fe(C2O4)3]2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为 。
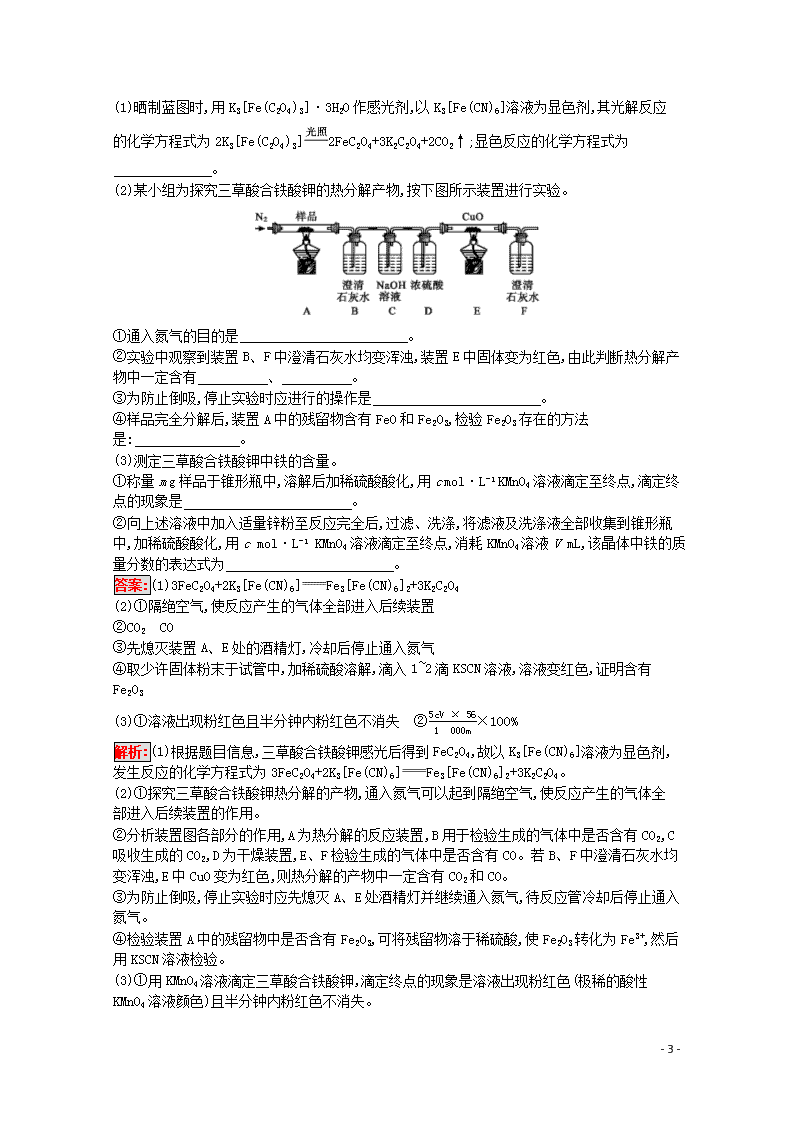
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
①通入氮气的目的是 。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有 、 。
③为防止倒吸,停止实验时应进行的操作是 。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是: 。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀硫酸酸化,用c mol·L-1 KMnO4溶液滴定至终点,滴定终点的现象是 。
②向上述溶液中加入适量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀硫酸酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL,该晶体中铁的质量分数的表达式为 。
答案:(1)3FeC2O4+2K3[Fe(CN)6]Fe3[Fe(CN)6]2+3K2C2O4
(2)①隔绝空气,使反应产生的气体全部进入后续装置
②CO2 CO
③先熄灭装置A、E处的酒精灯,冷却后停止通入氮气
④取少许固体粉末于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,证明含有Fe2O3
(3)①溶液出现粉红色且半分钟内粉红色不消失 ②5cV×561 000m×100%
解析:(1)根据题目信息,三草酸合铁酸钾感光后得到FeC2O4,故以K3[Fe(CN)6]溶液为显色剂,发生反应的化学方程式为3FeC2O4+2K3[Fe(CN)6]Fe3[Fe(CN)6]2+3K2C2O4。
(2)①探究三草酸合铁酸钾热分解的产物,通入氮气可以起到隔绝空气,使反应产生的气体全部进入后续装置的作用。
②分析装置图各部分的作用,A为热分解的反应装置,B用于检验生成的气体中是否含有CO2,C吸收生成的CO2,D为干燥装置,E、F检验生成的气体中是否含有CO。若B、F中澄清石灰水均变浑浊,E中CuO变为红色,则热分解的产物中一定含有CO2和CO。
③为防止倒吸,停止实验时应先熄灭A、E处酒精灯并继续通入氮气,待反应管冷却后停止通入氮气。
④检验装置A中的残留物中是否含有Fe2O3,可将残留物溶于稀硫酸,使Fe2O3转化为Fe3+,然后用KSCN溶液检验。
(3)①用KMnO4溶液滴定三草酸合铁酸钾,滴定终点的现象是溶液出现粉红色(极稀的酸性KMnO4溶液颜色)且半分钟内粉红色不消失。
- 6 -
②该测定原理的离子方程式为2Fe3++Zn2Fe2++Zn2+,5Fe2++MnO4-+8H+5Fe3++Mn2++4H2O。即5Fe2+~MnO4-,故该晶体中铁的质量分数的表达式:
w(Fe)=cmol·L-1×V×10-3L×5×56 g·mol-1mg×100%=5cV×561 000m×100%。
9.(20分)实验室制取乙酸丁酯的实验装置有如图所示两种装置供选用。其有关物质的物理性质如表所示:
乙酸
1-丁醇
乙酸丁酯
熔点/℃
16.6
-89.5
-73.5
沸点/℃
117.9
117
126.3
密度/(g·cm-3)
1.05
0.81
0.88
水溶性
互溶
可溶(9 g/100 g水)
微溶
(1)制取乙酸丁酯的装置应选用 (填“甲”或“乙”);不选另一种装置的理由是 。
(2)酯化反应是一个可逆反应,为提高1-丁醇的利用率,可采取的措施是 。
(3)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,如图所示的操作中,肯定需要的化学操作是 (选填答案编号)。
(4)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须 ;
某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还可能 。
答案:(1)乙 由于反应物(乙酸和1-丁醇)的沸点低于产物乙酸丁酯的沸点,若采用甲装置会造成反应物的大量挥发降低了反应物转化率,乙装置则可以冷凝回流反应物,提高了反应物转化率
(2)增大乙酸浓度
(3)AC
(4)检查是否漏水或堵塞 分液漏斗上口玻璃塞上的凹槽未与漏斗口上的小孔对准(或漏斗内部未与外界大气相通,或玻璃塞未打开)
- 6 -
解析:(1)装置的选择要综合考虑反应条件及反应物、生成物的性质,本题中反应物沸点均低于产物的沸点,因此要考虑冷凝回流。(2)可逆反应提高某一原料利用率的方法是增大另一反应物的浓度。(4)分液漏斗在使用前要检漏,放液时应使漏斗内外压强一致,才能使液体顺利流下。
10.(18分)绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知: 、 。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。
①仪器B的名称是 。
②将下列实验操作步骤正确排序 (填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量A
f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x= (列式表示)。若实验时按a、d次序操作,则使x (填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
①C、D中的溶液依次为 (填标号)。C、D中有气泡冒出,并可观察到的现象分别为 。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2
e.浓硫酸
②写出硫酸亚铁高温分解反应的化学方程式 。
答案:(1)样品中没有Fe3+ Fe2+易被氧化成Fe3+
(2)①干燥管 ②dabfce ③76(m2-m3)9(m3-m1) 偏小
(3)①c、a 产生白色沉淀、褪色 ②2FeSO4Fe2O3+SO2↑+SO3↑
解析:(1)样品溶于水,滴加KSCN溶液,溶液颜色无明显变化,说明样品中不存在Fe3+;通入空气,溶液逐渐变红色,说明Fe2+易被氧气氧化为Fe3+。(2)①B为干燥管;②在反应之前先通入N2,目的是排除装置中的空气,防止Fe2+被空气中的O2氧化,再加热使绿矾隔绝空气分解,然后熄灭酒精灯使其在N2中冷却到室温,再关闭K1、K2
- 6 -
,最后称量A,根据前后质量变化,可得出失去的结晶水质量。则操作步骤的正确排序是dabfce。③根据题意FeSO4的质量为(m3-m1) g,结晶水的质量为(m2-m3) g,绿矾分解反应的化学方程式为:
FeSO4·xH2OFeSO4 + xH2O
152 18x
(m3-m1) g (m2-m3) g
则152(m3-m1) g=18x(m2-m3) g,得x=76(m2-m3)9(m3-m1);若按a、d次序操作,Fe2+会被空气中的O2氧化,导致m3增大,由表达式x=76(m2-m3)9(m3-m1),可判断x偏小。(3)①FeSO4分解看到有红色粉末,说明有Fe2O3生成。将气体通入BaCl2溶液中,若有沉淀生成,说明产物中有SO3,SO2与BaCl2不反应。继续通入品红溶液中,若红色褪去,说明产物中有SO2,SO2并不能完全被品红吸收,所以在最后要进行尾气处理。BaCl2溶液不能为Ba(NO3)2溶液,因为将SO2和SO3的混合气通入Ba(NO3)2溶液,SO2和SO3均能与Ba(NO3)2溶液反应生成BaSO4沉淀。②由实验现象判断出分解产物有Fe2O3、SO2和SO3,则FeSO4分解反应的化学方程式为2FeSO4Fe2O3+SO2↑+SO3↑。
- 6 -
相关文档
- 广西专用2020版高考化学二轮复习专2021-07-056页
- 广西专用2020版高考化学二轮复习专2021-07-056页
- 天津专用2020高考化学二轮复习专题2021-07-036页
- 广西专用2020版高考化学二轮复习专2021-07-035页
- 天津专用2020高考化学二轮复习专题2021-07-035页
- 天津专用2020高考化学二轮复习专题2021-07-025页
- 天津专用2020高考化学二轮复习专题2021-07-023页
- 广西专用2020版高考化学二轮复习专2021-07-026页
- 广西专用2020版高考化学二轮复习专2021-07-026页
- 广西专用2020高考语文二轮复习专题2021-06-087页