- 354.07 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高三化学试题
2020.6
本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间90分钟。
注意事项:
1.每小题选出答案后,用2B铅笔把答题卡上对应题目答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号,不能将答案直接答在试卷上。
2.考试结束后,请将答题卡一并交回。
可能用到的相对原子质量:
H 1 C 12 N 14 O 16 Na 23 S 32 C1 35.5 K 39 Cr 52 Cu 64
第I卷(选择题 共40分)
一、选择题:本题共10小题,每题2分,共20分。每小题只有一个选项符合题意。
1.化学与中华古文化密切相关,下列说法不正确的是
A.汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为粘土
B.《墨子·天志》中记载:“书于竹帛,镂于金石”。其中的“金”指的是金属
C.《天工开物》中记载:“世间丝、麻、裘、褐皆具素质”,其中“丝、麻、裘”的主要成分都是蛋白质
D.《周易参同契》中对汞的描述:“得火则飞,不见埃尘,将欲制之,黄芽为根。”黄芽为硫磺
2.在指定条件下,下列各组离子一定能大量共存的是
A.滴加甲基橙显红色的溶液中:Na+、Fe2+、C1-、NO3-
B.0.1mol·L-1FeC13溶液中:NH4+、Mg2+、SO32-、NO3-
C.0.1mo1·L-1KI溶液中:Na+、K+、ClO-、OH-
D.由水电离的c(H+)=1.0×10-13 mo1·L-1的溶液中:K+、NH4+、C1-、HCO3-
3.X、Y、Z、W为短周期主族元素。X、Z、W形成的一种离子常用于检验Fe3+,X、Y
形成的化合物YX3常用作汽车安全气囊的气体发生剂,W的单质在加热条件下可与X、Z的最高价含氧酸反应。下列叙述正确的是
A.原子半径:Z>Y>W>X
B.简单氢化物稳定性:Z>X
C.W形成的单质一定为原子晶体
D.ZO2和ZO3中Z的原子杂化方式相同
4.设NA为阿伏加德罗常数的值。下列叙述正确的是
A.14gCO、N2混合气体中共含有7NA个电子
B.常温下,0.1mol环氧乙烷()共有0.3NA个共价键
C.在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA
D.氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目为2NA
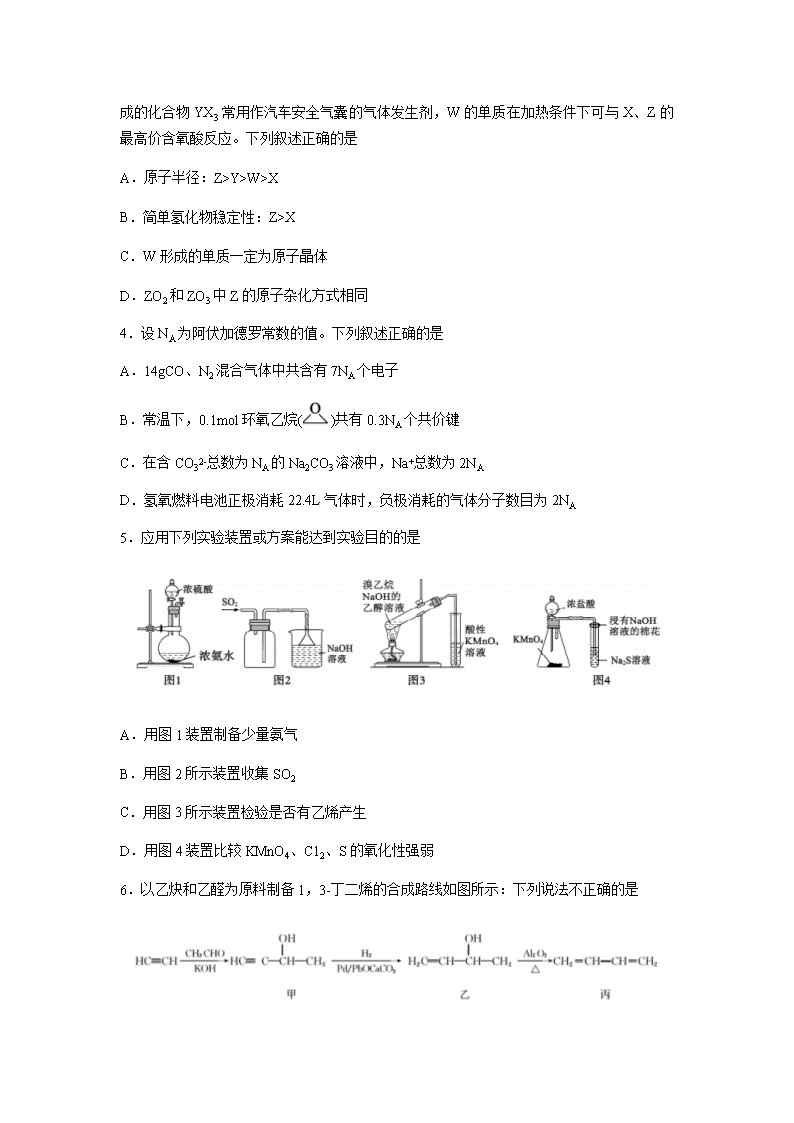
5.应用下列实验装置或方案能达到实验目的的是
A.用图1装置制备少量氨气
B.用图2所示装置收集SO2
C.用图3所示装置检验是否有乙烯产生
D.用图4装置比较KMnO4、C12、S的氧化性强弱
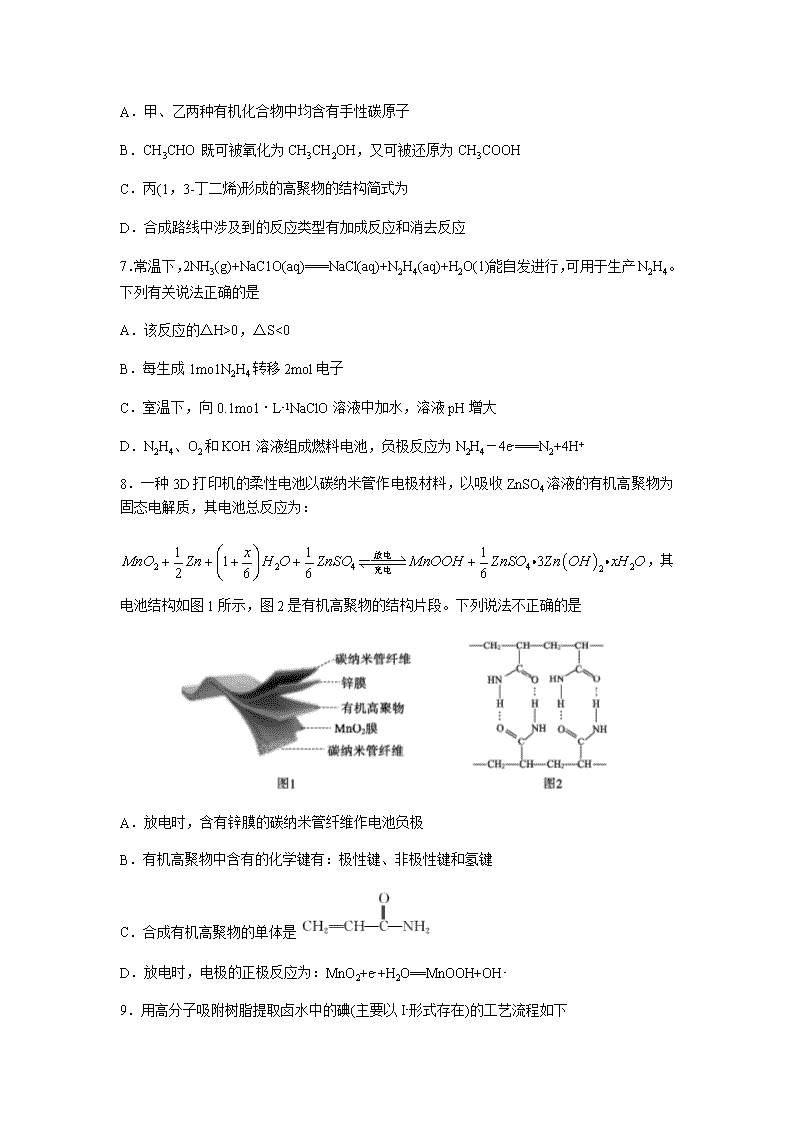
6.以乙炔和乙醛为原料制备1,3-丁二烯的合成路线如图所示:下列说法不正确的是
A.甲、乙两种有机化合物中均含有手性碳原子
B.CH3CHO既可被氧化为CH3CH2OH,又可被还原为CH3COOH
C.丙(1,3-丁二烯)形成的高聚物的结构简式为
D.合成路线中涉及到的反应类型有加成反应和消去反应
7.常温下,2NH3(g)+NaC1O(aq)===NaCl(aq)+N2H4(aq)+H2O(1)能自发进行,可用于生产N2H4。下列有关说法正确的是
A.该反应的△H>0,△S<0
B.每生成1mo1N2H4转移2mol电子
C.室温下,向0.1mo1·L-1NaClO溶液中加水,溶液pH增大
D.N2H4、O2和KOH溶液组成燃料电池,负极反应为N2H4-4e-===N2+4H+
8.一种3D打印机的柔性电池以碳纳米管作电极材料,以吸收ZnSO4溶液的有机高聚物为固态电解质,其电池总反应为:
,其电池结构如图1所示,图2是有机高聚物的结构片段。下列说法不正确的是
A.放电时,含有锌膜的碳纳米管纤维作电池负极
B.有机高聚物中含有的化学键有:极性键、非极性键和氢键
C.合成有机高聚物的单体是
D.放电时,电极的正极反应为:MnO2+e-+H2O==MnOOH+OH-
9.用高分子吸附树脂提取卤水中的碘(主要以I-形式存在)的工艺流程如下
下列说法正确的是
A.流程中①和④所得溶液中,I-离子的浓度相等
B.流程中⑥的分离碘产品的操作方法是萃取
C.流程中④发生离子反应:2I2+SO32-+H2O=4I-+SO42-+2H+
D.制备10mol I2,理论上需KC1O3的质量约为408g
10.在2L恒容密闭容器分别投入2molCO和1molO2。进行反应:2CO(g)+O2(g)2CO2(g)。在相同的时间段(5min)下,测得CO的转化率与温度的关系如图所示。下列说法正确的是
A.化学平衡常数:K(b)0
C.随pH的升高而减小
D.在NaHC2O4溶液中c(Na+)>(HC2O4-)>c(C2O42-)>c(H2C2O4)
第Ⅱ卷(非选择题 共60分)
三、非选择题:本题共5小题,共60分
16.(12分)过氧化尿素(CO(NH2)2·H2O2)是过氧化氢水溶液与尿素的加和物,兼有尿素和过氧化氢的性质,是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。某化学小组同学用低浓度的双氧水和饱和尿素[CO(NH2)2]溶液在30℃条件下用右图装置合成过氧化尿素。请回答下列问题:
(1)仪器X的名称是______________;
(2)制备过氧化尿素的化学方程式为_______________________,反应时采取的受热方式为_____________;
(3)搅拌器不能选择铁质材料的原因是______________________
(4)过氧化尿素中活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品8.000g,溶解于水,在250mL容量瓶中定容,准确量取其中25.00mL溶液于锥形瓶中,加入1mL6mol·L-1H2SO4,然后用0.2000mol·L-1KMnO4标准溶液滴定样品中的H2O2(KMnO4溶液与尿素不反应)。三次滴定平均消耗KMnO4溶液20.000mL:
①请完善滴定时反应的离子方程式:__MnO4-+___H2O2+______==_______________
②若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量_______(填“偏高”、“偏低”或“不变”);
③根据滴定结果确定产品质量_______(填“合格”或“不合格”),活性氧的质量分数为_________。
17.(10分)N、F、Cu及其化合物在化工、医药、材料等方面应用十分广泛。回答下列有关问题:
(1)N原子中最高能级的电子的电子云轮廓图为___________;基态Cu+的核外电子排布式为____________。
(2)化合物(CH3)3N可用于制备医药、农药。分子中N原子杂化方式为________,该物质能溶于水的原因是_____________________。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,其阳离子的空间构型为_____________,写出一种与[H2F]+互为等电子体的分子______________(写化学式)。
(4)氮、铜形成的一种化合物的晶胞结构如图所示。与每个Cu原子紧邻的Cu原子有____个,令阿伏加德罗常数的值为NA,该晶体的密度为______g/cm3。(列出计算式)
18.(12分)二甲醚(CH3OCH3)是一种新型能源,被誉为“21世纪的清洁燃料”。
(1)用CO和H2合成二甲醚的反应为:3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)△H。
几种物质的相对能量如下:
△H=_______kJ·mo1。改变下列“量”,一定会引起△H发生变化的是_____(填代号)。
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
(2)有利于提高反应中CH3OCH3产率的条件为_______(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(3)采用新型催化剂(主要成分是Cu—Mn的合金)制备二甲醚。催化剂中n(Mn)/n(Cu)对合成二甲醚的影响情况如下图所示。
当n(Mn)/n(Cu)=2时,二甲醚的选择性()为85.8%,此时二甲醚的产率为_________。
(4)用二甲醚燃料电池电解法可将酸性含铬废水(主要含有Cr2O72-)转化为Cr3+。原理如下图:
①燃料电池中的负极是______(填“M”或“N”)电极。电解池阴极的电极反应式为______________________________。
②消耗6.9g二甲醚时可处理Cr的含量为26.0g·L-1的废水1L,该套装置的能量利用率为___________。(保留3位有效数字)
19.(13分)钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠的途径如图所示:
(1) Na2MoO4·2H2O中钼元素的化合价是____________
(2)焙烧过程发生的主要反应为MoS2+O2→MoO3+SO2(未配平),该反应的氧化产物是____________(填化学式)。
(3)碱浸时生成Na2MoO4和一种气体A,该气体的电子式为________;沉淀时加入Na2S溶液的目的是______________________
(4)焙烧钼精矿所用的装置是多层焙烧炉,图1为各炉层固体物料的物质的量的百分数(φ)。
第6层焙烧炉中所得MoO3与MoO2的物质的量之比为___________
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图2:
①使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_______。
②随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是__________________________________。
③空气中钼酸盐对碳钢的缓蚀原理是在碳钢表面形成FeMnO4—Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需要加入钼酸盐外还需加入NaNO2。则NaNO2的作用是_____________________________
20.(13分)有机物I()是一种新型感光高分子化合物,工业合成I的路线如下:
已知:同一个碳原子上连接有2个羟基时,自动脱去一个水分子。请回答下列问题:
(1)有机物C中官能团名称_________。反应①的化学反应类型为______________
(2)反应④的化学方程式为:_______________________________________________
(3)反应⑤除生成H外,还生成一种能与碳酸氢钠反应放出气体的有机化合物M,M的结构简式为:_______________________
(4)X是H的芳香族同分异构体,1molX与足量银氨溶液反应时可得到4molAg。则X共有__________种。写出一种核磁共振氢谱有4组峰的同分异构体的结构简式_____________________。
(5)参照上述合成路线。设计以乙醇和乙炔为原料制备CH3CH=CH—COOCH=CH2的流程图。
________________________________________________________________________
高三化学试题参考答案
2020.6
一、选择题:本题共10小题,每题2分,共20分
1.C 2.B 3.D 4.A 5.D 6.B 7.B 8.B 9.D 10.D
二、选择题:本题共5个小题,共20分
11.BD 12.A 13.BC 14.C 15.BC
三、非选择题:本题共5小题,共60分
16.(12分,除标注外每空2分)
(1)球形冷凝管(1分)
(2)CO(NH2)2+H2O2==CO(NH2)2·H2O2 水浴加热(1分)
(3)2Fe+3H2O2+6H+==2Fe3++6H2O,生成的金属离子能催化过氧化氢的分解;
(4)①2MnO4-+5H2O2+6H+==2Mn2++8H2O+5O2↑ ②偏高(1分)
③合格(1分) 20%
17.(10分,除标注外每空2分)
(1)哑铃形或纺锤形;(1分)[Ar]3d10或1s22s22p63s23p63d10(1分)
(2)sp3;(1分)(CH3)3N为极性分子,且可与水分子形成分子间氢键(1分)
(3)V形;(1分)H2O或H2S(合理即可)(1分)
(4)8;
18.(12分,除标注外每空2分)
(1)-253.4 D
(2) B (1分)
(3)61.8%
(4)①M(1分) Cr2O72-+6e-+14H+===2Cr3++7H2O ②83.3%
19.(13分,除标注外每空2分)
(1)+6(1分)
(2)MoO3和SO2
(3) 除去Pb2+离子
(4)1:3(1分)
(5)①1:1(1分)
②C1有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;
③替代空气中氧气起氧化剂作用
20.(13分,除标注外每空2分)
(1)酯基(1分) 加成反应(1分)
(2)
(3)CH3COOH
(4)10