- 153.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高二化学试卷
分值:100分 时间:100分钟
温馨提示:此次考试卷面分为5分
说明:1. 书写整齐无大面积涂改且主观题基本完成的得5分
2. 书写有涂改或主观题未完成的,根据情况扣(1—5) 分
可能用到的原子量:H-1 O-16 C-12 Si-28 S-32 Cl-35.5 K-39 Ca-40 Na-23 Mg-24 Al-27 Ba-137 Fe-56 Ag-108
一.单项选择题(本大题包括16小题,每小题3分,共48分)
1.下列关于强弱电解质及非电解质的判断完全正确的是
选项
A
B
C
D
强电解质
NaCl
CaCl2
HNO
H2SO4
弱电解质
CH3COOH
BaSO4
AlCl3
HF
非电解质
Cl2
CO2
SO2
C2H5OH
2.下列电离方程式或水解方程式正确的是( )
A.H2SO3的电离方程式:H2SO32H++SO32-
B.NaHSO4在水溶液中的电离方程式: NaHSO4═ Na++H++SO42-
C.Na2CO3的水解∶CO32-+2H2OH2CO3+2OH-
D.NH4Cl的水解:NH4++H2O ═ NH3·H2O+H+
3.下列说法正确的是( )
A.所有自发进行的化学反应都是放热反应
B.铁在潮湿空气中生锈是自发过程
C.在其他条件不变的情况下,使用催化剂可以改变化学反应进行的方向
D.298 K时,2H2S(g)+SO2(g) ═ 3S(s)+2H2O(l)能自发进行,则其ΔH>0
4.下列事实能用勒夏特列原理解释的是
A.红棕色的NO2,加压后颜色变深
B.对于反应2HI(g) H2 (g)+I2(g),达到平衡后,缩小容器的体积可使体系颜色变深
C.实验室中常用排饱和食盐水的方法收集氯气
D.500℃左右比室温更利于合成氨反应
5.常温下,下列各组离子在指定的条件下能大量共存的是 ( )
A.中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
B. 四种离子Na+、Ca2+、AlO2-、HCO3-不能大量共存的原因是AlO2-和HCO3-发生双水解
C.由水电离出的c(H+)=10-12 mol·L-1的溶液中:Mg2+、Na+、SO42-、ClO-
D.通入足量CO2的溶液中:Na+、Cl-、K+、SO42-
6.由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法不正确的是( )
A.反应生成1 mol N2时转移4 mol e-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)===N2(g)+NO2(g) ΔH=-139 kJ·mol-1
D.断键吸收能量之和小于成键释放能量之和
7.下列事实能证明HCOOH为弱酸的是
A.HCOOH可与Na2CO3溶液反应生成CO2
B.常温时HCOONa溶液的pH大于7
C.HCOOH溶液的导电能力低于同浓度的硫酸溶液
D.0.1 mol·L-1 HCOOH溶液可以使甲基橙变红
8.一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。若要配制1 mol·L-1的稀硫酸标准溶液,用其滴定某未知浓度的NaOH溶液。下列说法错误的是
A.实验中用到的滴定管和容量瓶使用前都需要检漏
B.如果实验需用85 mL的稀硫酸标准溶液,配制时可选用100 mL容量瓶
C.用甲基橙作指示剂,滴定终点时,溶液颜色从红色变为橙色
D. 酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸滴定,会导致测定的NaOH溶液浓度偏大
9.一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3溶液可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
10.下列有关问题与盐的水解无关的是( )
A.NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂
B.NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
C.实验室中盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞
D.要除去FeCl3溶液中混有的Fe2+,可先通入氧化剂Cl2,再调节溶液的pH
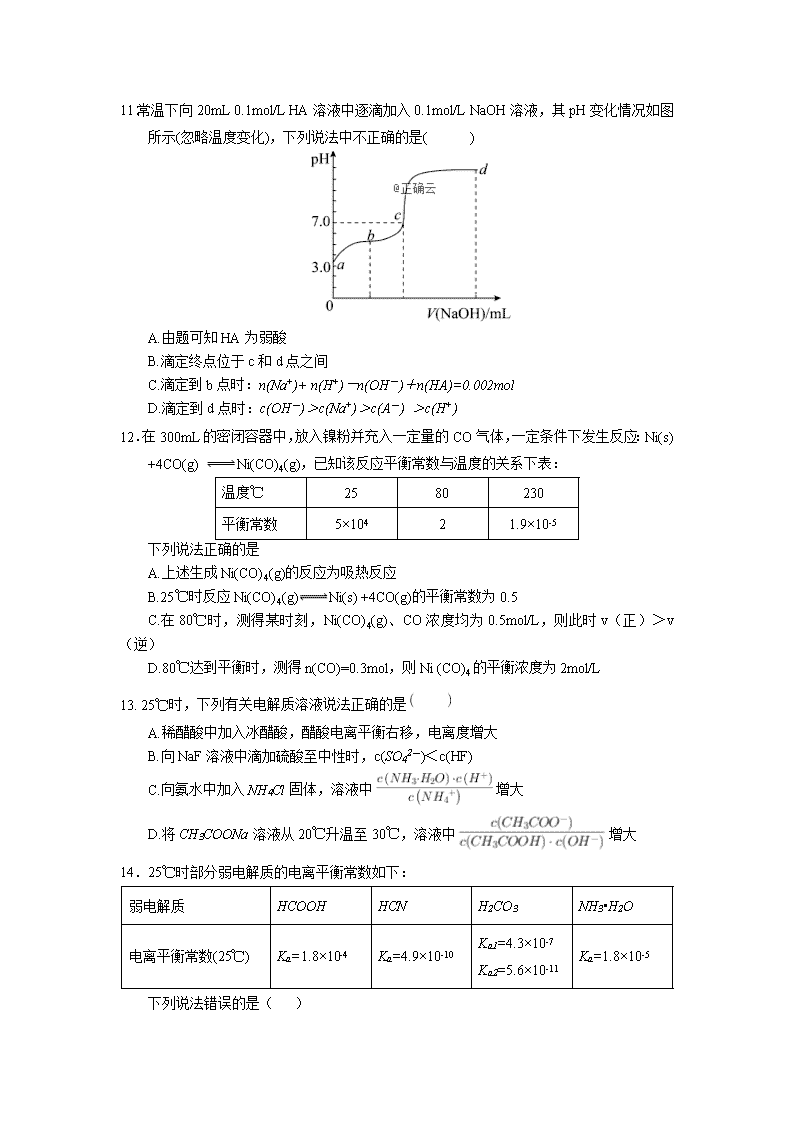
11.常温下向20mL 0.1mol/L HA溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化情况如图所示(忽略温度变化),下列说法中不正确的是( )
A.由题可知HA为弱酸
B.滴定终点位于c和d点之间
C.滴定到b点时:n(Na+)+ n(H+)-n(OH-)+n(HA)=0.002mol
D.滴定到d点时:c(OH-)>c(Na+)>c(A-) >c(H+)
12.在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s) +4CO(g) Ni(CO)4(g),已知该反应平衡常数与温度的关系下表:
温度℃
25
80
230
平衡常数
5×104
2
1.9×10-5
下列说法正确的是
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.25℃时反应Ni(CO)4(g)Ni(s) +4CO(g)的平衡常数为0.5
C.在80℃时,测得某时刻,Ni(CO)4(g)、CO浓度均为0.5mol/L,则此时v(正)>v(逆)
D.80℃达到平衡时,测得n(CO)=0.3mol,则Ni (CO)4的平衡浓度为2mol/L
13. 25℃时,下列有关电解质溶液说法正确的是
A.稀醋酸中加入冰醋酸,醋酸电离平衡右移,电离度增大
B.向NaF溶液中滴加硫酸至中性时,c(SO42-)<c(HF)
C.向氨水中加入NH4Cl固体,溶液中增大
D.将CH3COONa溶液从20℃升温至30℃,溶液中增大
14.25℃时部分弱电解质的电离平衡常数如下:
弱电解质
HCOOH
HCN
H2CO3
NH3•H2O
电离平衡常数(25℃)
Ka=1.8×10-4
Ka=4.9×10-10
Ka1=4.3×10-7
Ka2=5.6×10-11
Ka=1.8×10-5
下列说法错误的是( )
A.结合H+的能力:CO32->CN->HCO3->HCOO-
B.0.1mol/L的HCOONH4溶液中存在以下关系式:c(HCOO-)>c(NH4+)>c(H+)>c(OH-)
C.pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则V (盐酸)>V (氨水)
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者等于后者
15.室温下,用0.10mol·L-1盐酸分别滴定20.00mL 0.10mol·L-1氢氧化钾溶液和氨水,滴定过程中溶液pH随加入盐酸体积V(HCl)的变化关系如图。下列说法不正确的是( )
A.Ⅱ表示的是滴定氨水的曲线
B.当pH=7时,滴定氨水消耗的V(HCl)<20mL,且此时溶液中c(NH4+)=c(Cl-)
C.滴定氢氧化钾溶液时,若V(HCl)>20mL,则可能c(Cl-)>c(H+)>c(K+)>c(OH-)
D.当滴定氨水消耗V(HCl)=10mL时,c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)>c(H+)
16.在2 L密闭容器中发生反应:xA(g)+yB(g)zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化关系,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200 ℃时,该反应的平衡常数为25
C.当外界条件由200 ℃降到100 ℃时,原平衡一定被破坏,且正、逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g)zC(g)的ΔH<0,且a=2
二.非选择题(共47分)
17.(8分)
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:________________________。
(2)若已知下列数据:
化学键
H—H
N≡N
键能/kJ·mol-1
435
943
试根据表中及图中数据计算N—H的键能:________kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)
ΔH1=-akJ·mol-1 ② N2(g)+O2(g)═2NO(g) ΔH2=-bkJ·mol-1
若1molNH3还原NO至N2,则该反应过程中的热化学方程式:________________________。(用含a、b的式子表示ΔH3)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应 Ⅰ:2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq) ΔH1
反应 Ⅱ:NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________________。
18.(10分) 25℃时,有关物质的电离平衡常数如下:
化学式
CH3COOH
H2CO3
H2SO3
电离平衡常数K
K=1.8×10-5
K1=4.3×10-7
K2=5.6×10-11
K1=1.5×10-2
K2=1.02×10-7
(1)以上三种电解质的酸性由强至弱顺序为________________________(用化学式表示,下同)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为 ,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者
后者(填“>、<或=”)。
(3)已知NaHSO3溶液显酸性,其原因是______________________________________________(离子方程式配适当文字叙述)。
(4)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______________________。
19.(9分)某化学兴趣小组对加碘食盐中的KIO3进行研究,它是一种白色粉末,常温下很稳定。在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质。 学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取mg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;发生反应:IO3﹣+5I﹣+6H+=3I2+3H2O,将反应后的溶液加水稀释至100.00 mL。
c.取10.00mL上述溶液到锥形瓶中,以淀粉为指示剂,用物质的量浓度为3.0mol•L﹣1的 Na2S2O3溶液滴定(滴定时的反应方程式:I2+2S2O32﹣═2I﹣+S4O62﹣)。
d.重复实验2次,三次实验分别记录有关数据如下:
滴定次数
待测溶液的体积/mL
1.00×10﹣3mol•L﹣1的 Na2S2O3溶液的体积(mL)
滴定前刻度
滴定后刻度
第一次
10.00
2.62
22.60
第二次
10.00
7.56
30.30
第三次
10.00
6.22
26.24
试回答:
(1)如下图,是某次滴定时的滴定管中的液面,其读数为___________mL。
(2)判断到达滴定终点的现象是:_______________________。
(3)滴定时,Na2S2O3溶液应放在_________________________ (填“酸式滴定管”或“碱式滴定管”)。
(4)根据实验测定数据,计算加碘食盐样品中的碘元素百分含量是_______ (以含m的代数式表示)。
(5)根据上述实验对下列假定情况进行讨论,导致测出待测液的浓度是(填“偏小”、“偏大”或“无影响”)
①标准液读数时,若滴定前俯视,滴定后仰视,测出待测液的浓度__________
②盛标准液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失,测出待测液的浓度__________
20.(8分) 合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)CO(g)+3H2(g) △H1=+206.1kJ/mol
②CH4(g)+CO2(g)2CO(g)+2H2(g) △H2=+247.3kJ/mol
③CO(g)+H2O(g)CO2(g)+H2(g) △H3=-41.2kJ/mol
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v (H2)=______;10min时,改变的外界条件可能是____________________。
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象。
(3)800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO
H2O
CO2
H2
0.5mol
8.5mol
2.0mol
2.0mol
此时反应③中正、逆反应速率的关系式是____________(填代号)。
a.v(正)>v (逆) b.v(正)<v (逆)
c.v(正)= v (逆) d.无法判断.
21.(12分) 根据下列化合物:①NaOH,②H2SO4,③CH3COOH,④NaCl,⑤CH3COONa,⑥NH4Cl,⑦CH3COONH4,⑧NH4HSO4,⑨NH3•H2O,请回答下列问题:
(1)NH4Cl溶液中离子浓度大小顺序为______________________。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH﹣)=_________;在pH=3的CH3COOH溶液中,水电离出来的c(H+)=___________。
(3)已知水存在如下平衡:H2O+H2OH3O++OH﹣△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_________。
A.向水中加入NaHSO4固体 B.向水中加NaHCO3固体
C.加热至100℃[其中c(H+)=1×10﹣6mol/L] D.向水中加入NH4Cl固体
(4)若浓度均为0.1mol/L、等体积的NaOH和NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则 m_________n(填“<”、“>”或“=”)。
(5)物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)_____。