- 602.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019学年高一化学下学期期末考试试题
说明:①不使用答题卡者,请把选择题答案填写在答题卷上的选择题答题表中
②相对原子质量:H:1 C:12 O:16
第I卷(必做选择题,共45分)
一、选择题(每小题只有一个选项正确,每小题3分)
1.元素周期表中某区域的一些元素多用于制造半导体材料,它们是
A.过渡元素 B.金属、非金属元素分界线附近的元素
C.右上方区域的元素 D.左下方区城的元素
2.1869年,门捷列夫所制出的第一张元素周期表,是将元素按照下列的哪个量从小到大排列的
A.核电荷数 B.质子数 C.质量数 D.相对原子质量
3.下列物质中,属于含有共价键的离子化合物的是
A.NH4Cl B.CaCl2 C.H2O2 D.Na2O
4.下列过程中,共价键被破坏的是
A.碘开华 B.二氧化氮被木炭吸附 C.蔗糖溶于水 D.HCl气体溶于水
5.下列元素的原子半径最大的是
A.O B.A1 C.Na D.Cl
6.下列说法正确的是
A.CO2分子的结构式为O=C=O
B.稀士元素与互为同素异形体
C.核外电子排布相同的微粒,化学性质也相同
D.某放射性核索的原子核外电子数为99
7.短周期元素A、B、C原子序数依大增大,A3-与B2-、C+电子层结构相同,则下列说法中不正确的是
A.三种元素可组成CAB2和CAB3型化合物
B.离子半径:C+>B2->A3-
C.H2B在同主族元素气态氢化物中最稳定
D.B的某种单质可用于杀菌消毒
8.未来新能源的特点是资源丰富,
- 9 -
在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的有:①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.⑤⑥⑦ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
9.从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”,下列既有旧化学键的断裂,又有新化学键形成的变化是
A.酒精溶解于水 B.白磷熔化 C.氯化钠受热熔化 D.碳酸氢铵受热分解
10.在2A+B3C+4D中,表示该反应速率最快的是
A.v(A)=0.5mol/(L·s) B.v(B)=0.3 mol/(L·s)
C.v(C)=0.8 mol/(L·s) D.v(D)=1mol/(L·s)
11.决定化学反应速率的本质因素是
A.浓度 B.压强 C.温度 D.反应物质的性质
12.可逆反应2NO22NO+O2在密团容器中反应,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量依度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
A.①④ B.②③ C.①③④ D.①②③④
13.已知反应C+CO22C0的正反应为吸收热量。当温度升高时,其正反应、逆反应的速率变化情况为
A.同时增大 B.同时减小 C.增大,减小 D.减小,增大
14.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的电子数是其电子层数的3倍,Y的非金属性在所有短周期元素中最强,Z的最外层电子数与最内层电子数相等,W是地壳中含量第二多的元素。下列叙述正确的是
A.原子半径的大小顺序:r(Z)>r(W)>r(Y)>r(X)
B. Y的单质与H2化合时,点燃安静燃烧,光照则会发生爆炸
C.最简单气态氢化物的稳定性:X>W
D.单质Z不能与水发生化学反应
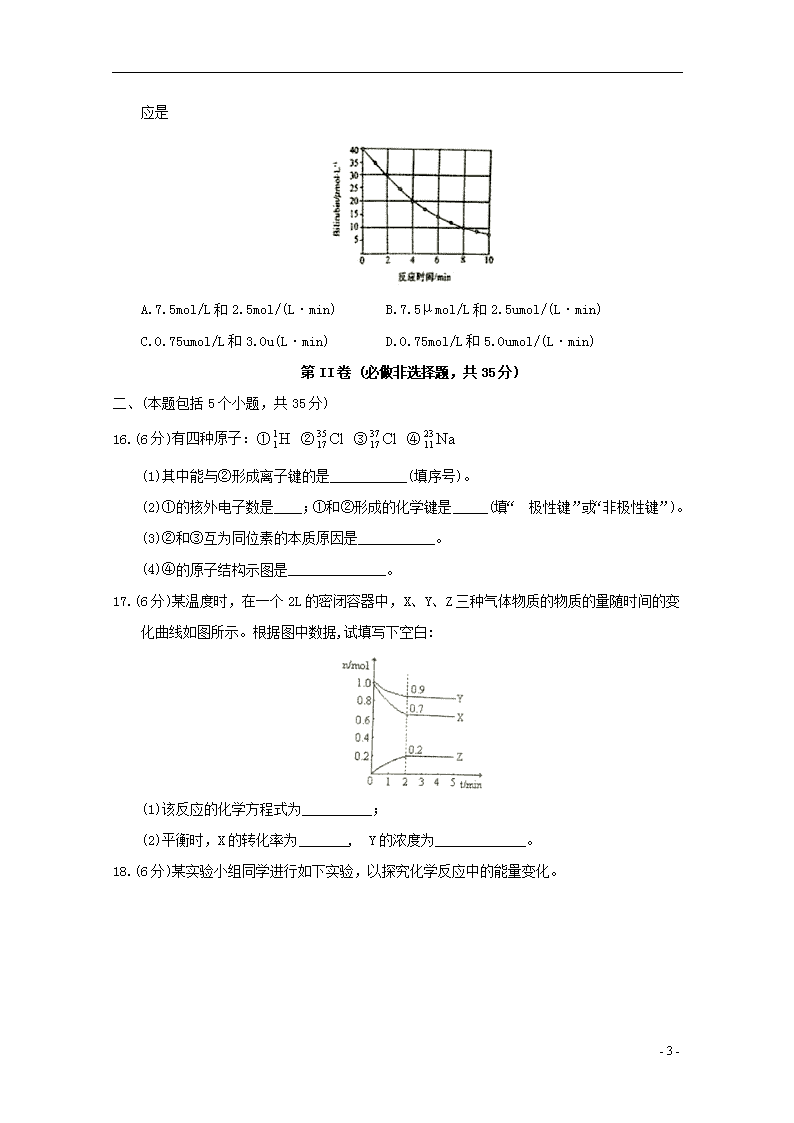
15.研究小组发现一种化合物在一定波长的光照射下发生分解反应,反应物依度随反应时间变化如图所示。则反应10min时反应物的浓度和反应4min -8min间的平均反应速率,
- 9 -
结果应是
A.7.5mol/L和2.5mol/(L·min) B.7.5μmol/L和2.5umol/(L·min)
C.0.75umol/L和3.0u(L·min) D.0.75mol/L和5.0umol/(L·min)
第II卷 (必做非选择题,共35分)
二、(本题包括5个小题,共35分)
16.(6分)有四种原子:① ② ③ ④
(1)其中能与②形成离子键的是___________(填序号)。
(2)①的核外电子数是____;①和②形成的化学键是_____(填“ 极性键”或“非极性键”)。
(3)②和③互为同位素的本质原因是___________。
(4)④的原子结构示图是______________。
17.(6分)某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下空白:
(1)该反应的化学方程式为__________;
(2)平衡时,X的转化率为_______, Y的浓度为_____________。
18.(6分)某实验小组同学进行如下实验,以探究化学反应中的能量变化。
- 9 -
(1)实验表明:①中的温度降低,由此判断氢氧化钡晶体与氯化铵晶体反应是_____(填“吸热”或收热")反应。
(2)实验②中,该小组同学在烧杯中加入5mL1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示。图A中0-t1段化学反应速率变化的原因是________。
已知该反应是放热反应,其能量变化可用下图中的_____(填“B”或“C”)表示。
19.(8分)下表为元素周期表的一部分,参照元素①-⑧在表中的位置,请回答下列问题。
(1)元素③单质的化学式为____,①和④两种元素形成化合物的电子式为_____。由①②组成且含有非极性键的物质的结构式为____________。
(2)④-⑧5种元素所形成的最高价氧化物的水化物中,碱性最强的是____,酸性最强的是____。属于中强酸的是___ (均填化学式)。
(3)④和⑥两种元素的最高价氧化物的水化物,在水中反应的离子方程式为____________。
20.(9分)有X、Y、Z、M、R、Q六种短周期主族元素,部分信息如下表所示:
X
Y
Z
M
R
Q
- 9 -
原子半径/nm
0.186
0.074
0.099
0.160
主要化合价
+4,-4
-2
-1,+7
其它
阳离子核外无电子
无机非金属材料的主角
六种元素中原子半径最大
次外层电子数是最外层电子数的4倍
请回答下列问题:
(1)X的元素符号为______ ,R 在元素周期表中的位置是___________。
(2)根据表中数据推测,Y的原子半径的最小范围是___________。
(3)Q简单离子的离子半径比Z的小,其原因是___________。
(4)下列事实能说明R非金属性比Y强这一结论的是_______ (选填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.气态氧化物稳定性R>Y。
c.Y与R形成的化合物中Y呈正价
第II卷(选做非选择题,共20分)
三、本题包括21题(有机化学)和22题(化学反应原理)2个题组,考生从中选1个题组作答,不得多选或混选。答题时请在答题卷上写清每1问的序号。
21.【有机化学】(20分)
21-1.(10分)已知乙烯能发生以下转化:
(1)化合物D中官能团的名称为_______;反应②中 Cu的作用是__________。反应①.④的反应类型分别为_______、________。
- 9 -
(2)分别写出反应①、③、④的化学方程式。
①_____________。
③_____________。
④_____________。
21-II.(10分)
某学生在如图所示的装置中用苯(沸点80℃)和液溴制取溴苯(沸点156℃),请根据下列实验步骤回答有关问题。
(1)将分液漏斗中的部分苯和溴的混合物加入到A中,则A中发生的化学方程式为______。
(2)反应结束后,打开A下端的活塞,让反应被流入B中,充分振荡,目的是_____。用分液漏斗分离出B 中的溴苯时,要想保证上层(有机物层)的纯度,应该进行的操作方法是_____。
(3)反应过程中,被C装置吸收的物质有______;试管D中滴加AgNO3溶液能够观察到的现象为______, 此现象证明了A中的反应生成了_______。
(4)为了净化上面实验得到的粗溴苯,可以向粗溴苯中,加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_______。除去溴苯中的少量苯,应该采用的分离操作方法是______。
22.【化学反应原理】(20分)
22-I.(10分)
请参考题中图表,已知E1=134kJ/mol、E2=368kJ/mol,根据要求回答问题:
- 9 -
(1)图I是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能最变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___ (填“增大” 、“减小”或“不变”下同) ,△H的变化是________。请写出 NO2和CO反应的热化学方程式:__________。
(2)如表所示是部分化学键的键能参数:
化学键
P-P
P-O
O=O
P=O
键能/kJ/mol
a
b
c
x
已知白磷的燃烧热为d kJ/ mol,白磷及其完全燃烧的产物的结构如图II所示。1个P4O10分子中P-O 的个数为_______表中x=_____kJ/mol(用含a、b、c、d的代表数式表示)。
22-II.(10分)高温下N2和O2发生N2(g)+O2(g)2NO(g)反应,是导致汽车尾气中含有NO的原因之一”。
(1)右图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,据此判断反应N2(g)+O2(g)2NO(g)为_______(填“吸热”或“放热”)反应。
(2)2000℃时向容积为2L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则此反应的平衡常数K=____。该温度下,若开始时向上述容器中充入N2和O2均为1mol,则达到平衡后N2的转化率为______。
- 9 -
(3)汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示。写出其变化的总化学反应方程式:__________。
(4)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氢氧化物的污染。例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
若16gCH4还原NO2至N2共放出热量867kJ,则△H2=_______。
一、选择题(每小题3分,共45分)
1~5 BDADC 6~10 ABBDB 11~15 DAACB
二、(必做非选择题包括5个小题,共35分)
16.(6分)(1)④ (2)1 极性键 (3)质子数相同而中子数不同(2分)[来源:ZXXK]
(4)
17.(6分) (1)3X+Y2Z (2)30% 0.45mol/L
18.(6分)(1)吸热 ;(2)反应放热,随反应进行,温度升高,化学反应速率加快 B
19.(8分)(1)F2 Na+[:H]— H—O—O—H ;(2)NaOH HClO4 H3PO4
(3)Al(OH)+OH—=AlO2—+H2O(2分)
20.(9分)(1)H(1分) 第三周期VIIA族 (2)大于0.099nm 小于0.160nm
(3)Mg2+和Na+核外电子排布完全相同,前者的核电荷数大于后者,核对电子的吸引力大于后者
(4)b、c
三、(选作非选择题,各有两题,共20分)
21-I(10分)(1)羧基 催化剂 加成反应 取代反应(或酯化反应)(各1分)
(2)①CH2=CH2 + H2OCH3CH2OH
- 9 -
④CH3COOH+ CH3CH2OHCH3COOCH2CH3 + H2O
21-Ⅱ(10分)
(1)(2分)
(2)除去溶于溴苯中的溴 将下层液体从下口充分放出后,从上层倒出有机物层
(3)苯、溴 (2分) 生成淡黄色沉淀 HBr
(4)除去溴苯中的水 蒸馏
22-I(10分)
(1)减小 不变 NO2(g)+CO(g)=CO2(g)+NO(g) ΔH=-234 kJ·mol-1
(2)12 (d+6a+5c-12b)
22-Ⅱ(10分)
(1)吸热
(2)1/9或0.11 1/7或14.3%
(3)2NO+O2+4CO4CO2+N2
(4)-1160 kJ·mol-1
- 9 -