- 781.00 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020年莆田市高中毕业班教学质量检测试卷
理科综合能力测试 化学试题
注意事项:
1.本试题分第I卷(选择题)和第II卷(非选择题)两部分。
2.答题前,考生务必将自己的姓名、准考证号填写在答题卡上。
3.全部答案在答题卡上完成,答在本试题卷上无效。
4.考试结束后,将本试题卷和答题卡一并交回。
可能用到的相对原子质量:Al27 S32
第I卷(选择题 共126分)
一、选择题:本题共13小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的。
7.《唐本草》和《本草图经》中记载:“绛矾,本来绿色,……正如瑠璃烧之赤色”“取此物(绛矾)置于铁板上,聚炭,……吹令火炽,其矾即沸,流出,色赤如融金汁者是真也”。其中不涉及的物质是
A.FeSO4•7H2O B.S C.Fe2O3 D.H2SO4
8.“84消毒液”的主要成分是NaClO。下列说法错误的是
A.长期与空气接触会失效
B.不能与“洁厕剂”(通常含盐酸)同时使用
C.1 L 0.2 mol·L-1 NaClO溶液含有0.2 mol ClO-
D.0.1 mol NaClO起消毒作用时转移0.2 mol e-
9.某有机物的结构简式如右图所示。下列说法错误的是
A.与互为同分异构体 B.可作合成高分子化合物的原料(单体)
C.能与NaOH溶液反应 D.分子中所有碳原子不可能共面
10.已知:① ΔH<0;②硝基苯沸点210.9℃,蒸馏时选用空气冷凝管。下列制取硝基苯的操作或装置(部分夹持仪器略去),正确的是
A.配制混酸 B.水浴加热 C.洗涤后分液 D.蒸馏提纯
11.在两只锥形瓶中分别加入浓度均为1 mol·L-1的盐酸和NH4Cl溶液,将温度和pH传感器与溶液相连,往瓶中同时加入过量的质量、形状均相同的镁条,实验结果如下图。
关于该实验的下列说法,正确的是
A.反应剧烈程度:NH4Cl>HCl B.P点溶液:c(NH4+)+2c(Mg2+)>c(Cl-)
C.Q点溶液显碱性是因为MgCl2发生水解 D.1000s后,镁与NH4Cl溶液反应停止
12.我国科学家研发一种低成本的铝硫二次电池,以铝箔和多孔碳包裹的S为电极材料,离子液体为电解液。放电时,电池反应为2Al+3S=Al2S3,电极表面发生的变化如下图所示。下列说法错误的是
A.充电时,多孔碳电极连接电源的负极
B.充电时,阴极反应为8Al2Cl7-+6e-=2Al+14AlCl4-
C.放电时,溶液中离子的总数不变
D.放电时,正极增重0.54g,电路中通过0.06 mol e-
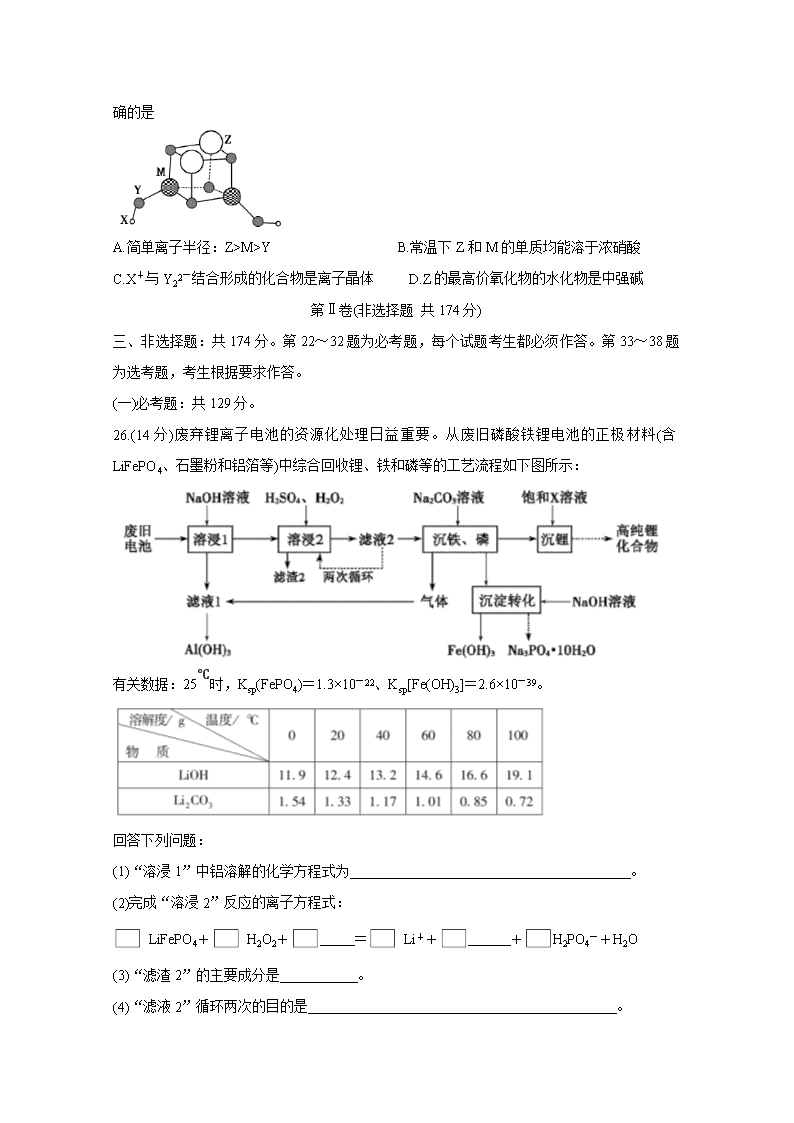
13.短周期元素X、Y、Z、M的原子序数依次增大,它们组成一种团簇分子,结构如下图所示。X、M的族序数均等于周期序数,Y原子核外最外层电子数是其电子总数的3/4。
下列说法正确的是
A.简单离子半径:Z>M>Y B.常温下Z和M的单质均能溶于浓硝酸
C.X+与Y22-结合形成的化合物是离子晶体 D.Z的最高价氧化物的水化物是中强碱
第Ⅱ卷(非选择题 共174分)
三、非选择题:共174分。第22~32题为必考题,每个试题考生都必须作答。第33~38题为选考题,考生根据要求作答。
(一)必考题:共129分。
26.(14分)废弃锂离子电池的资源化处理日益重要。从废旧磷酸铁锂电池的正极材料(含LiFePO4、石墨粉和铝箔等)中综合回收锂、铁和磷等的工艺流程如下图所示:
有关数据:25℃时,Ksp(FePO4)=1.3×10-22、Ksp[Fe(OH)3]=2.6×10-39。
回答下列问题:
(1)“溶浸1”中铝溶解的化学方程式为 。
(2)完成“溶浸2”反应的离子方程式:
LiFePO4+ H2O2+ = Li++ +H2PO4-+H2O
(3)“滤渣2”的主要成分是 。
(4)“滤液2”循环两次的目的是 。
(5)“沉铁、磷”时,析出FePO4沉淀,反应的离子方程式为 。实验中,铁、磷的沉淀率结果如右图所示。碳酸钠浓度大于30%后,铁沉淀率仍然升高,磷沉淀率明显降低,其可能原因是 。
(6)“沉淀转化”反应:FePO4+3OH-Fe(OH)3+PO43-。用此反应的化学平衡常数说明转化能否完全?
(7)为了充分沉淀,“沉锂”时所用的X和适宜温度是 (填标号)。
A.NaOH 20~40℃ B.NaOH 80~100℃
C.Na2CO3 20~40℃ D.Na2CO3 60~80℃
27.(14分)实验室用如下装置(略去夹持仪器)制取硫代硫酸钠晶体。
已知:①Na2S2O3·5H2O是无色晶体,易溶于水,难溶于乙醇。
②硫化钠易水解产生有毒气体。
③装置C中反应如下:Na2CO3+SO2=Na2SO3+CO2
2Na2S+3SO2=3S+2Na2SO3 S+Na2SO3Na2S2O3
回答下列问题:
(1)装置B的作用是 。
(2)该实验能否用NaOH代替Na2CO3? (填“能”或“否”)。
(3)配制混合液时,先溶解Na2CO3,后加入Na2S·9H2O,原因是 。
(4)装置C中加热温度不宜高于40℃,其理由是 。
(5)反应后的混合液经过滤、浓缩,再加入乙醇,冷却析出晶体。乙醇的作用是 。
(6)实验中加入m1 g Na2S·9H2O和按化学计量的碳酸钠,最终得到m2 g Na2S2O3·5H2O晶体。Na2S2O3·5H2O的产率为 (列出计算表达式)。
【Mr(Na2S·9H2O)=240,Mr(Na2S2O3·5H2O)=248】
(7)下列措施不能减少副产物Na2SO4产生的是 (填标号)。
A.用煮沸并迅速冷却后的蒸馏水配制相关溶液
B.装置A增加一导管,实验前通入N2片刻
C.先往装置A中滴加硫酸,片刻后往三颈烧瓶中滴加混合液
D.将装置D改为装有碱石灰的干燥管
28.(15分)用结构和原理阐释化学反应的类型、限度、速率和历程是重要的化学学科思维。回答下列问题:
(1)用过氧化氢检验Cr(VI)的反应是Cr2O72-+4H2O2+2H+=2CrO5+5H2O。CrO5的结构式为,该反应是否为氧化还原反应? (填“是”或“否”)。
(2)已知:
2H2(g)+O2(g)=2H2O(l) ΔH=–571.6 kJ·mol-1
H2(g)+O2(g)=H2O2(l) ΔH=–187.8 kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) ΔH= kJ·mol-1
(3)一定条件下,H2O2分解时的c(H2O2)随t变化如右图所示。已知该反应的瞬时速率可表示为v(H2O2)=k·cn(H2O2),k为速率常数。
①0~20min内,(H2O2)= 。
②据图分析,n= 。
③其它条件相同,使用活性更高的催化剂,下列说法正确的是 (填标号)。
A.v(H2O2)增大 B.k增大 C.ΔH减小 D.Ea(活化能)不变
(4)气体分压pi=p总×xi(物质的量分数)。恒温50℃、恒压101 kPa,将足量的CuSO4·5H2O、NaHCO3置于一个密闭容器中,再充入已除去CO2的干燥空气。假设只发生以下反应,达平衡时两者分解的物质的量比为2:1。
CuSO4·5H2O(s)CuSO4·3H2O(s)+2H2O(g) Kp1=36(kPa)2
2NaHCO3(s)Na2CO3(s)+H2O(g)+CO2(g) Kp2
①平衡时= ,Kp2= 。
②平衡后,用总压为101 kPa的潮湿空气[其中p(H2O)=8 kPa、p(CO2)=0.4 kPa]替换容器中的气体,50℃下达到新平衡。容器内CuSO4·5H2O的质量将 (填“增加”“减少”或“不变”,下同),NaHCO3质量将 。
(二)选考题:共45分。请考生从2道物理题、2道化学题、2道生物题中每科任选一题作答。如果多做,则每科按所做的第一题计分。
35.(15分)2019年诺贝尔化学奖授予三位化学家,以表彰其对研究开发锂离子电池作出的卓越贡献。LiFePO4、聚乙二醇、LiPF6、LiAsF6和LiCl等可作锂离子聚合物电池的材料。回答下列问题:
(1)Fe的价层电子排布式为 。
(2)Li、F、P、As四种元素的电负性由大到小的顺序为 。
(3)乙二醇(HOCH2CH2OH)的相对分子质量与丙醇(CH3CH2CH2OH)相近,但沸点高出100℃,原因是 。
(4)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiASF6的阴离子结构如图乙所示(X=P、As)。
①聚乙二醇分子中,碳、氧的杂化类型分别是 、 。
②从化学键角度看,Li+迁移过程发生 (填“物理变化”或“化学变化”)。
③PF6-中P的配位数为 。
④相同条件,Li+在 (填“LiPF6”或“LiAsF6”)中迁移较快,原因是 。
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标
。LiCl·3H2O属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。右图为沿Z轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。据此推断该晶胞中Cl原子的数目为 。LiCl·3H2O的摩尔质量为M g·mol-1,设NA为阿伏加德罗常数的值,则LiCl·3H2O晶体的密度为 g·cm-3(列出计算表达式)。
36.[化学——选修5:有机化学基础](15分)
氟西汀G是一种治疗抑郁性精神障碍的药物,其一种合成路线如下:
已知:LiAlH4是强还原剂,不仅能还原醛、酮,还能还原酯,但成本较高。
回答下列问题:
(1)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出D的结构简式,用星号(*)标出D中的手性碳 。
(2)④的反应类型是 。
(3)C的结构简式为 。
(4)G的分子式为 。
(5)反应⑤的化学方程式为 。
(6)已知M与D互为同分异构体,在一定条件下能与氯化铁溶液发生显色反应。M分子的苯环上有3个取代基,其中两个相同。符合条件的M有 种。
(7) 也是一种生产氟西汀的中间体,设计以和CH3SO2Cl为主要原料制备它的合成路线(无机试剂任选)。