- 337.00 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
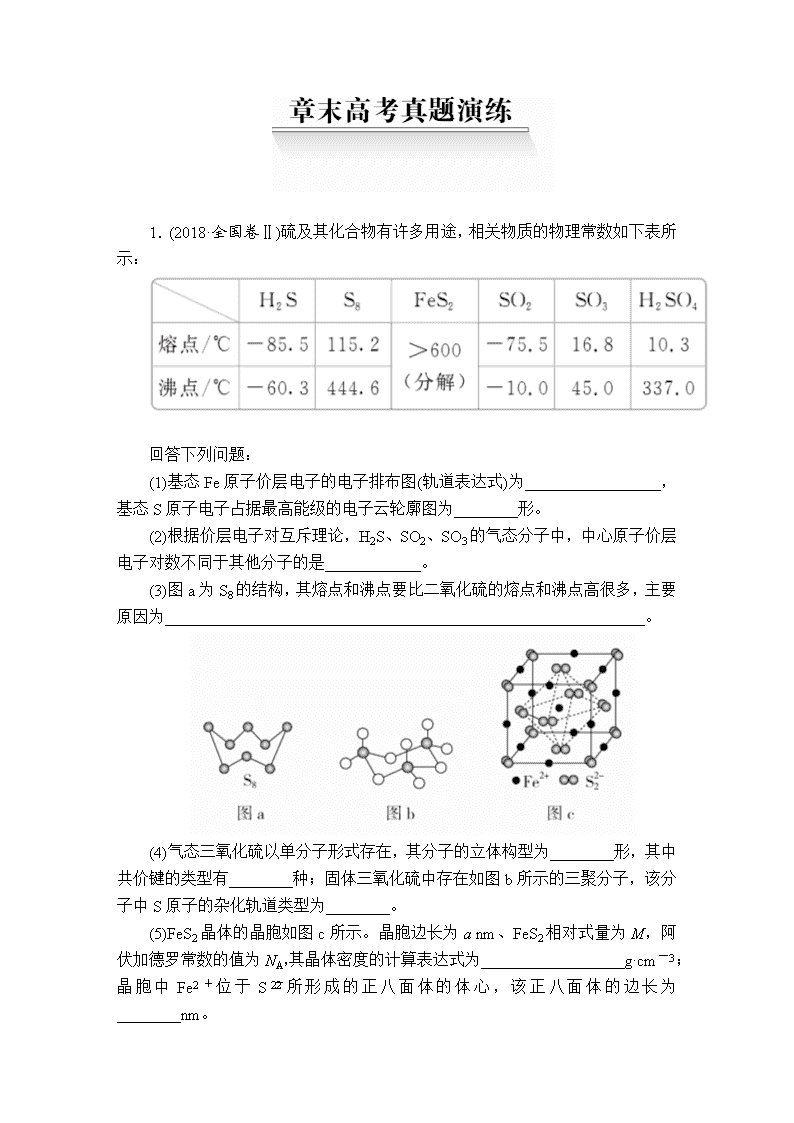
1.(2018·全国卷Ⅱ)硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为_________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是____________。
(3)图a为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为____________________________________________________________。
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图b所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图c所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为__________________g·cm-3;晶胞中Fe2+位于S所形成的正八面体的体心,该正八面体的边长为________nm。
答案 (1) 哑铃(纺锤) (2)H2S (3)S8相对分子质量大,分子间范德华力强 (4)平面三角 2 sp3 (5)×1021 a
解析 (1)基态Fe原子的核外电子排布式为1s22s22p63s23p63d64s2,则其价层电子的电子排布图(轨道表达式)为;基态S原子的核外电子排布式为1s22s22p63s23p4,则电子占据的最高能级是3p,其电子云轮廓图为哑铃(纺锤)形。
(2)根据价层电子对互斥理论可知H2S、SO2、SO3的气态分子中,中心原子价层电子对数分别是2+=4、2+=3、3+=3,因此中心原子价层电子对数不同于其他分子的是H2S。
(3)S8、二氧化硫形成的晶体均是分子晶体,由于S8相对分子质量大,分子间范德华力强,所以其熔点和沸点要比二氧化硫的熔点和沸点高很多。
(4)气态三氧化硫以单分子形式存在,根据(2)中分析可知中心原子含有的价层电子对数是3,且不存在孤对电子,所以其分子的立体构型为平面三角形。分子中存在氧硫双键,因此其中共价键的类型有2种,即σ键、π键;固体三氧化硫中存在如图b所示的三聚分子,该分子中S原子形成4个共价键,因此其杂化轨道类型为sp3。
(5)根据晶胞结构可知含有Fe2+的个数是12×+1=4,S个数是8×+6×=4,晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,则其晶体密度的计算表达式为ρ== g·cm-3=×1021 g·cm-3;晶胞中Fe2+位于S所形成的正八面体的体心,该正八面体的边长是面对角线的一半,则为a nm。
2.(2018·全国卷Ⅲ节选)锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为____________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第一电离能
I1(Zn)________I1(Cu)(填“大于”或“小于”)。原因是____________________。
(3)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________,C原子的杂化形式为________________。
(4)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为__________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为__________________g·cm-3(列出计算式)。
答案 (1)[Ar]3d104s2或1s22s22p63s23p63d104s2
(2)大于 Zn核外电子排布为全满稳定结构,较难失电子
(3)平面三角形 sp2
(4)六方最密堆积(A3型)
解析 (1)Zn是第30号元素,所以核外电子排布式为[Ar]3d104s2或1s22s22p63s23p63d104s2。
(2)Zn的第一电离能大于Cu的第一电离能,原因是Zn的核外电子排布已经达到了每个能级都是全满的稳定结构,所以失电子比较困难。
(3)碳酸锌中的阴离子为CO,根据价层电子对互斥理论,其中心原子C的价电子对数为3+=3,所以空间构型为平面三角形,中心C原子的杂化形式为sp2杂化。
(4)由图可知,堆积方式为六方最密堆积。为了计算方便,选取该六棱柱结构进行计算。六棱柱顶点的原子是6个六棱柱共用的,面心是两个六棱柱共用,所以该六棱柱中的锌原子为12×+2×+3=6个,所以该结构的质量为 g。该六棱柱的底面为正六边形,边长为a cm,底面的面积为6个边长为a cm的正三角形面积之和,根据正三角形面积的计算公式,该底面的面积为6×a2 cm2
,高为c cm,所以体积为6×a2c cm3。所以密度为= g·cm-3。
3.(2017·全国卷Ⅰ)钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为________nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据最高能层的符号是________,占据该能层电子的电子云轮廓图形状为________________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是_______________________________________________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I离子。I离子的几何构型为________,中心原子的杂化形式为____________。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446 nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为________nm,与K紧邻的O个数为________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于________位置,O处于________位置。
答案 (1)A (2)N 球形 K原子半径较大且价电子数较少,金属键较弱 (3)V形 sp3 (4)0.315 12 (5)体心 棱心
解析 (1)紫色光对应的辐射波长范围是400~430 nm(此数据来源于物理教材 人教版 选修34)。
(2)基态K原子占据K、L、M、N四个能层,其中能量最高的是N能层。N能层上为4s电子,电子云轮廓图形状为球形。Cr的原子半径小于K且其价电子数较多,则Cr的金属键强于K,故Cr的熔、沸点较高。
(3)I的价层电子对数为=4,中心原子杂化轨道类型为sp3,成键电子对数为2,孤电子对数为2,故空间构型为V形。
(4)K与O间的最短距离为a=×0.446 nm≈0.315 nm;由于K、O分别位于晶胞的顶角和面心,所以与K紧邻的O原子为12个。
(5)根据KIO3的化学式及晶胞结构可画出KIO3的另一种晶胞结构,如图,可看出K处于体心,O处于棱心。
4.(2017·全国卷Ⅲ)研究发现,在CO2低压合成甲醇反应(CO2+3H2===CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为________________。元素Mn与O中,第一电离能较大的是________,基态原子核外未成对电子数较多的是________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为________和________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为________________________,原因是________________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为__________nm。MnO也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为________nm。
答案 (1)1s22s22p63s23p63d74s2(或[Ar]3d74s2) O Mn
(2)sp sp3
(3)H2O>CH3OH>CO2>H2 H2O与CH3OH均为极性分子,H2O中氢键比甲醇多;CO2与H2均为非极性分子,CO2分子量较大,范德华力较大
(4)离子键和π键(Π键)
(5)0.148 0.076
解析 (1)Co是27号元素,其基态原子核外电子排布式为[Ar]3d74s2或1s22s22p63s23p63d74s2。元素Mn与O中,由于O是非金属元素而Mn是金属元素,所以O的第一电离能大于Mn的。O基态原子核外电子排布式为1s22s22p4,其核外未成对电子数是2,而Mn基态原子核外电子排布式为[Ar]3d54s2,其核外未成对电子数是5,因此Mn的基态原子核外未成对电子数比O的多。
(2)CO2和CH3OH的中心原子C的价层电子对数分别为2和4,所以CO2和CH3OH分子中C原子的杂化形式分别为sp和sp3。
(4)硝酸锰是离子化合物,硝酸根和锰离子之间形成离子键,硝酸根中N原子与3个氧原子除形成 3个σ键,还存在π键(Π键)。
(5)因为O2-采用面心立方最密堆积方式,面对角线是O2-半径的4倍,即4r(O2-)=a,解得r(O2-)≈0.148 nm;根据晶胞的结构可知,棱上阴阳离子相切,因此2r(Mn2+)+2r(O2-)=0.448 nm,所以r(Mn2+)=0.076 nm。
5.(2017·江苏高考)铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为________。
(2)丙酮()分子中碳原子轨道的杂化类型是________,1 mol丙酮分子中含有σ键的数目为____________。
(3)C、H、O三种元素的电负性由小到大的顺序为________。
(4)乙醇的沸点高于丙酮,这是因为________________。
(5)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为________。
答案 (1)[Ar]3d5或1s22s22p63s23p63d5 (2)sp2和sp3 9 mol (3)H