- 246.00 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
安徽省舒城中学2017-2018学年度第一学期第一次统考
高二化学试卷
命题人:程 燚 审题人:胡玉来
可能用到的相对原子质量:H-1;C-12;N-14;O-16;Na-23;Cl-35.5;K-39;Cu-64;I-127
第Ⅰ卷(选择题 共54分)
一、选择题(每题只有一个正确答案,每题3分,18题,共54分)
1.关于下列仪器或用品的使用说法正确的是 ( )
① ② ③ ④
A.用装置①排水法收集气体,则气体应该从b端通入
B.装置②常作为气体的干燥装置,气体从b端通入
C.用③来检验产生的Cl2时,应该先将③湿润
D.用④制作一过滤器时,滤纸边缘应该与漏斗口齐平
2.下列物质的检验方法不合理的是 ( )
A.O2——带火星的小木条,看是否复燃
B.SO42———加BaCl2溶液看是否产生白色沉淀
C.Fe3+——加KSCN溶液看溶液是否变血红色
D.K+——做焰色反应实验,并透过蓝色钴玻璃看是否呈紫色
3.下列溶液导电能力最强的是 ( )
A.8 L 0.4 mol·L-1的NaOH溶液 B.2 L 0.15 mol·L-1的Na3PO4溶液
C.1 L 0.3 mol·L-1的NaCl溶液 D.0.4 L 0.5 mol·L-1的Na2SO4溶液
4.把下列物质分别加入盛水的锥形瓶内,立即塞紧带U 形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染 成红色),加入下列哪些物质后,发生如图所示变化 ( )
①NaOH粉末;②浓H2SO4;③NH4NO3晶体; ④Na2O2固体;⑤生石灰
A.①②④⑤ B.①②③ C.②③⑤ D.③④⑤
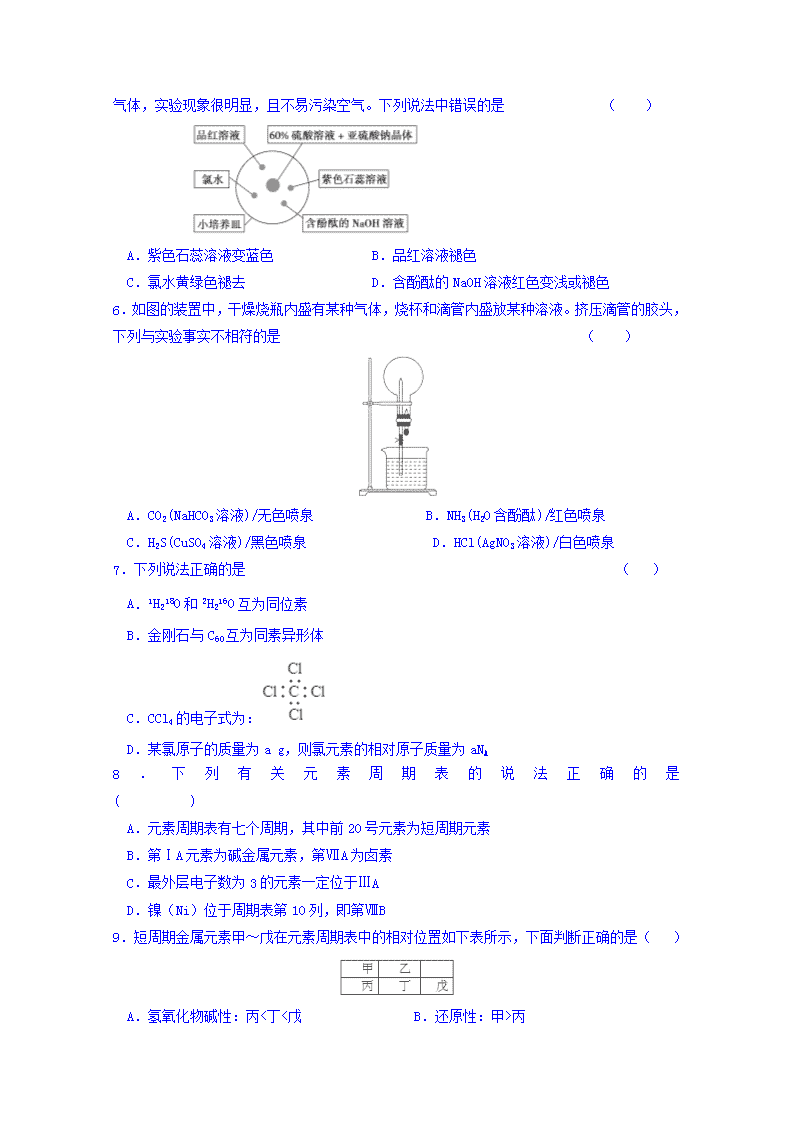
5.如图是研究二氧化硫性质的微型实验装置。现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2
气体,实验现象很明显,且不易污染空气。下列说法中错误的是 ( )
A.紫色石蕊溶液变蓝色 B.品红溶液褪色
C.氯水黄绿色褪去 D.含酚酞的NaOH溶液红色变浅或褪色
6.如图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实不相符的是 ( )
A.CO2(NaHCO3溶液)/无色喷泉 B.NH3(H2O含酚酞)/红色喷泉
C.H2S(CuSO4溶液)/黑色喷泉 D.HCl(AgNO3溶液)/白色喷泉
7.下列说法正确的是 ( )
A.1H218O和2H216O互为同位素
B.金刚石与C60互为同素异形体
C.CCl4的电子式为:
D.某氯原子的质量为a g,则氯元素的相对原子质量为aNA
8.下列有关元素周期表的说法正确的是 ( )
A.元素周期表有七个周期,其中前20号元素为短周期元素
B.第ⅠA元素为碱金属元素,第ⅦA为卤素
C.最外层电子数为3的元素一定位于ⅢA
D.镍(Ni)位于周期表第10列,即第ⅧB
9.短周期金属元素甲~戊在元素周期表中的相对位置如下表所示,下面判断正确的是( )
A.氢氧化物碱性:丙<丁<戊 B.还原性:甲>丙
C.简单离子的半径:丙>丁>戊 D.族序数:甲>乙
10.下列反应中既有离子键、极性键和非极性键被破坏,也有离子键、极性键和非极性键形成的是 ( )
A.2Na2O2+2H2O=4NaOH+O2↑ B.Na2O+H2O=2NaOH
C.2H2O2=2H2O+O2↑ D.NaCl+AgNO3=AgCl↓+NaNO3
11.燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如下图所示,a、b均为惰性电极。下列叙述不正确的是 ( )
A.a极是负极,该电极上发生氧化反应
B.b极反应是O2+4OH--4e-=2H2O
C.总反应方程式为2H2+O2=2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
12.下列反应的离子方程式书写正确的是 ( )
A.NaHCO3溶液与NaOH溶液反应:HCO3-+ OH-= H2O +CO2↑
B.Fe3O4溶于盐酸中:Fe3O4+6H+=2Fe3++3H2O
C.Fe2(SO4)3溶液中加入Ba(OH)2溶液:Fe3++3OH—=Fe(OH)3↓
D.硫磺与NaOH溶液共热:3S+6OH— 2S2—+SO32—+3H2O
13.把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应:
3X(g)+Y(g) nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/(L·min),则n的值为 ( )
A.4 B.3 C.2 D.1
14.某单烯烃经与氢气加成后,得到有机物:,则原单烯烃有 ( )
A.3种 B.4种 C.5种 D.6种
15.苯乙烯是一种重要的有机化工原料,其结构简式为,它一般不可能具有的性质是 ( )
A.易溶于水,也易溶于有机溶剂
B.在空气中燃烧产生黑烟
C.它能使溴的四氯化碳溶液褪色
D.能发生加成反应,在一定条件下可与4倍物质的量的氢气加成
16.将 1 mol乙醇(其中的羟基氧用18O标记)在浓硫酸存在并加热下与足量乙酸充分反应。下列叙述不正确的是 ( )
A.反应时先加乙醇再加浓硫酸和乙酸 B.生成的乙酸乙酯中含有18O
C.可能生成90 g乙酸乙酯 D.制得的乙酸乙酯用饱和Na2CO3溶液吸收
17.下列氧化物不能跟铝粉组成铝热剂的是 ( )
A.WO3 B.MnO2 C.MgO D.V2O5
18.下列经计算所得结果正确的是 ( )
A.NaClO3和Na2SO3按物质的量之比2:1反应,Na2SO3被氧化,则反应得到的还原产物可能为ClO2
B.钠、镁、铝各0.3 mol分别放入100 mL 1 mol·L-1的盐酸中,同温同压下产生的气体的体积比是1∶1∶1
C.在Al2(SO4)3、K2SO4和明矾的混合溶液中,如果c(SO42-)等于0.4 mol/L,当加入等体积0.4 mol/L的KOH溶液时,生成的沉淀恰好溶解,则此溶液中K+的物质的量浓度为0.25mol/L
D.19.2gCu与100mL(4mol/LHNO3和2mol/LH2SO4)混合稀酸反应,产生标况下2.24LNO气体
第Ⅱ卷(非选择题 共46分)
二、填空简答题(共5小题,共46分)
19.(8分)写出下列反应的方程式
(1)写出下列各反应的化学方程式
①氨的催化氧化______________________________________________________________
②Fe(OH)2浊液在空气中由白色变成灰绿色最终变成红褐色的反应__________________
(2)写出下列各反应的离子方程式
①硅与NaOH溶液反应_________________________________________________________
②漂白液中通过量的CO2_______________________________________________________
20.(10分)a、b、c、d、e是原子序数依次递增的短周期元素,周期表中a与b、b与c相邻;a与e的最外层电子数之比为2∶3,b的最外层电子数比e的最外层电子数少1;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1)e的元素符号是________。
(2)a、b、c的氢化物稳定性由小到大的顺序为(用分子式表示)________________________; d、e形成化合物的电子式为________________。
(3)将0.4 g NaOH和1.06 g d2ac3混合并配成溶液,向溶液中逐滴加入0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是____________
(4)下列有关化石燃料综合利用发生物理变化的是____
A.煤的干馏 B.煤的气化 C.煤的液化 D.石油的分馏
E.石油的裂化 F.石油的裂解 G.海水晒盐 F.电解炼镁
21.(10分)(1)将等质量的两份Zn粉a、b分别加入过量的稀硫酸,若同时向a中加少量CuSO4溶液:
①加少量CuSO4溶液时a中发生反应的离子方程式为______________________________
②当析出Cu后,构成了原电池,加快了Zn与稀硫酸反应的速率,此后正极上发生的电极反应式为__________________________
③a、b两份相比,下列各图中产生H2的体积V(L)与时间t(min)的关系,正确的是_____
(2)为了探究原电池的工作原理,某化学学习小组设计了如下实验,其装置如图:
发生氧化还原反应方程式是_________________________________________;因此决定了原电池中Mg作_______极。
22.(10分)(1)写出下列各烷烃的分子式:
①烷烃A在同温同压下蒸气的密度是H2的43倍_________________。
②0.1mol烷烃F含4.2mol电子__________________。
(2)下列可以鉴别甲烷和乙烯的试剂为______(填选项字母)。
A.稀硫酸 B.溴的四氯化碳溶液
C.水 D.酸性高锰酸钾溶液
(3)下列物质中,不能通过乙烯加成反应得到的是________(填选项字母)。
A.CH3CH3 B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
(4)乙醇是生活中常见的有机物,能进行如下图所示的多种反应,A、C都是有机物。
写出反应③的化学方程式:___________________________________________________。
23.(8分)海洋植物如海带、海藻中含有丰富的碘元素,碘元素以离子的形式存在。实验中从海藻提取碘的流程如图所示
(1)将海藻灼烧成海藻灰需在_____________(填仪器名称)中进行。
(2)写出过程②中有关反应的离子方程式__________________________________。
(3)提取碘的过程中可供选择的有机试剂B为____________
A.酒精、四氯化碳 B.四氯化碳、苯 C.汽油、醋酸 D.汽油、甘油
(4)步骤②也可用反应:KI+KIO3+HCl→KCl+I2+H2O(未配平)得到单质碘;则该反应的原子利用率为_____________________(百分数中分子保留一位小数)。
高二上学期第一次月考
化学答题卡
一、选择题
题号
1
2
3
4
5
6
7
8
9
答案
题号
10
11
12
13
14
15
16
17
18
答案
二、填空简答题
19.(1)①_________________________________________________
②________________________________________________________
(2)①____________________________________________________
②_________________________________________________________
20.(1)_________________
(2)__________________________________;__________________
(3)______________(4)_______________
21.(1)①________________________________________;
②_________________________________________;③_________
(2)________________________________________;____________
22.(1)①_________;②_________ (2)________(3)__________
(4)_______________________________________________________
23.(1)______________
(2)____________________________________________________
(3)______________________ (4)______________________
高二上学期第一次月考
化学答案
CBDAA ABCCA BDDAA CCA
19.(1)①4NH3+5O24NO+6H2O(条件没写扣1分)
②4Fe(OH)2+O2+2H2O=4Fe(OH)3
(2)①Si+2OH—+H2O=SiO32—+2H2↑
②ClO—+CO2+H2O=HClO+HCO3—
20.(1)S (2)CH4