- 389.00 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学反应与能量变化
A组 基础必做题
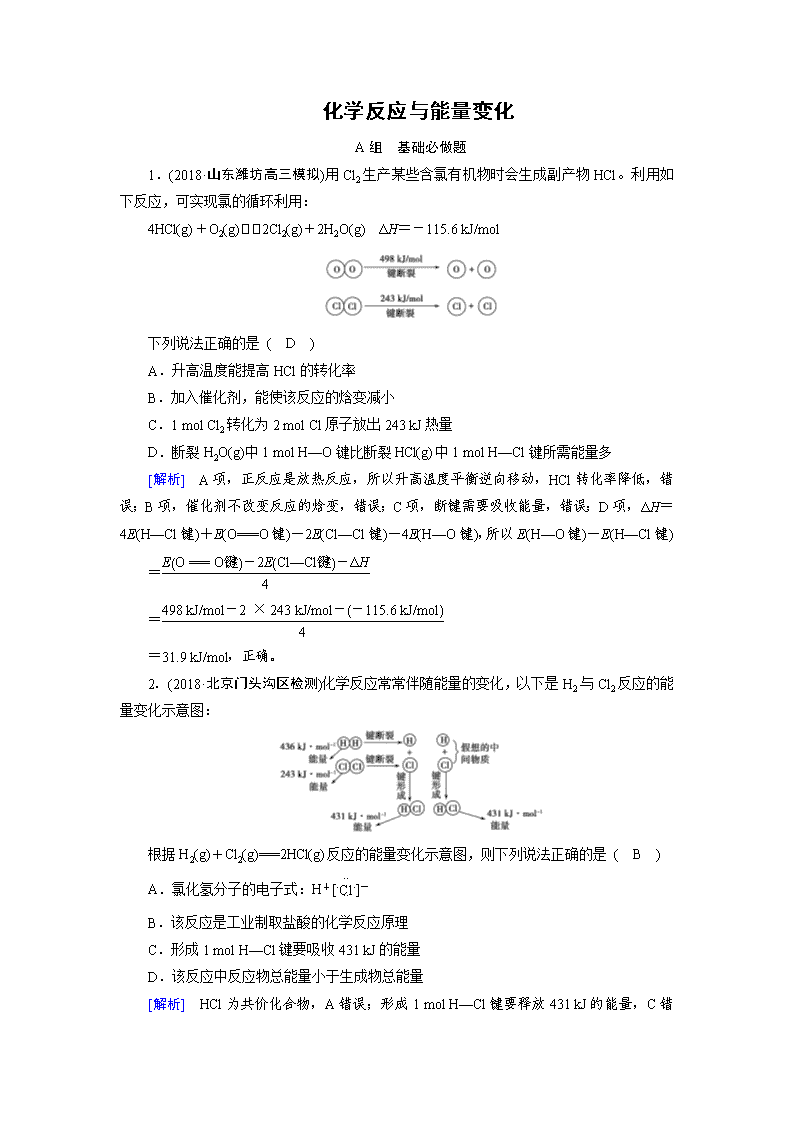
1.(2018·山东潍坊高三模拟)用Cl2生产某些含氯有机物时会生成副产物HCl。利用如下反应,可实现氯的循环利用:
4HCl(g)+O2(g)2Cl2(g)+2H2O(g) ΔH=-115.6 kJ/mol
下列说法正确的是 ( D )
A.升高温度能提高HCl的转化率
B.加入催化剂,能使该反应的焓变减小
C.1 mol Cl2转化为2 mol Cl原子放出243 kJ热量
D.断裂H2O(g)中1 mol H—O键比断裂HCl(g)中1 mol H—Cl键所需能量多
[解析] A项,正反应是放热反应,所以升高温度平衡逆向移动,HCl转化率降低,错误;B项,催化剂不改变反应的焓变,错误;C项,断键需要吸收能量,错误;D项,ΔH=4E(H—Cl键)+E(O===O键)-2E(Cl—Cl键)-4E(H—O键),所以E(H—O键)-E(H—Cl键)
=
=
=31.9 kJ/mol,正确。
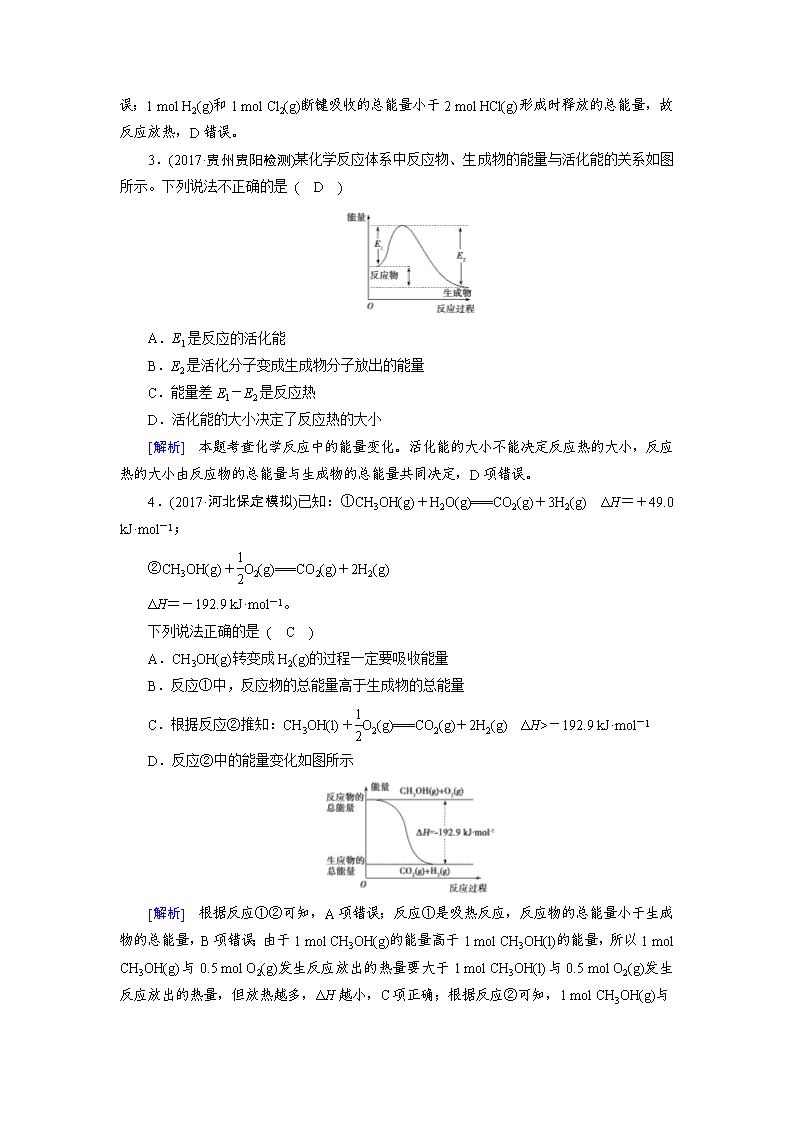
2.(2018·北京门头沟区检测)化学反应常常伴随能量的变化,以下是H2与Cl2反应的能量变化示意图:
根据H2(g)+Cl2(g)===2HCl(g)反应的能量变化示意图,则下列说法正确的是 ( B )
A.氯化氢分子的电子式:H+[]-
B.该反应是工业制取盐酸的化学反应原理
C.形成1 mol H—Cl键要吸收431 kJ的能量
D.该反应中反应物总能量小于生成物总能量
[解析] HCl为共价化合物,A错误;形成1 mol H—Cl键要释放431
kJ的能量,C错误;1 mol H2(g)和1 mol Cl2(g)断键吸收的总能量小于2 mol HCl(g)形成时释放的总能量,故反应放热,D错误。
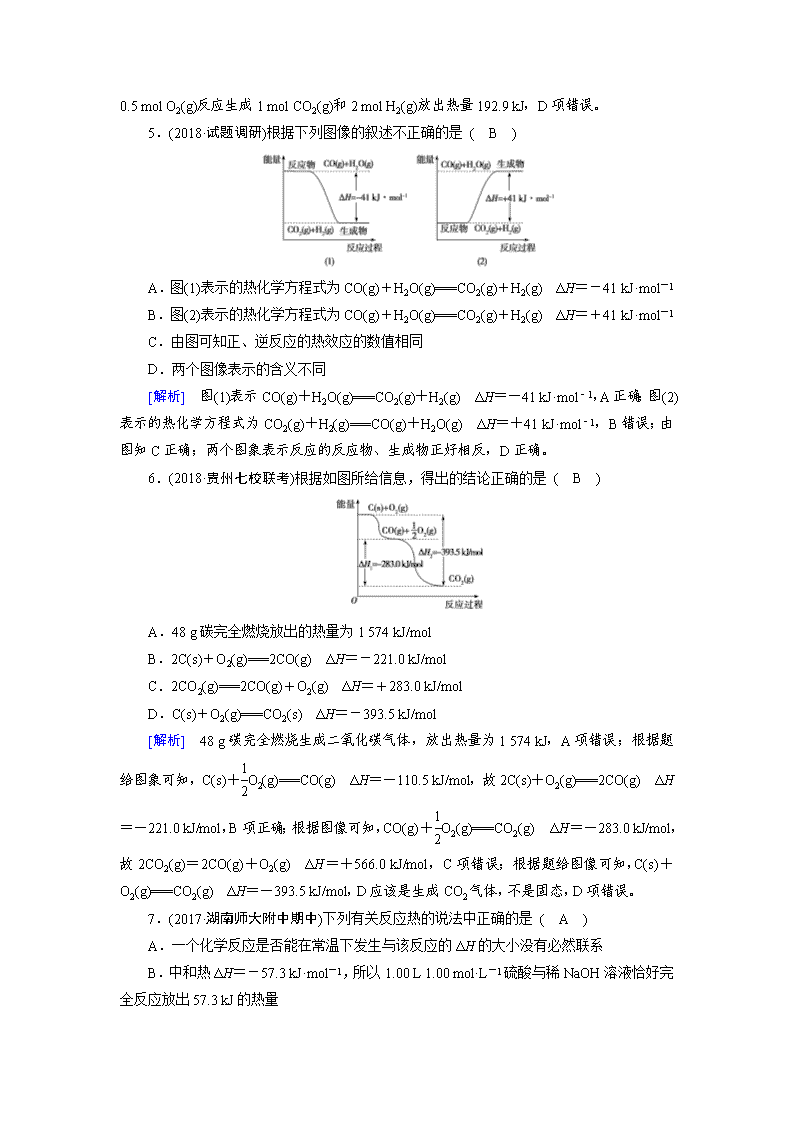
3.(2017·贵州贵阳检测)某化学反应体系中反应物、生成物的能量与活化能的关系如图所示。下列说法不正确的是 ( D )
A.E1是反应的活化能
B.E2是活化分子变成生成物分子放出的能量
C.能量差E1-E2是反应热
D.活化能的大小决定了反应热的大小
[解析] 本题考查化学反应中的能量变化。活化能的大小不能决定反应热的大小,反应热的大小由反应物的总能量与生成物的总能量共同决定,D项错误。
4.(2017·河北保定模拟)已知:①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1;
②CH3OH(g)+O2(g)===CO2(g)+2H2(g)
ΔH=-192.9 kJ·mol-1。
下列说法正确的是 ( C )
A.CH3OH(g)转变成H2(g)的过程一定要吸收能量
B.反应①中,反应物的总能量高于生成物的总能量
C.根据反应②推知:CH3OH(l)+O2(g)===CO2(g)+2H2(g) ΔH>-192.9 kJ·mol-1
D.反应②中的能量变化如图所示
[解析] 根据反应①②可知,A项错误;反应①是吸热反应,反应物的总能量小于生成物的总能量,B项错误;由于1 mol CH3OH(g)的能量高于1 mol CH3OH(l)的能量,所以1 mol CH3OH(g)与0.5 mol O2(g)发生反应放出的热量要大于1 mol CH3OH(l)与0.5 mol O2(g)发生反应放出的热量,但放热越多,ΔH越小,C项正确;根据反应②可知,1 mol CH3OH(g)与0.5 mol O2(g)反应生成1 mol CO2(g)和2 mol H2(g)放出热量192.9 kJ,D项错误。
5.(2018·试题调研)根据下列图像的叙述不正确的是 ( B )
A.图(1)表示的热化学方程式为CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1
B.图(2)表示的热化学方程式为CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=+41 kJ·mol-1
C.由图可知正、逆反应的热效应的数值相同
D.两个图像表示的含义不同
[解析] 图(1)表示CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1,A正确;图(2)表示的热化学方程式为CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41 kJ·mol-1,B错误;由图知C正确;两个图象表示反应的反应物、生成物正好相反,D正确。
6.(2018·贵州七校联考)根据如图所给信息,得出的结论正确的是 ( B )
A.48 g碳完全燃烧放出的热量为1 574 kJ/mol
B.2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ/mol
C.2CO2(g)===2CO(g)+O2(g) ΔH=+283.0 kJ/mol
D.C(s)+O2(g)===CO2(s) ΔH=-393.5 kJ/mol
[解析] 48 g碳完全燃烧生成二氧化碳气体,放出热量为1 574 kJ,A项错误;根据题给图象可知,C(s)+O2(g)===CO(g) ΔH=-110.5 kJ/mol,故2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ/mol,B项正确;根据图像可知,CO(g)+O2(g)===CO2(g) ΔH=-283.0 kJ/mol,故2CO2(g)=2CO(g)+O2(g) ΔH=+566.0 kJ/mol,C项错误;根据题给图像可知,C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol,D应该是生成CO2气体,不是固态,D项错误。
7.(2017·湖南师大附中期中)下列有关反应热的说法中正确的是 ( A )
A.一个化学反应是否能在常温下发生与该反应的ΔH的大小没有必然联系
B.中和热ΔH=-57.3 kJ·mol-1,所以1.00 L 1.00 mol·L-1硫酸与稀NaOH溶液恰好完全反应放出57.3 kJ的热量
C.用等体积的0.50 mol·L-1盐酸、0.55 mol·L-1NaOH溶液进行中和热测定的实验,
会使测得的值偏大
D.在101 kPa时,1 mol CH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热
[解析] 化学反应能否在常温下进行与物质的稳定性有关,与该反应的ΔH大小没有必然联系,A正确;中和热是稀溶液中H+与OH-反应生成1 mol H2O(l)放出的热量,1.00 L 1.00 mol·L-1硫酸与稀NaOH溶液恰好完全反应生成2 mol H2O,故放出的热量为114.6 kJ,B错误;用等体积的0.50 mol·L-1盐酸、0.55 mol·L-1NaOH溶液进行中和热测定的实验,NaOH稍过量,可保证HCl完全反应,不会使测得的中和热的值偏大,C错误;根据燃烧热的概念,CH4完全燃烧生成的稳定氧化物应为CO2(g)和H2O(l),D错误。
8.(2018·山东聊城模拟)丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)
ΔH1=-a kJ·mol-1
途径Ⅱ:C3H8(g)===C3H6(g)+H2(g)
ΔH2=+b kJ·mol-1
2C3H6(g)+9O2(g)===6CO2(g)+6H2O(l)
ΔH3=-c kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH4=-d kJ·mol-1(a、b、c、d均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量__等于__(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)由于C3H8(g)===C3H6(g)+H2(g)的反应中,反应物具有的总能量__小于__(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要__吸收__(填“放出”或“吸收”)能量才能转化为生成物,因此其反应条件是__加热__。
(3)b与a、b、c的数学关系式是__2b=c+d-2a__。
[解析] (1)根据盖斯定律知两者相等。
(3)设途径Ⅱ的3个热化学方程式分别为①、②、③,将途径Ⅱ的热化学方程式①+(②+③)可得途径Ⅰ的热化学方程式,则有b+×(-c)+×(-d)=-a,整理即得
2b=c+d-2a。
B组 能力提升题
9.(2018·福建泉州五校联考)一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。已知:①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160 kJ·mol-1
下列选项不正确的是 ( C )
A.CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g)
ΔH=-867 kJ·mol-1
B.CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH3<ΔH1
C.若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4 kJ
D.若用标准状况下2.24 LCH4还原NO2至N2,整个过程中转移的电子为0.8 mol
[解析] A项,(①+②)/2得出:CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH=(-574-1 160)/2 kJ·mol-1=-867 kJ·mol-1,正确;B项,H2O(g)===H2O(l) ΔH<0,因此两式相加,ΔH3<ΔH1,正确;C项,根据A选项,放出热量为867×0.2 kJ=173.4 kJ,但没有说明H2O的状态,若是气态,则正确,若是液态,则大于173.4 kJ,不正确;D项,根据A选项,消耗1 mol CH4转移8 mol e-,则消耗0.1 CH4转移电子为0.8 mol,正确。
10.下列有关图像的叙述不正确的是 ( A )
A.图Ⅰ:H2的燃烧热为245 kJ·mol-1
B.图Ⅱ:b可能为使用催化剂的曲线,活化能降低
C.图Ⅱ:恒温恒容时,向容器中充入1 mol N2、3 mol H2,充分反应后放热小于92.2 kJ
D.图Ⅲ:HgO(s)===Hg(l)+O2(g)
ΔH=+90.7 kJ·mol-1
[解析] 根据燃烧热的概念,H2的燃烧热为1 mol H2(g)完全燃烧生成稳定氧化物H2O(l)时所放出的热量,由图I可知H2O为气态,A项叙述错误。由图Ⅱ可知,曲线b的活化能低于a的,b可能使用了催化剂,B项叙述正确。由于N2与H2合成NH3为可逆反应,故充分反应后达到平衡时放热小于92.2 kJ,C项叙述正确。由图Ⅲ可知,HgO(s)分解为Hg(l)和O2(s)为吸热反应,热化学方程式书写正确,D项叙述正确。
11.(2018·山东滨州检测)下列关于化学反应中能量变化的叙述正确的是 ( D )
A.由H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol知,中和热为57.3 kJ/mol
B.一定条件下,0.2 mol SO2(g)与0.1 mol O2(g)混合充分反应时放出的热量的18 kJ,则有2SO2(g)+O2(g)2SO3(g) ΔH=-180 kJ/mol
C.已知H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ/mol,则H2的燃烧热为241.8 kJ/mol
D.已知S(s)+O2(g)===SO2(g) ΔH1,S(g)+O2(g)===SO2(g) ΔH2,则ΔH1>ΔH2
[解析] 本题考查热化学知识,意在考查考生对化学基本概念与理论的应用能力。有弱碱或弱酸参与的中和反应的中和热不是57.3 kJ/mol,A错误;因为SO2(g)与O2(g)
的反应是可逆的,0.2 mol SO2(g)与0.1 mol O2(g)混合充分反应时消耗的SO2(g)少于0.2 mol,故所给热化学方程式错误,B错误;与燃烧热对应的生成物中水应为液态,C错误;固态硫所具有的能量低于气态硫,D正确。
特别提醒:中和热:在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态H2O时的反应热。需注意:①稀溶液是指物质溶于大量水中;②中和热不包括离子在水溶液中的生成热、物质的溶解热、电解质电离时的热效应;③中和反应的实质是H+和OH-化合生成H2O,即H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。
12.(2018·河北衡水检测)在25 ℃、1.01×105 Pa下,将22 g CO2通入750 mL 1.0 mol·L-1的NaOH溶液中充分反应,放出x kJ热量。在该条件下,将1 mol CO2通入2L 1.0 mol·L-1的NaOH溶液中充分反应,放出y kJ热量,则CO2与NaOH反应生成NaHCO3的热化学方程式为 ( B )
A.CO2(g)+NaOH(aq)===NaHCO3(aq)
ΔH=-(2y-x) kJ·mol-1
B.CO2(g)+NaOH(aq)===NaHCO3(aq)
ΔH=-(4x-y) kJ·mol-1
C.CO2(g)+NaOH(aq)===NaHCO3(aq)
ΔH=-(2x-y) kJ·mol-1
D.CO2(g)+NaOH(aq)===NaHCO3(aq)
ΔH=-(8x-2y) kJ·mol-1
[解析] 根据题意,将22 gCO2通入750 mL 1.0 mol·L-1的NaOH溶液中充分反应,n(CO2)==0.5 mol,n(NaOH)=1.0 mol·L-1×0.75 L=0.75 mol,反应产物为碳酸钠和碳酸氢钠,反应的化学方程为2CO2+3NaOH===NaHCO3+Na2CO3+H2O,由0.5 mol CO2参加反应放出热量为x kJ知,2 mol CO2参加反应放出的热量为4x kJ,即热化学方程式为2CO2(g)+3NaOH(aq)===NaHCO3(aq)+Na2CO3(aq)+H2O(l) ΔH=-4x kJ·mol-1①,又将1 mol CO2通入2 L 1.0 mol·L-1NaOH溶液中充分反应入出y kJ的热量,则热化学方程式为2NaOH(aq)+CO2(g)===Na2CO3(aq)+H2O(l) ΔH=-y kJ·mol-1②,根据盖斯定律,由①-②可得
NaOH(aq)+CO2(g)===NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1。
13.(2017·江苏高考)通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是 ( C )
①C(s)+H2O(g)===CO(g)+H2(g) ΔH1=a kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=b kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g)
ΔH3=c kJ·mol-1
④2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=d kJ·mol-1
A.反应①、②为反应③提供原料气
B.反应③也是CO2资源化利用的方法之一
C.反应CH3OH(g)===CH3OCH3(g)+H2O(l)的ΔH= kJ·mol-1
D.反应2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d) kJ·mol-1
[解析] 反应①的产物为CO和H2,反应②的产物为CO2和H2,反应③的原料为CO2和H2,A项正确;反应③将温室气体CO2转化为燃料CH3OH,B项正确;反应④中生成物H2O为气体,C项中生成物H2O为液体,故C项中反应的焓变不等于 kJ·mol-1,C项错误;依据盖斯定律,由②×2+③×2+④,可得所求反应的焓变,D项正确。
14.(2017·北京四十三中月考)下列说法正确的是 ( A )
A.如图可表示水分解过程中的能量变化
B.若2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1,则碳的燃烧热为110.5 kJ·mol-1
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知:Ⅰ.对于反应:H2(g)+Cl2(g)===2HCl(g) ΔH=-a kJ·mol-1,
Ⅱ.,且a、b、c均大于0,则断开1 mol H—Cl键所需的能量为(a+b+c)kJ
[解析] 水的分解反应为吸热反应,使用催化剂能降低反应的活化能,加快反应速率,A正确;碳的燃烧热是指1 mol C(s)完全燃烧生成CO2(g)放出的热量,B错误;一个反应是吸热反应还是放热反应与反应条件无关,C错误;根据反应热与键能的关系可知,ΔH=b kJ·mol-1+c kJ·mol-1-2E(H—Cl)=-a kJ·mol-1,则有E(H—Cl)=0.5(a+b+c)kJ·mol-1,故断开1 mol H—Cl键所需要的能量为0.5(a+b+c)kJ,D错误。
15.(2017·河南安鹤新开四校联考)工业上制取硝酸铵的流程图如下所示
请回答下列问题:
已知:4NO(g)+4NH3(g)+O2(g)4N2(g)+6H2O(g) ΔH=-1745.2 kJ·mol-1;6NO(g)+4NH3(g)5N2(g)+6H2O(g) ΔH=-1925.2 kJ·mol-1;
则反应Ⅰ的热化学方程式可表示为__4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH=-1025.2 kJ·mol-1__。
[解析] 将已知的两个热化学方程式从上到下依次标记为①和②,根据盖斯定律由①×5-②×4得:4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH=-1025.2 kJ·mol-1。
16.(2018·重庆三峡名校联盟期末)氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料。
(1)纳米级的Cu2O可作为太阳光分解水的催化剂。一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.10 mol水蒸气发生反应:2H2O(g)2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时段产生O2的量见表格:
时间/min
20
40
60
80
n(O2)/mol
0.001 0
0.001 6
0.002 0
0.002 0
上述反应过程中能量转化形式为光能转化为__化学__能,达平衡过程中至少需要吸收光能__0.968__kJ(保留三位小数)。
(2)氢气是合成氨工业的原料,合成塔中每产生2 mol NH3,放出92.2 kJ热量。已知:
则1 mol N—H键断裂吸收的能量约等于__391_kJ__。
(3)已知:①2H2(g)+O2(g)===2H2O(g)
ΔH=-483.6 kJ·mol-1
②N2(g)+2O2(g)===2NO2(g) ΔH=+67.7 kJ·mol-1
则H2还原NO2生成水蒸气和氮气反应的热化学方程式是__4H2(g)+2NO2(g)===N2(g)+4H2O(g)
ΔH=-1 034.9 kJ·mol-1__。
[解析] (1)题述反应过程中能量转化形式为光能转化为化学能,达平衡时,生成氧气0.002 mol,至少需要吸收的光能为0.002 mol×484 kJ·mol-1=0.968 kJ。
(2)3H2(g)+N2(g)2NH3(g),反应的焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量
=3×436 kJ·mol-1+945.8 kJ·mol-1-6×E(N—H)
=-92.2 kJ·mol-1,E(N—H)=391 kJ·mol-1。
(3)反应4H2(g)+2NO2(g)===N2(g)+4H2O(g)可以由①×2-②得到,故ΔH=-(483.6 kJ·mol-1)×2-67.7 kJ·mol-1=-1 034.9 kJ·mol-1