- 799.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
练案[18]第六章 化学反应与能量
第18讲 原电池 化学电源
A组 基础必做题
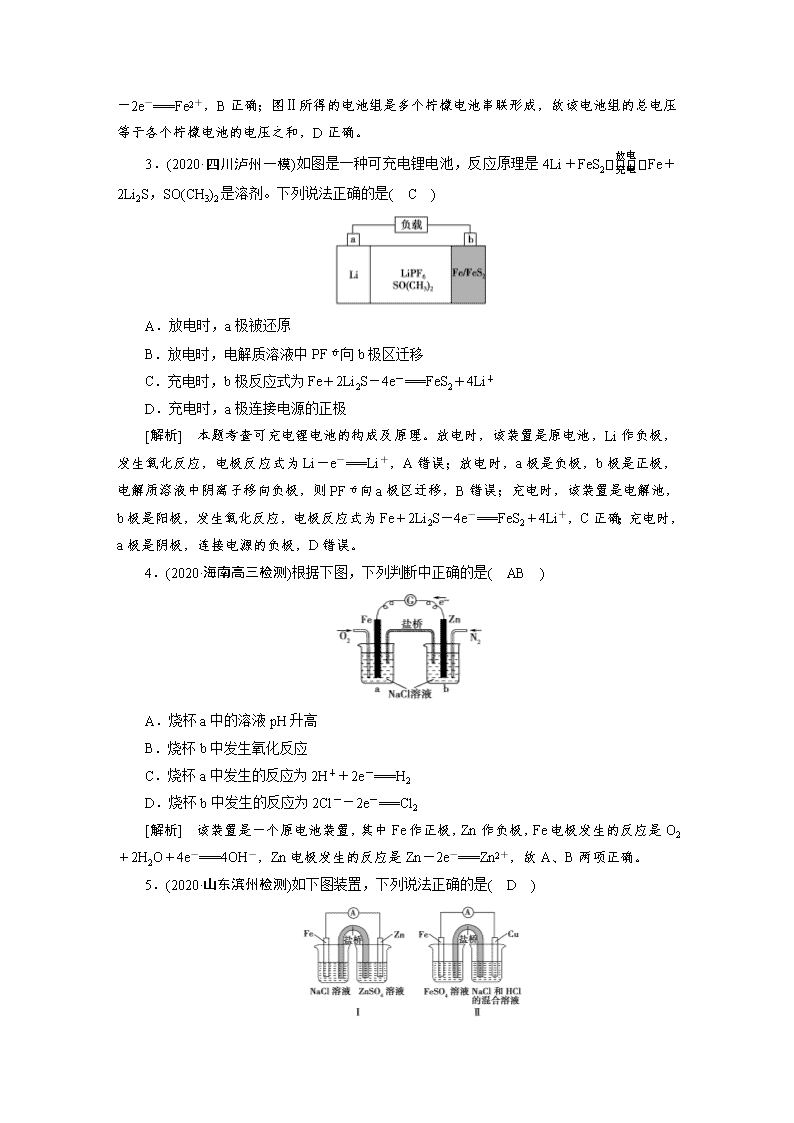
1.(2020·河北唐山检测)(双选)铜锌电池原理如图所示,下列说法正确的是( BC )
A.a电极发生还原反应
B.盐桥中K+移向b电极
C.b电极反应式为Cu2++2e-===Cu
D.电子由Zn电极流出,经盐桥流向b电极
[解析] 本题考查“双液铜锌原电池”的构成及工作原理。Zn的金属活动性强于Cu,则铜锌原电池中,Zn作负极,发生氧化反应,A错误;b电极是正极,盐桥中阳离子向正极区移动,则盐桥中K+移向b电极,B正确;溶液中Cu2+在b电极上发生还原反应生成Cu,电极反应式为Cu2++2e-===Cu,C正确;电子由负极经导线流向正极,则电子由Zn电极流出,经电流计流向Cu电极,电子不能经过盐桥,D错误。
2.(2020·北京石景山区检测)在探究柠檬电池的工作原理时,某课外小组同学发现:当按图1所示连接一个柠檬时,二极管不发光;按图Ⅱ所示连接几个柠檬时,二极管发光。下列说法不正确的是( A )
A.图Ⅰ中二极管不发光,说明该装置不构成原电池
B.图Ⅱ中铁环为负极、铜线为正极,负极的电极反应为Fe-2e-===Fe2+
C.图Ⅰ中二极管不发光的原因是单个柠檬电池的电压较小
D.图Ⅱ中所得的电池组的总电压是各个柠檬电池的电压之和
[解析] 本题通过实验探究柠檬电池的构成及工作原理。图Ⅰ连接一个柠檬时,形成原电池,二极管不发光的原因是单个柠檬电池的电压较小,A错误、C正确;图Ⅱ中多个柠檬电池串联,铁比铜活泼,则铁环是负极,负极上Fe失电子被氧化生成Fe2+
,电极反应式为Fe-2e-===Fe2+,B正确;图Ⅱ所得的电池组是多个柠檬电池串联形成,故该电池组的总电压等于各个柠檬电池的电压之和,D正确。
3.(2020·四川泸州一模)如图是一种可充电锂电池,反应原理是4Li+FeS2Fe+2Li2S,SO(CH3)2是溶剂。下列说法正确的是( C )
A.放电时,a极被还原
B.放电时,电解质溶液中PF向b极区迁移
C.充电时,b极反应式为Fe+2Li2S-4e-===FeS2+4Li+
D.充电时,a极连接电源的正极
[解析] 本题考查可充电锂电池的构成及原理。放电时,该装置是原电池,Li作负极,发生氧化反应,电极反应式为Li-e-===Li+,A错误;放电时,a极是负极,b极是正极,电解质溶液中阴离子移向负极,则PF向a极区迁移,B错误;充电时,该装置是电解池,b极是阳极,发生氧化反应,电极反应式为Fe+2Li2S-4e-===FeS2+4Li+,C正确;充电时,a极是阴极,连接电源的负极,D错误。
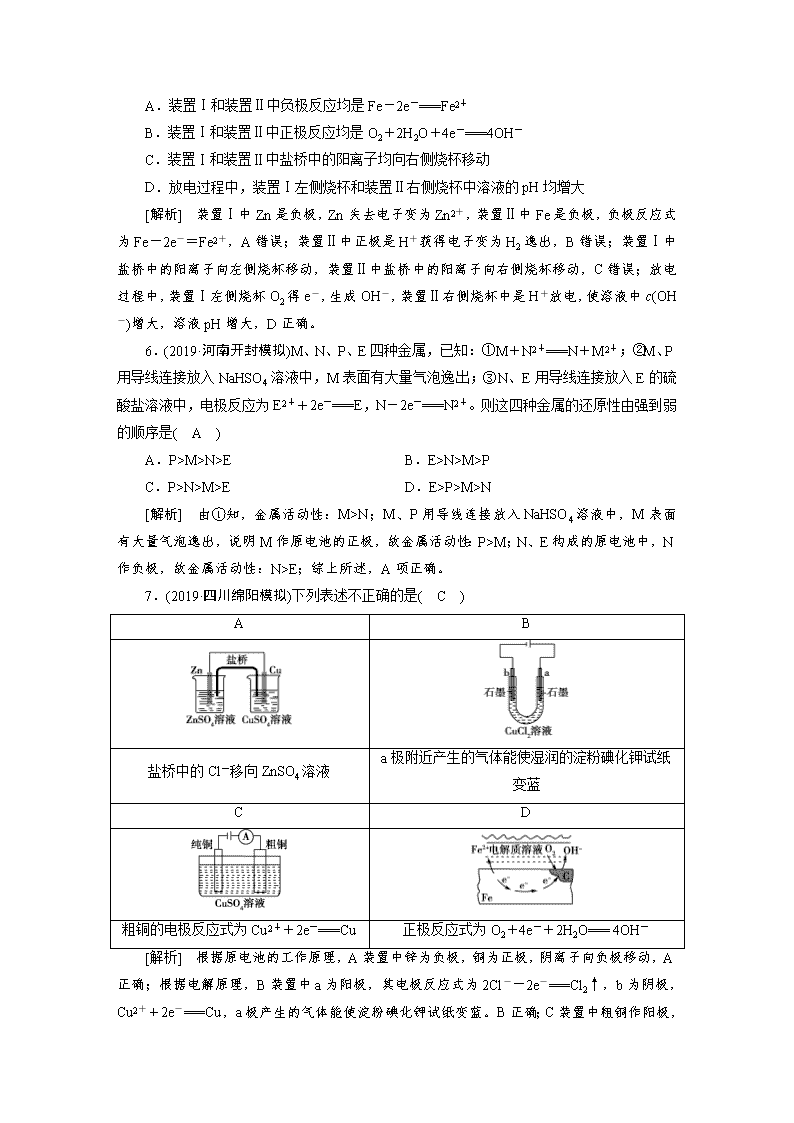
4.(2020·海南高三检测)根据下图,下列判断中正确的是( AB )
A.烧杯a中的溶液pH升高
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为2H++2e-===H2
D.烧杯b中发生的反应为2Cl--2e-===Cl2
[解析] 该装置是一个原电池装置,其中Fe作正极,Zn作负极,Fe电极发生的反应是O2+2H2O+4e-===4OH-,Zn电极发生的反应是Zn-2e-===Zn2+,故A、B两项正确。
5.(2020·山东滨州检测)如下图装置,下列说法正确的是( D )
A.装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-===Fe2+
B.装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-===4OH-
C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动
D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大
[解析] 装置Ⅰ中Zn是负极,Zn失去电子变为Zn2+,装置Ⅱ中Fe是负极,负极反应式为Fe-2e-=Fe2+,A错误;装置Ⅱ中正极是H+获得电子变为H2逸出,B错误;装置Ⅰ中盐桥中的阳离子向左侧烧杯移动,装置Ⅱ中盐桥中的阳离子向右侧烧杯移动,C错误;放电过程中,装置Ⅰ左侧烧杯O2得e-,生成OH-,装置Ⅱ右侧烧杯中是H+放电,使溶液中c(OH-)增大,溶液pH增大,D正确。
6.(2019·河南开封模拟)M、N、P、E四种金属,已知:①M+N2+===N+M2+;②M、P用导线连接放入NaHSO4溶液中,M表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为E2++2e-===E,N-2e-===N2+。则这四种金属的还原性由强到弱的顺序是( A )
A.P>M>N>E B.E>N>M>P
C.P>N>M>E D.E>P>M>N
[解析] 由①知,金属活动性:M>N;M、P用导线连接放入NaHSO4溶液中,M表面有大量气泡逸出,说明M作原电池的正极,故金属活动性:P>M;N、E构成的原电池中,N作负极,故金属活动性:N>E;综上所述,A项正确。
7.(2019·四川绵阳模拟)下列表述不正确的是( C )
A
B
盐桥中的Cl-移向ZnSO4溶液
a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝
C
D
粗铜的电极反应式为Cu2++2e-===Cu
正极反应式为O2+4e-+2H2O=== 4OH-
[解析] 根据原电池的工作原理,A装置中锌为负极,铜为正极,阴离子向负极移动,A正确;根据电解原理,B装置中a为阳极,其电极反应式为2Cl--2e-===Cl2↑,b为阴极,Cu2++2e-==
=Cu,a极产生的气体能使淀粉碘化钾试纸变蓝。B正确;C装置中粗铜作阳极,粗铜上发生失电子反应,C错误;D装置所示为钢铁发生的吸氧腐蚀,正极电极反应式为O2+2H2O+4e-===4OH-,D正确。
8.(2020·广州模拟)某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图为某实验小组依据的氧化还原反应:(用离子方程式表示) Fe+Cu2+===Fe2++Cu 。
设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过 0.2 mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为 2H++2e-===H2↑ ,这是由于NH4Cl溶液显 酸性 (填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因 NH+H2ONH3·H2O+H+ ,用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式 2Fe2++Cl2===2Fe3++2Cl- ,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:“溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO,试写出该反应的离子方程式: 2Fe3++3Cl2+8H2O===2FeO+6Cl-+16H+ 。
(3)其他条件不变,若将盐桥换成弯铜丝与石墨相连成n形,如图所示,一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是 溶液变红 ,电极反应为 O2+2H2O+4e-===4OH- ;乙装置中石墨(1)为 阴 极(填“正”“负”“阴”或“阳”),乙装置中与铜丝相连石墨(2)电极上发生的反应式为 2Cl--2e-===Cl2↑ ,产物常用 湿润的淀粉碘化钾试纸 检验,反应的离子方程式为 Cl2+2I-===2Cl-+I2 。
[解析] (1)若一段时间后,两电极质量相差12 g,消耗负极0.1 mol Fe,同时正极生成0.1 mol Cu,导线中通过0.2 mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,由于NH水解,NH+H2ONH3·H2O+H+,所以NH4Cl溶液显酸性,石墨电极上H+得到电子,电极反应式为2H+
+2e-===H2↑;铁电极反应式为Fe-2e-===Fe2+,用吸管吸出少许铁片附近溶液置于试管中,向其中滴加少量新制饱和氯水,发生反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-,然后滴加几滴硫氰化钾溶液,由于存在Fe3+,所以溶液变红,继续滴加过量新制饱和氯水,颜色褪去,如果原因是+3价铁被氧化为FeO,则该反应的离子方程式为2Fe3++3Cl2+8H2O===2FeO+6Cl-+16H+。
(3)如题图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n形,则甲池为原电池,铁电极反应为Fe-2e-===Fe2+,铜电极反应为O2+2H2O+4e-===4OH-;乙池为电解池,石墨(2)电极为阳极,电极反应为2Cl--2e-===Cl2↑,石墨(1)电极为阴极,电极反应为Cu2++2e-===Cu;所以一段时间后,在甲装置铜丝附近滴加酚酞试液,溶液变红,乙装置中石墨(2)电极产物可以用湿润的淀粉碘化钾试纸检验,反应的离子方程式为Cl2+2I-===2Cl-+I2。
B组 能力提升题
9.(2020·甘肃兰州一中检测)某同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如图所示原电池,盐桥中装有饱和溶液。下列说法正确的是( D )
A.b电极上发生还原反应
B.外电路电子的流向是从a到b
C.电池工作时,盐桥中的SO移向甲烧杯
D.a电极上发生的反应为MnO+8H++5e-===Mn2++4H2O
[解析] 根据氧化还原反应方程式可知,氧化剂是KMnO4,故a为正极,发生还原反应,A错误;a为正极,b为负极,电子沿外电路从负极流向正极,即电子从b流向a,B错误;原电池工作时,阴离子流向负极,即乙烧杯,C错误;a电极为正极,MnO得电子生成Mn2+,D正确。
10.(2020·河北保定调研考试)将以葡萄糖为燃料的微生物燃料电池甲与盛有足量硫酸铜溶液的装置乙相连,起始电路接入状况如图,以电流0.1 A,通电10 min后,将电池的正、负极互换接入,移动滑动变阻器,以电流0.2 A,继续通电10 min,结束实验。
下列有关说法正确的是( D )
A.葡萄糖在装置甲的正极参加反应,氧气在负极参加反应
B.在该电池反应中,每消耗1 mol氧气理论上能生成标准状况下二氧化碳11.2 L
C.电池工作20 min时,乙装置电极析出固体和电极上产生气体的质量之比为2︰1
D.电池工作15 min时,乙装置中铜棒的质量与起始通电前相等
[解析] 本题考查电化学知识,考查的化学核心素养是证据推理与模型认知。由题意可知,装置甲是以葡萄糖为燃料的微生物燃料电池,葡萄糖在负极失去电子发生氧化反应,氧气在正极得到电子发生还原反应,A项错误;在该电池中,发生的总反应为C6H12O6+6O2===6CO2+6H2O,则每消耗1 mol氧气理论上能生成标准状况下二氧化碳22.4 L,B项错误;由题意知,0~10 min,铜棒与电源正极相连,发生反应Cu-2e-===Cu2+,碳棒与电源负极相连,发生反应Cu2++2e-===Cu,通电10 min后将电池的正、负极互换接入,由于10~20 min时的电流是0~10 min时的2倍,则10~15 min碳棒上发生反应Cu-2e-===Cu2+,铜棒上发生反应Cu2++2e-===Cu,15 min时乙装置中铜棒即可恢复到起始通电前的状态,15~20 min碳棒上发生反应4OH--4e-===O2↑+2H2O,铜棒上发生反应Cu2++2e-===Cu,生成1 mol O2的同时析出2 mol Cu,则20 min时,乙装置电极析出固体和电极上产生气体的质量之比为4︰1,C项错误、D项正确。
[点拨] 对于燃料电池,加入燃料的一极为负极,通入氧气或空气的一极为正极。
11.(2020·河南郑州第一次质量预测)科学家设计了一种可以循环利用人体呼出的CO2并提供O2的装置,总反应方程式为2CO2===2CO+O2。下列说法正确的是( C )
A.由图分析N电极为正极
B.OH-通过离子交换膜迁向左室
C.阴极的电极反应为CO2+H2O+2e-===CO+2OH-
D.反应完毕,该装置中电解质溶液的碱性增强
[解析] 本题考查电化学知识,考查的核心素养是证据推理与模型认知。由题图可知N电极为负极,P电极为正极,A项错误;OH-通过阴离子交换膜迁向右室,B项错误;根据题图知,阴极发生的电极反应为:CO2+H2O+2e-===CO+2OH-,C项正确;根据总反应2CO2===2CO+O2,可知反应完毕装置中溶液的pH并无变化,故碱性不会增强,D项错误。
12.(2020·海南高三检测)(双选)锌空气电池的电容量大,可作为汽车的清洁能源。总反应式为:2Zn+O2+2H2O===2Zn(OH)2。示意图如图所示:
有关该电池的说法正确的是( CD )
A.电池可以用稀硫酸做电解质溶液
B.电池工作时,电子由a电极沿导线流向b电极
C.空气扩散电极上的电极反应:O2+2H2O+4e-===4OH-
D.阻隔空气进入锌-空气电池,电池停止工作
[解析] A.若用稀硫酸做电解质溶液,锌与稀硫酸反应放出氢气,正极氢离子得电子生成氢气,故A错误;B.电池工作时,锌是负极,所以电子由b电极沿导线流向a电极,故B错误;C.空气扩散电极是正极,正极上氧气得电子生成氢氧根离子,电极反应是O2+2H2O+4e-===4OH-,故C正确;D.阻隔空气进入锌-空气电池,正极上缺少了氧气,电池停止工作,故D正确,答案选CD。
13.(2020·福建福州质量抽测)锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移至MnO2晶格中,生成LiMnO2。以下表述不正确的是( B )
A.a电极电势比b电极电势低
B.混合有机溶剂可用浓NaOH溶液替代
C.电池工作时负极反应为Li-e-===Li+
D.外电路未接通时,电解质溶液中离子不会定向移动
[解析] 本题考查锂锰电池的工作原理。根据Li+通过电解质迁移至MnO2晶格中,可知b为正极,a为负极,故a电极电势比b电极电势低,A项正确;由于金属Li能与水反应,故混合有机溶剂不能用浓NaOH溶液替代,B项错误;a为负极,电池工作时负极上Li发生氧化反应:Li-e-===Li+
,C项正确;外电路未接通时,电解质溶液中离子自由移动,不会定向移动,D项正确。
14.(2020·山东青岛高三检测)(双选)已知反应AsO+2I-+2H+AsO+I2+H2O是可逆反应。设计如图装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导体作用),分别进行下述操作:(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,(Ⅱ)向(B)烧杯中逐滴加入40%NaOH溶液。结果均发现电流计指针偏转。据此,下列判断正确的是( BC )
A.两次操作过程中指针偏转方向相同
B.两次操作过程中指针偏转方向相反
C.(Ⅰ)操作过程中C2棒上发生的反应为:AsO+2e-+2H+===AsO+H2O
D.(Ⅱ)操作过程中C1棒上发生的反应为:2I--2e-=I2
[解析] 因为反应是可逆反应,所以当加入浓盐酸时,可增大氢离子浓度,平衡向正反应方向移动,此时碘离子失去电子,发生氧化反应,所以C1为负极,C2为正极得到电子,发生还原反应;当加入氢氧化钠溶液时,氢氧化钠可以中和氢离子,导致氢离子浓度降低,平衡向逆反应方向移动,此时AsO失去电子,发生氧化反应,所以C2为负极,C1为正极,得到电子,发生还原反应,据此分析。两次操作过程,反应方向相反,电子流向相反,指针偏转方向相反,故A错误,B正确;(Ⅰ)操作过程中C2为正极得到电子,发生的反应为AsO+2e-+2H+===AsO+H2O,故C正确;(Ⅱ)操作过程中C1为正极,得到电子,发生还原反应,I2+2e-=2I-,故D错误。
15.(2020·经典习题选粹)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为
Pb+PbO2+4H++2SO2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时,正极的电极反应式是 PbO2+2e-+4H++SO===PbSO4+2H2O
;电解液中H2SO4的浓度将变 小 ;当外电路通过1 mol电子时,理论上负极板的质量增加 48 g。
(2)在完全放电耗尽PbO2和Pb时,若按题图连接,电解一段时间后,则在A电极上生成 Pb ,B电极上生成 PbO2 ,此时铅蓄电池的正负极的极性将 对换 。
[解析] (1)根据装置和电池反应判断:负极是Pb,正极是PbO2,放电时的电极反应为负极:Pb-2e-+SO===PbSO4;正极:PbO2+2e-+4H++SO===PbSO4+2H2O,反应中H2SO4不断被消耗,故浓度变小,又根据电极反应判断两极均有PbSO4生成,每转移1 mol电子,两极均有0.5 mol PbSO4生成,对于负极将增加0.5 mol SO,质量为96 g·mol-1×0.5 mol=48 g。
(2)按题图连接后,变为电解池,A极上发生的反应为PbSO4+2e-===Pb+SO,而B极上发生的反应为PbSO4+2H2O-2e-===PbO2+4H++SO,故A、B两极上将分别生成Pb和PbO2,且工作时蓄电池正负极的极性已对换。
16.(2020·河北衡水检测)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。
(1)氢氧燃料电池的能量转化形式主要是 化学能转化为电能 ,在导线中电子流动方向为 a→b (用a、b和箭头表示)。
(2)负极反应式为 H2-2e-+2OH-===2H2O 。
(3)电极表面镀铂粉的原因为 增大电极单位面积吸附H2和O2的分子数,加快电极反应速率 。
(4)氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术。有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气。光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素[CO(NH2)2](C为+4价)的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。
①图1中N型半导体为 负极 (填“正极”或“负极”)
②该系统工作时,A极的电极反应式为 CO(NH2)2+8OH--6e-===CO+N2↑+6H2O 。
③若A极产生7.00 g N2,则此时B极产生 16.8 L H2(标准状况下)。
[解析] (1)氢氧燃料电池属于原电池,是将化学能转化为电能的装置,所以该燃料电池中能量转化形式主要是化学能转化为电能;燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,电子从负极沿导线流向正极,所以通入氢气的电极是负极、通入氧气的电极是正极,电子流动方向为a到b。(2)碱性氢氧燃料电池中,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为H2-2e-+2OH-===2H2O。(3)反应物接触面积越大,反应速率越大,电极表面镀铂粉能增大吸附气体的能力,所以能增大反应速率。(4)①该电池反应时,氮元素化合价由-3价变为0价,氢元素化合价由+1价变为0价,则氮元素被氧化,氢元素被还原,所以生成氮气的电极A是阳极,生成氢气的电极B是阴极,则图1中N型半导体为负极,P型半导体为正极;②A极为阳极,电极反应式为:CO(NH2)2+8OH--6e-===CO+N2↑+6H2O;③根据分析可知,若A极产生7.00 g N2即0.25 mol N2,则转移电子是1.5 mol,此时B极产生H2,电极反应式:2H2O+2e-===H2↑+2OH-,转移1.5 mol电子,标准状况下,产生氢气的体积:×22.4 L·mol-1=16.8 L。