- 607.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
河北省2020届高三全国Ⅰ卷模拟试卷12
一、选择题:本题共 7 小题,每小题 6 分,共 42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.《新修本草》是我国古代中药学著作之一,记载药物844种,其中有关于“青矾”的描述:“绛矾,本来绿色,新出窟未见风者,正如瑠璃……烧之赤色……”据此推测,“青矾”的主要成分为( )
A.CuSO4·5H2O B.FeSO4·7H2O
C.KAl(SO4)2·12H2O D.Fe2(SO4)3·9H2O
解析:选B “青矾”的描述为“本来绿色,新出窟未见风者,正如瑠璃……烧之赤色……”,青矾是绿色,经煅烧后,分解成粒度非常细而活性又很强的Fe2O3超细粉末为红色。A项,CuSO4·5H2O为蓝色晶体,错误;B项,FeSO4·7H2O是绿色晶体,正确;C项,KAl(SO4)2·12H2O是无色晶体,错误;D项,Fe2(SO4)3·9H2O为黄色晶体,错误。
答案:B
8. NA是阿伏加德罗常数的值。下列说法正确的是( )
A. 电解精炼铜时,阳极质量减小64g,转移电子数为
B. 100g质量分数为的乙醇溶液中含有氢原子数为
C. 固体中含有离子总数为
D. 浓盐酸与足量加热充分反应,生成的数目为
解析:A、电解法精炼铜,阳极是铜、铁、锌、镍失电子,当阳极质量减少 64g 时,外电路通过电子数不是 2NA,故A错误;B、100g质量分数为46%的乙醇溶液中,乙醇的物质的量为=1mol,H2O的物质的量为=3mol,乙醇溶液中含有氢原子数为(1mol×6+3mol×2)×NAmol-1=12NA,故B正确;C、7.8gNa2O2固体中含有离子总数为0.3NA,故C错误;D、随着反应的进行,浓盐酸变稀就不反应了,故D错误;
答案:B。
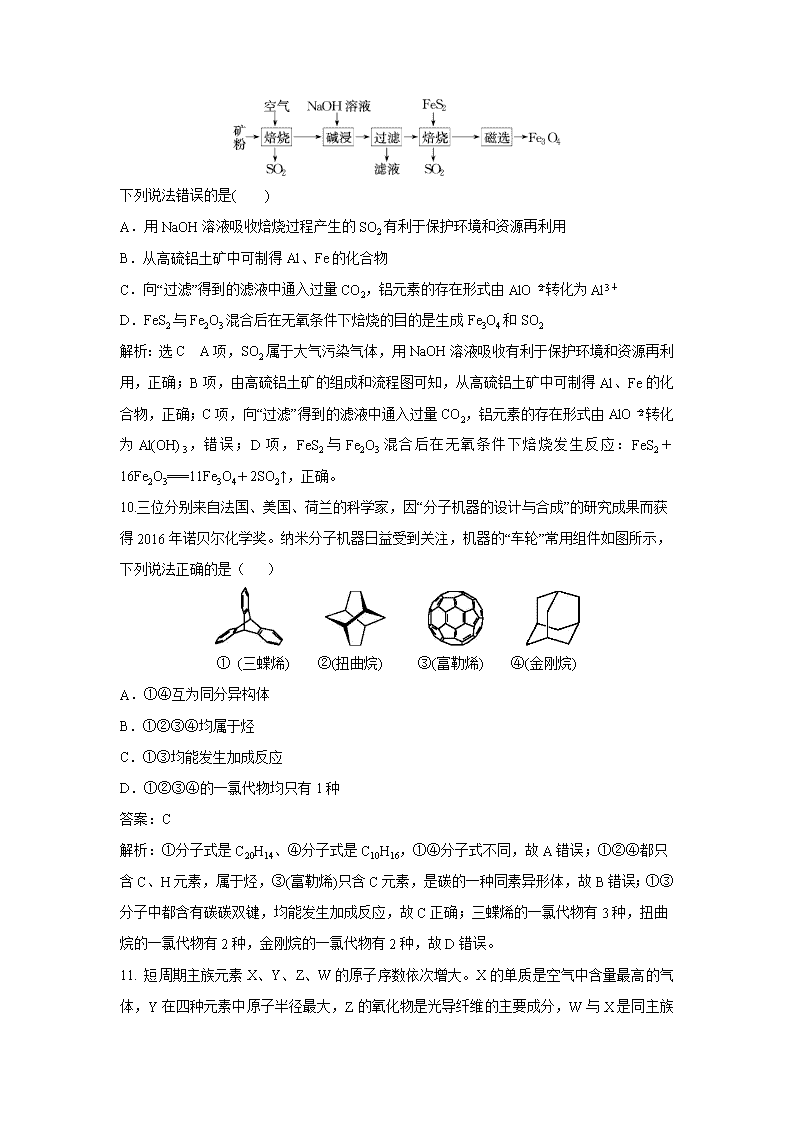
9.以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,含少量FeS2)为原料,生产Fe3O4的部分工艺流程如下:
下列说法错误的是( )
A.用NaOH溶液吸收焙烧过程产生的SO2有利于保护环境和资源再利用
B.从高硫铝土矿中可制得Al、Fe的化合物
C.向“过滤”得到的滤液中通入过量CO2,铝元素的存在形式由AlO转化为Al3+
D.FeS2与Fe2O3混合后在无氧条件下焙烧的目的是生成Fe3O4和SO2
解析:选C A项,SO2属于大气污染气体,用NaOH溶液吸收有利于保护环境和资源再利用,正确;B项,由高硫铝土矿的组成和流程图可知,从高硫铝土矿中可制得Al、Fe的化合物,正确;C项,向“过滤”得到的滤液中通入过量CO2,铝元素的存在形式由AlO转化为Al(OH)3,错误;D项,FeS2与Fe2O3混合后在无氧条件下焙烧发生反应:FeS2+16Fe2O3===11Fe3O4+2SO2↑,正确。
10.三位分别来自法国、美国、荷兰的科学家,因“分子机器的设计与合成”的研究成果而获得2016年诺贝尔化学奖。纳米分子机器日益受到关注,机器的“车轮”常用组件如图所示,下列说法正确的是( )
① (三蝶烯) ②(扭曲烷) ③(富勒烯) ④(金刚烷)
A.①④互为同分异构体
B.①②③④均属于烃
C.①③均能发生加成反应
D.①②③④的一氯代物均只有1种
答案:C
解析:①分子式是C20H14、④分子式是C10H16,①④分子式不同,故A错误;①②④都只含C、H元素,属于烃,③(富勒烯)只含C元素,是碳的一种同素异形体,故B错误;①③分子中都含有碳碳双键,均能发生加成反应,故C正确;三蝶烯的一氯代物有3种,扭曲烷的一氯代物有2种,金刚烷的一氯代物有2种,故D错误。
11.
短周期主族元素X、Y、Z、W的原子序数依次增大。X的单质是空气中含量最高的气体,Y在四种元素中原子半径最大,Z的氧化物是光导纤维的主要成分,W与X是同主族元素。下列叙述正确的是( )
A.离子半径XNa+,错误;B项,Na3N含有离子键,Si3N4含有共价键,错误;C项,由于NH3分子间存在氢键,故氢化物沸点NH3>PH3,错误;D项,非金属性越强,最高价氧化物的水化物的酸性越强,非金属性Sic(HA-)>c(A2-)
D.在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-)
解析:选C A项,据图可知,H2A溶液中不存在H2A分子,说明H2A第一步完全电离,HA-、A2-共存,说明H2A第二步部分电离,所以H2A的电离方程式为H2A===H++HA-,HA-A2-+H+,正确;B项,据图可知,当pH=3时,c(A2-)=c(HA-),电离平衡HA-A2-+H+的平衡常数Ka==c(H+)=10-3,正确;C项,HA-A2-+H+的平衡常数Ka=10-3,A2-水解平衡常数是 =10-11<10-3,HA-的电离程度大于A2- 的水解程度,所以c(HA-)”或“<”)。
(3)[Cu(NH3)4]SO4 中阴离子的立体构型是__________;中心原子的轨道杂化类型为________________,[Cu(NH3)4]SO4 中Cu2+与NH3之间形成的化学键称为_______________。
(4)用Cu作催化剂可以氧化乙醇生成乙醛,乙醛再被氧化成乙酸,等物质的量的乙醛与乙酸中σ键的数目比为________________________。
(5)氯、铜两种元素的电负性如表:
元素
Cl
Cu
电负性
3.2
1.9
CuCl属于______________(填“共价”或“离子”)化合物。
(6)Cu与Cl形成某种化合物的晶胞如图所示,该晶体的密度为ρ g·cm-3,晶胞边长为a cm,则阿伏加德罗常数为________(用含ρ、a的代数式表示,相对原子质量:Cu—64 ,Cl—35.5)。
答案:(1)发射光谱 (2)K 3d104s1 > (3)正四面体 sp3 配位键 (4)6∶7 (5)共价 (6) mol-1
解析:(5)Cl与Cu的电负性之差为3.2-1.9=1.3,电负性差值小于1.7,故CuCl属于共价化合物。
(6)晶胞中黑色球数目为4、白色球数目为8×+6×=4,该化合物为CuCl,晶胞质量为4×=ρ g·cm-3×(a cm)3,整理可得NA= mol-1。
36.(2019·济南市高三模拟)辣椒的味道主要源自于所含的辣椒素,具有消炎、镇痛、麻醉和戒毒等功效,特别是其镇痛作用与吗啡相若且比吗啡更持久。辣椒素(F)的结构简式为,其合成路线如下:
已知:R—OHR—Br
R—Br+R′—Na―→R′—R+NaBr
回答下列问题:
(1)辣椒素的分子式为____________,A所含官能团的名称是__________________,D的最简单同系物的名称是__________。
(2)A→B的反应类型为____________,写出C→D的化学方程式:______________________
__________________________________________________。
(3)写出同时符合下列三个条件的D的同分异构体的结构简式:__________________。
①能使溴的四氯化碳溶液褪色
②能发生水解反应,产物之一为乙酸
③核磁共振氢谱为三组峰,且峰面积比为3∶2∶1
(4)4戊烯酸(CH2===CHCH2CH2COOH)可用作农药、医药中间体。参照以上合成路线,设计由CH2===CHCH2OH为起始原料制备4戊烯酸的合成路线:___________________________
________________________________________________________________________。
答案:(1)C18H27O3N 碳碳双键、溴原子 丙烯酸 (2)取代反应
(CH3)2CHCH===CH(CH2)3CH(COOH)2(CH3)2CHCH===CH(CH2)4COOH+CO2↑
(3)
(4)CH2===CHCH2OHCH2===CHCH2Br
CH2===CHCH2CH(COOCH2CH3)2CH2===CHCH2CH(COOH)2
CH2===CHCH2CH2COOH
解析:根据题给“已知”和流程以及D的分子式,较易推断出合成路线中各物质的结构简式:
A:(CH3)2CHCH===CH(CH2)3Br,
B:(CH3)2CHCH===CH(CH2)3CH(COOCH2CH3)2,
C:(CH3)2CHCH===CH(CH2)3CH(COOH)2,
D:(CH3)2CHCH===CH(CH2)4COOH,
E:(CH3)2CHCH===CH(CH2)4COCl。
(3)D的分子式为C10H18O2,不饱和度为2。满足题给条件的D的同分异构体含有碳碳双键、CH3COO—、3种H原子(分别为9、6、3个)。应有三种甲基,各3、2、1个,且同种甲基连在同一碳原子上或处于分子对称位置。符合题意的同分异构体为。
(4)由CH2===CHCH2OH为起始原料合成CH2===CHCH2CH2COOH,分子中增加2个碳原子。流程中A→B→C→D分子中净增2个碳原子,故直接模仿写出制备4戊烯酸的合成路线:CH2===CHCH2OHCH2===CHCH2Br
CH2===CHCH2CH(COOCH2CH3)2CH2===CHCH2CH(COOH)2
CH2===CHCH2CH2COOH。