- 164.00 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
水溶液中的离子平衡
1.已知温度 T 时水的离子积常数为 Kw,该温度下,将浓度为 a mol·L-1
的一元酸 HA 与 b mol·L-1 的一元碱 BOH 等体积混合,可判定该溶液呈中性的
依据是( )
A.a=b
B.混合溶液的 pH=7
C.混合溶液中,c(H+)= Kw mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
答案 C
解析 a=b 只能说明酸碱恰好完全反应,生成盐和水,由于酸碱强弱未知,
不能说明溶液呈中性,A 错误;题给温度未指明是 25 ℃,所以 pH=7 并不能说
明溶液呈中性,B 错误;由于混合溶液中 c(H+)= Kw,结合 Kw=c(H+)·c(OH-),
可推断出 c(H+)=c(OH-),所以溶液一定呈中性,C 正确;电荷守恒表达式是正
确的,无论溶液是否呈中性都满足此式,D 错误。
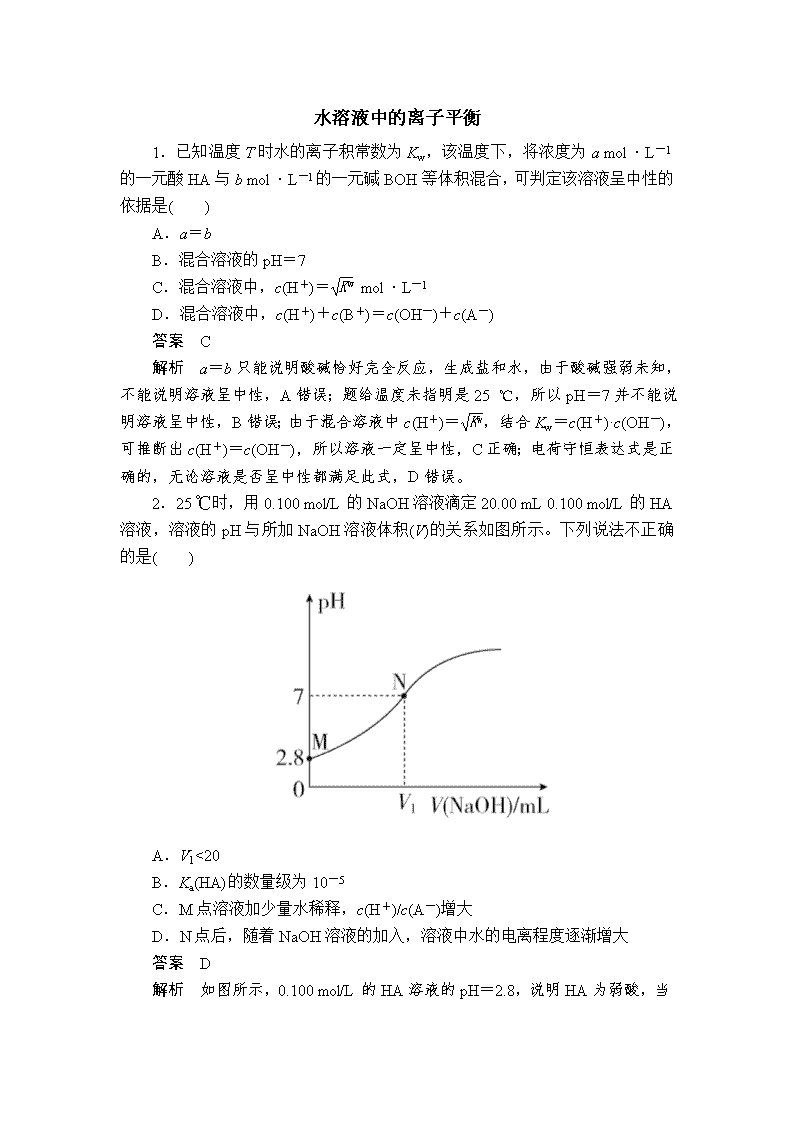
2.25 ℃时,用 0.100 mol/L 的 NaOH 溶液滴定 20.00 mL 0.100 mol/L 的 HA
溶液,溶液的 pH 与所加 NaOH 溶液体积(V)的关系如图所示。下列说法不正确的
是( )
A.V1<20
B.Ka(HA)的数量级为 10-5
C.M 点溶液加少量水稀释,c(H+)/c(A-)增大
D.N 点后,随着 NaOH 溶液的加入,溶液中水的电离程度逐渐增大
答案 D
解析 如图所示,0.100 mol/L 的 HA 溶液的 pH=2.8,说明 HA 为弱酸,当
HA 与 NaOH 恰好反应完时,所得到的溶液 pH>7,当滴定到 pH=7 时,表明消
耗的 V(NaOH)<20 mL,A 正确;Ka(HA)=c(H+)·c(A-)
c(HA)
=10-2.8×10-2.8
0.1-10-2.8
≈
10-5.6
0.1
=10-4.6=100.4×10-5,B 正确;M 点溶液存在两个电离:HA H++A-,
H2O H++OH-,加水稀释时,c(H+)减小的程度比 c(A-)减小的程度小,
c(H+)
c(A-)
增大,C 正确;N 点后,加入 NaOH 溶液生成 NaA 的过程中,水的电离
程度是逐渐增大的,恰好变为 NaA 溶液后,继续滴加 NaOH 溶液,水的电离程
度是逐渐减小的,D 错误。
3.室温下,下列溶液中微粒浓度关系一定正确的是( )
A.0.1 mol/L Na2CO3 溶液,加水稀释,c(HCO-
3 )
c(CO2-
3 )
减小
B.pH=7 的氨水与氯化氨的混合溶液中:c(Cl-)>c(NH+
4 )
C.0.1 mol/L 的硫酸铝溶液中:c(SO2-
4 )>c(Al3+)>c(H+)>c(OH-)
D.pH=2 的醋酸溶液和 pH=12 的 NaOH 溶液等体积混合:c(Na + )=
c(CH3COO-)+c(CH3COOH)
答案 C
解析 Na2CO3 溶液中存在碳酸根离子的水解平衡,CO2-
3 +H2O HCO-
3 +
OH-,c(HCO-
3 )
c(CO2-
3 )
= Kh
c(OH-),加水稀释,溶液的碱性减弱,但水解平衡常数(Kh)
不变,因此c(HCO-
3 )
c(CO2-
3 )
增大,A 错误;氨水与氯化铵的混合溶液存在电荷守恒:
c(OH-)+c(Cl-)=c(NH+
4 )+c(H+),室温下,混合液 pH=7,则 c(OH-)=c(H+),
故 c(Cl-)=c(NH+
4 ),B 错误,硫酸铝溶液中铝离子水解,溶液显酸性,则 c(SO2-
4 )
>c(Al3+)>c(H+)>c(OH-),C 正确;醋酸的浓度大于氢氧化钠的浓度,等体积
混合后醋酸过量,c(Na+)<c(CH3COO-)+c(CH3COOH),D 错误。
4.下列关于溶液的说法错误的是( )
①NaHCO3 溶液加水稀释, c(Na+)
c(HCO-
3 )
增大
②浓度均为 0.1 mol·L-1 的 Na2CO3、NaHCO3 混合溶液:2c(Na+)=3[c(CO2-
3 )
+c(HCO-
3 )]
③在 0.1 mol·L-1 氨水中滴加 0.1 mol·L-1 盐酸,恰好中和时溶液的 pH=a,
则由水电离产生的 c(OH-)=10-a mol·L-1
④向 0.1 mol·L-1 Na2SO3 溶液中加入少量 NaOH 固体,c(Na+)、c(SO2-
3 )均增
大
⑤Na2S 稀溶液中:c(H+)=c(OH-)+c(H2S)+c(HS-)
A.②⑤ B.①③④ C.①③ D . ③
④
答案 A
解析 加水稀释 NaHCO3 溶液,促进 HCO -
3 的水解,n(HCO-
3 )减少,而 n(Na
+)不变, c(Na+)
c(HCO-
3 )
增大,①正确;Na2CO3、NaHCO3 物质的量浓度相同,相
当于按物质的量 1∶1 混合,根据 Na 和 C 守恒,有 2c(Na+)=3[c(CO2-
3 )+c(HCO-
3 )
+c(H2CO3)],②不正确;0.1 mol·L-1 氨水中滴加 0.1 mol·L-1 盐酸,恰好中和生
成 NH4Cl,NH4Cl 溶液中由水电离产生的 c(OH-)与溶液中的 c(H+)相等,c(OH-)
水=c(H+)=10-a mol·L-1,③正确;加入少量 NaOH 固体,c(Na+)增大,c(OH-)
增大,使 SO2-
3 +H2O HSO-
3 +OH-平衡逆向移动,c(SO2-
3 )增大,④正确;根
据质子守恒,有 c(OH-)=c(H+)+2c(H2S)+c(HS-),⑤不正确。
5.已知部分弱酸的电离平衡常数如下表:
弱酸 HCOOH HCN H2CO3
电离平衡常数(25 ℃) K=1.77×10-4 K=5.0×10-10 K1=4.3×10-7
K2=5.6×10-11
下列叙述错误的是( )
A.NaCN 溶液中通入少量 CO2 发生的离子反应为:CN-+H2O+CO2===HCN
+HCO-
3
B.等体积、等物质的量浓度的 HCOONa 和 NaCN 溶液中所含阴离子总数
前者大于后者
C.等物质的量浓度的 NaHCO3 和 Na2CO3 混合溶液中:c(Na + )>c(OH
-)>c(HCO-
3 )>c(CO2-
3 )>c(H+)
D.中和等体积、等 pH 的 HCOOH 溶液和 HCN 溶液消耗 NaOH 的物质的
量前者小于后者
答案 C
解析 向 NaCN 溶液中通入少量 CO2,因为酸性:H2CO3>HCN>HCO-
3 ,故
反应生成 HCN 和碳酸氢钠,不能生成 CO2-
3 ,反应的离子方程式为:CN-+H2O
+CO2===HCN+HCO-
3 ,A 正确;根据电荷守恒定律:c(Na+)+c(H+)=c(OH-)
+c(CN-)和 c(Na+)+c(H+)=c(OH-)+c(HCOO-),由于甲酸的酸性大于 HCN,
所以等物质的量浓度的 HCOONa 和 NaCN 溶液,NaCN 溶液水解能力强,c(OH
-)较大,c(H+)相对较小,由于两溶液 c(Na+)相等,所以 HCOONa 溶液中所含阴
离子总数大于 NaCN 溶液所含阴离子总数,B 正确;碳酸钠溶液中碳酸根离子水
解 能 力 大 于 碳 酸 氢 钠 溶 液 中 碳 酸 氢 根 离 子 水 解 能 力 , 所 以 溶 液 中
c(HCO-
3 )>c(CO2-
3 );由于溶液中的 c(OH-)主要是由 c(HCO-
3 )和 c(CO2-
3 )水解产生
的,所以 c(HCO-
3 )>c(CO2-
3 )>c(OH-),C 错误;由于酸性 HCOOH 大于 HCN,所
以等体积、等 pH 的 HCOOH 溶液和 HCN 溶液,HCN 溶液的浓度较大,HCN
溶质的量较大,消耗 NaOH 的物质的量较多,即中和等体积、等 pH 的 HCOOH
溶液和 HCN 溶液消耗 NaOH 的物质的量前者小于后者,D 正确。
6.常温下,下列说法不正确的是( )
A.0.2 mol·L-1 的 NaHCO3 溶液中:c(Na+)>c(HCO-
3 )>c(OH-)>c(H+)
B.0.02 mol·L-1 的 NaOH 溶液与 0.04 mol·L-1 的 NaHC2O4 溶液等体积混合:
2c(OH-)+c(C2O2-
4 )=c(HC2O-
4 )+2c(H+)
C.叠氮酸(HN3)与醋酸酸性相近,0.1 mol·L-1 NaN3 水溶液中离子浓度大
小顺序为:c(Na+)>c(N-
3 )>c(OH-)>c(H+)
D.向氨水中逐滴滴入盐酸至溶液的 pH=7,则混合液中 c(NH+
4 )=c(Cl-)
答案 B
解析 NaHCO3 溶液呈碱性,溶液中离子浓度关系为 c(Na+)>c(HCO-
3 )>c(OH
-)>c(H+),A 正确;混合后得到等物质的量浓度的 Na2C2O4、NaHC2O4 的混合溶
液,根据电荷守恒得:c(OH-)+ 2c(C2O2-
4 )+c(HC2O-
4 )=c(Na+)+c(H+),根据物
料守恒得:2c(Na+)=3[c(C2O2-
4 )+c(HC2O-
4 )+c(H2C2O4)],消去 c(Na+),得:2c(OH
-)-c(C2O2-
4 )=c(HC2O-
4 )+3c(H2C2O4)+2c(H+),B 错误;NaN3 为强碱弱酸盐,
N -
3 水解使溶液呈碱性,c(Na+)>c(N-
3 )>c(OH-)>c(H+),C 正确;根据电荷守恒得:
c(NH+
4 )+c(H+)=c(Cl-)+c(OH-),pH=7,则 c(OH-)=c(H+),故 c(NH+
4 )=c(Cl
-),D 正确。
7.在一隔热系统中,向 20.00 mL 0.01000 mol·L-1 的醋酸溶液中逐滴加入
0.01000 mol·L-1 的 NaOH 溶液,测得混合溶液的温度变化如下图所示。下列相关
说法错误的是( )
A.从 b 点到 c 点的溶液中:c(CH3COOH)
c(CH3COO-)
逐渐减小
B.a 点对应溶液中存在:c(CH3COO-)-c(Na+)=c(H+)-c(OH-)
C.b 点和 c 点对应的溶液中,Kw 相同
D.b 点溶液中存在:c(OH-)=c(CH3COOH)+c(H+)
答案 C
解析 b 点醋酸与氢氧化钠恰好反应生成醋酸钠,醋酸钠溶液中存在水解平
衡:CH3COO-+H2O CH3COOH+OH-,继续加入氢氧化钠,氢氧根离子浓
度增大,使水解平衡左移,则从 b 点到 c 点的溶液中:c(CH3COOH)
c(CH3COO-)
逐渐减小,
A 正确;a 点溶液中溶质为等浓度的醋酸和醋酸钠,据电荷守恒有 c(Na+)+c(H+)
=c(CH3COO-)+c(OH-),即 c(CH3COO-)-c(Na+)=c(H+)-c(OH-),B 正确;b
点和 c 点对应的溶液温度不同,Kw 不相同,C 错误;b 点醋酸与氢氧化钠恰好反
应生成醋酸钠,醋酸钠溶液中存在质子守恒:c(OH-)=c(CH3COOH)+c(H+),D
正确。
8.已知锌及其化合物的性质与铝及其化合物相似。如图横坐标为溶液的 pH,
纵坐标为 Zn2+或[Zn(OH)4]2-的物质的量浓度的对数。25 ℃时,下列说法中不正
确的是( )
A.往 ZnCl2 溶液中加入过量氢氧化钠溶液,反应的离子方程式为 Zn2++4OH
-===[Zn(OH)4]2-
B.若要从某废液中完全沉淀 Zn2+,通常可以调控该溶液的 pH 在 8.0~12.0
之间
C.pH=8.0 与 pH=12.0 的两种废液中,Zn2+浓度的比值为 108
D.该温度时,Zn(OH)2 的溶度积常数(Ksp)为 1×10-10
答案 D
解析 根据图像,往 ZnCl2 溶液中加入过量 NaOH 溶液,Zn2 + 最终以
[Zn(OH)4]2-的形式存在,故离子方程式为:Zn2++4OH-===[Zn(OH)4]2-,A 正确;
控制溶液的 pH 在 8.0~12.0 之间时,可以将该废液中的 Zn2+完全沉淀,B 正确;
由 a 点可知 pH=7.0 即 c(OH-)=10-7 mol·L-1 时,lg c(Zn2+)=-3.0,即 c(Zn2+)
=10-3 mol·L-1,则 Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-)=10-3×(10-7)2=10-17,pH
=8.0 即 c(OH-)=10-6 mol·L-1 时,c(Zn2+)=Ksp[Zn(OH)2]
c2(OH-)
= 10-17
(10-6)2 mol·L
- 1 =10 - 5 mol· L - 1 ,pH = 12.0 即 c(OH - )= 10 - 2 mol·L - 1 时 , c(Zn2 + )=
Ksp[Zn(OH)2]
c2(OH-)
= 10-17
(10-2)2 mol·L-1=10-13 mol·L-1,故两种废液中 Zn2+浓度
的比值为 10-5
10-13
=108,C 正确,D 错误。
9.一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5 的 H2S 溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a 的氨水,稀释 10 倍后,其 pH=b,则 a=b+1
C.pH=2 的 H2C2O4 溶液与 pH=12 的 NaOH 溶液任意比例混合:c(Na+)+
c(H+)=c(OH-)+c(HC2O-
4 )
D . 已 知 酸 性 CH3COOH>H2CO3>HClO , 则 pH 相 同 的 ①CH3COONa
②NaHCO3 ③NaClO 三种溶液的 c(Na+):①>②>③
答案 D
解析 pH=5 的 H2S 溶液中 H+的浓度为 1×10-5 mol·L-1,但是 HS-的浓
度会小于 H+的浓度,H+来自于 H2S 的第一步电离、HS-的电离和水的电离,故
H+的浓度大于 HS-的浓度,A 错误;弱碱不完全电离,弱碱稀释 10 倍时,pH
减小不到一个单位,a碳酸>次氯酸,根据越弱越水解的原则,pH 相同的三种
钠盐,浓度的大小关系为醋酸钠>碳酸氢钠>次氯酸钠,则钠离子的浓度为
①>②>③,故 D 正确。
10.某温度时,卤化银(AgX,X=Cl、Br、I)的 3 条溶解平衡曲线如图所示,
AgCl、AgBr、AgI 的 Ksp 依次减小。已知 pAg=-lg c(Ag+),pX=-lg c(X-),
利用 pX、pAg 的坐标系可表示出 AgX 的溶度积与溶液中 c(Ag+)和 c(X-)的相互
关系。下列说法错误的是( )
A.A 线是 AgCl 的溶解平衡曲线
B.坐标点 p 形成的溶液是 AgCl 的不饱和溶液
C.m 点可以是在水中加入足量的 AgBr 形成的饱和溶液
D.n 点表示由过量的 KI 与 AgNO3 反应产生 AgI 沉淀
答案 D
解析 由题意可知,c(Ag+)、c(X-)越大,pAg、pX 越小,由于 AgCl 的 Ksp
最大,故 A 线表示 AgCl 的溶解平衡曲线,A 正确;p 点位于 AgCl 的溶解平衡
曲线上方,其形成的溶液为 AgCl 的不饱和溶液,B 正确;B 线为 AgBr 的溶解
平衡曲线,m 点位于 AgBr 的溶解平衡曲线上,则 m 点溶液是 AgBr 的饱和溶液,
C 正确;C 线表示 AgI 的溶解平衡曲线,n 点位于 AgI 的溶解平衡曲线上,n 点
表示 KI 与过量的 AgNO3 反应生成 AgI 沉淀,D 错误。
11.25 ℃时,往 HA 溶液中滴加 NaOH 溶液,溶液中 HA 和 A-二者中各自
所占的物质的量分数(α)随溶液 pH 变化的关系如图所示。下列说法正确的是
( )
A.在 pH=5 的溶液中,c(A-)=c(HA),c(OH-)=c(H+)
B.pH=7 的溶液中,α(HA)=0,α(A-)=1.0
C.25 ℃时,Ka(HA)=1×10-5
D.pH=5 时,溶液中水电离产生的 c(H+)=1×10-5 mol·L-1
答案 C
解析 25 ℃时,pH=5 的溶液呈酸性,c(H+)>c(OH-),A 错误;HA 溶液
中含 HA 分子,说明 HA 为弱酸,根据题意,pH=7 的溶液应该为 HA 和 NaA
的混合液,α(HA)≠0,B 错误;25 ℃时,根据图像信息,pH=5 时,c(HA)=
c(A-),Ka=c(A-)·c(H+)
c(HA)
=c(H+)=1×10-5,C 正确;pH=5 时为 HA 和 NaA
的混合溶液,存在三个平衡:HA H + +A - ,H2O H + +OH - ,A - +
H2O HA+OH-,可以看出溶液中 c(H+)来自于水和 HA 的电离,而 c(OH-)
完全来自于水,则溶液中的水电离产生的 c(H+)=c(OH-)=1×10-9 mol·L-1,D
错误。