- 590.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
湖北省武汉市2020届高三下学期3月质量检测
可能用到的相对原子质量:H1 C12 N14 O16 Cl35.5 Ca40 Ni59
一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
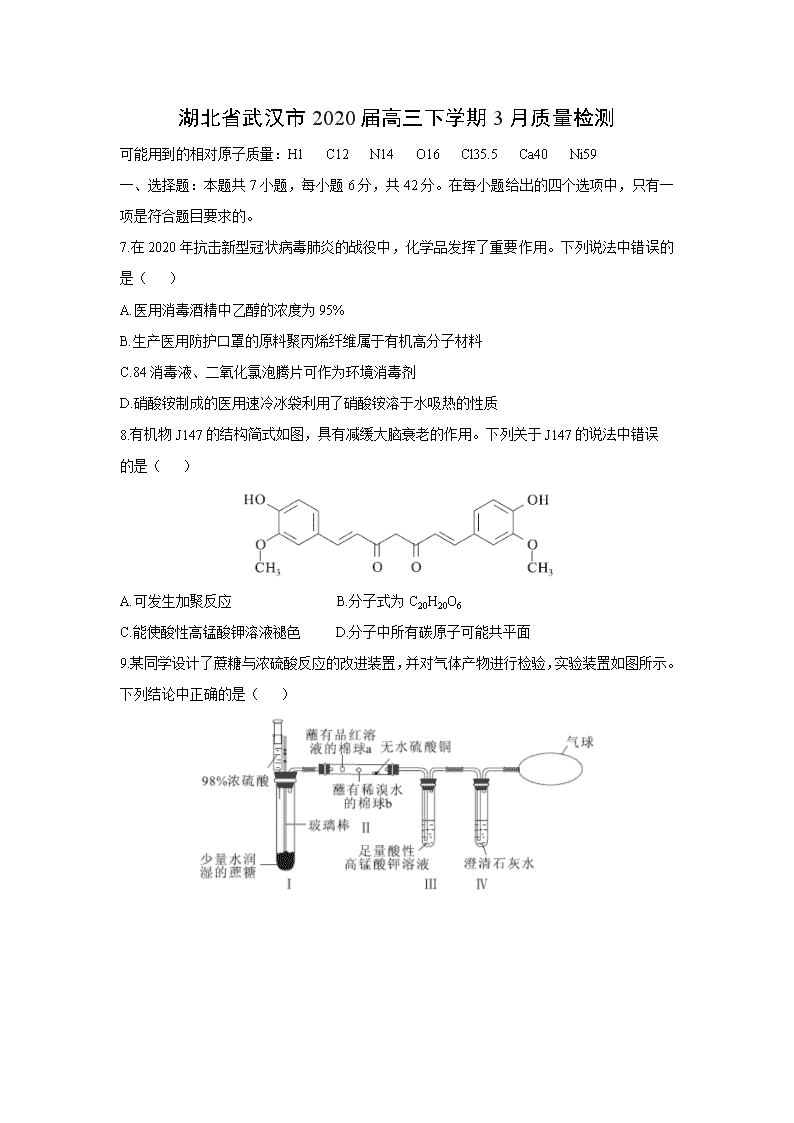
7.在2020年抗击新型冠状病毒肺炎的战役中,化学品发挥了重要作用。下列说法中错误的是( )
A.医用消毒酒精中乙醇的浓度为95%
B.生产医用防护口罩的原料聚丙烯纤维属于有机高分子材料
C.84消毒液、二氧化氯泡腾片可作为环境消毒剂
D.硝酸铵制成的医用速冷冰袋利用了硝酸铵溶于水吸热的性质
8.有机物J147的结构简式如图,具有减缓大脑衰老的作用。下列关于J147的说法中错误
的是( )
A.可发生加聚反应 B.分子式为C20H20O6
C.能使酸性高锰酸钾溶液褪色 D.分子中所有碳原子可能共平面
9.某同学设计了蔗糖与浓硫酸反应的改进装置,并对气体产物进行检验,实验装置如图所示。下列结论中正确的是( )
10.CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意
图如下:
下列说法中错误的是 ( )
A.过程①→②是吸热反应
B.Ni是该反应的催化剂
C.过程①→②既有碳氧键的断裂,又有碳氧键的形成
D.反应的总化学方程式可表示为:CH4+CO22CO+2H2
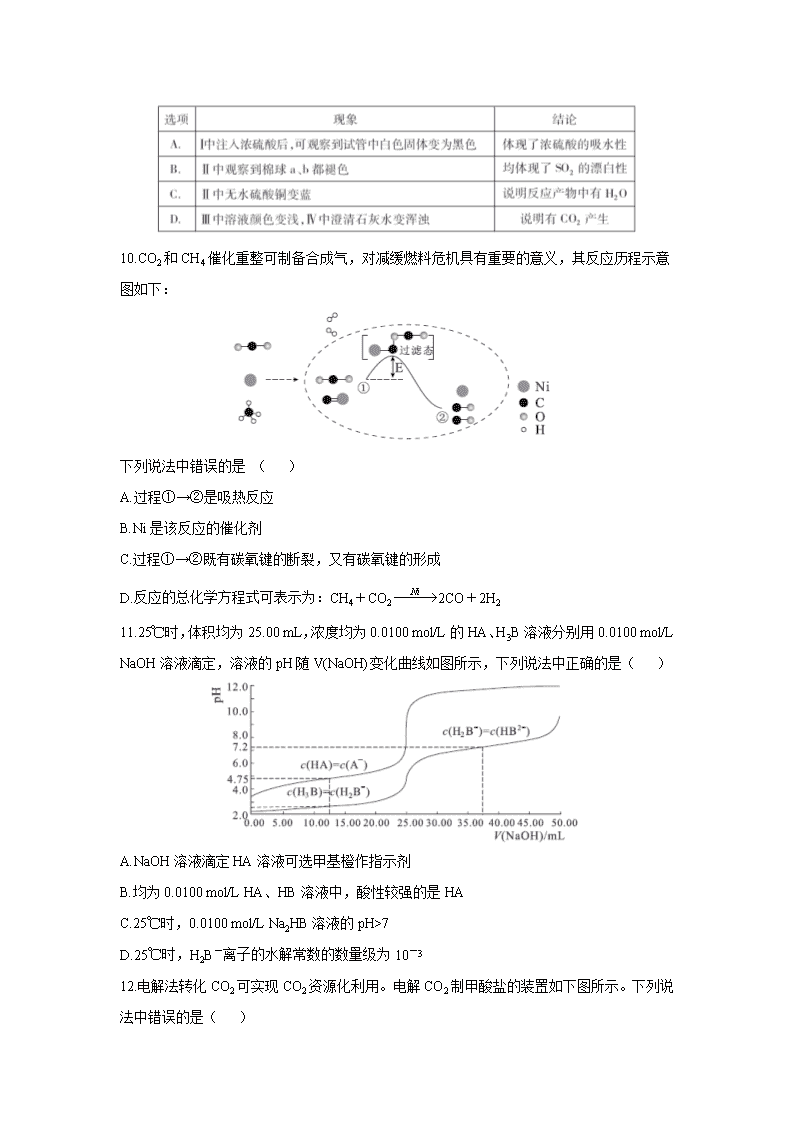
11.25℃时,体积均为25.00 mL,浓度均为0.0100 mol/L的HA、H3B溶液分别用0.0100 mol/L NaOH溶液滴定,溶液的pH随V(NaOH)变化曲线如图所示,下列说法中正确的是( )
A.NaOH溶液滴定HA溶液可选甲基橙作指示剂
B.均为0.0100 mol/L HA、HB溶液中,酸性较强的是HA
C.25℃时,0.0100 mol/L Na2HB溶液的pH>7
D.25℃时,H2B-离子的水解常数的数量级为10-3
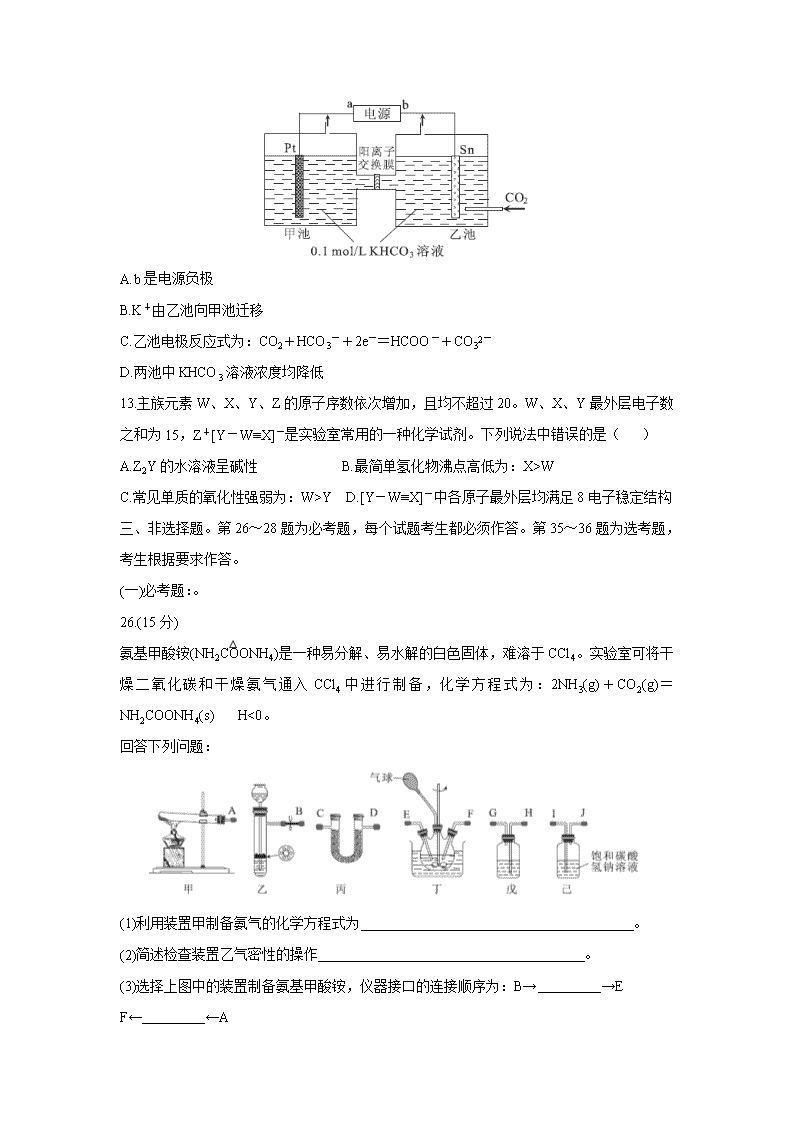
12.电解法转化CO2可实现CO2资源化利用。电解CO2制甲酸盐的装置如下图所示。下列说法中错误的是( )
A.b是电源负极
B.K+由乙池向甲池迁移
C.乙池电极反应式为:CO2+HCO3-+2e-=HCOO-+CO32-
D.两池中KHCO3溶液浓度均降低
13.主族元素W、X、Y、Z的原子序数依次增加,且均不超过20。W、X、Y最外层电子数之和为15,Z+[Y-W≡X]-是实验室常用的一种化学试剂。下列说法中错误的是( )
A.Z2Y的水溶液呈碱性 B.最简单氢化物沸点高低为:X>W
C.常见单质的氧化性强弱为:W>Y D.[Y-W≡X]-中各原子最外层均满足8电子稳定结构
三、非选择题。第26~28题为必考题,每个试题考生都必须作答。第35~36题为选考题,考生根据要求作答。
(一)必考题:。
26.(15分)
氨基甲酸铵(NH2COONH4)是一种易分解、易水解的白色固体,难溶于CCl4。实验室可将干燥二氧化碳和干燥氨气通入CCl4中进行制备,化学方程式为:2NH3(g)+CO2(g)=NH2COONH4(s) △H<0。
回答下列问题:
(1)利用装置甲制备氨气的化学方程式为 。
(2)简述检查装置乙气密性的操作 。
(3)选择上图中的装置制备氨基甲酸铵,仪器接口的连接顺序为:B→ →E
F← ←A
(4)反应时为了增加氨基甲酸铵的产量,三颈瓶的加热方式为 (填“热水浴”或“冷水浴”);丁中气球的作用是 。
(5),从装置T的混合物中分离出产品的方法是 (填写操作名称)。
(6)取因吸潮变质为碳酸氢铵的氨基甲酸铵样品11.730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥、称量,质量为15.000g。则样品中氨基甲酸铵的质量分数为 (已知:Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100。计算结果保留3位有效数字)。
27.(14分)
我国是以煤炭为主要能源的发展中国家,煤炭燃烧产生的烟气中含有大量的NOx和SO2,带来了严重的大气污染。某化工小组进行了ClO2协同氨水法脱除模拟烟气中NOx和SO2的实验研究,其流程如下:
回答下列问题:
(1)制备“模拟烟气”时应首先向装置管道内通入 ,目的是 。
(2)“喷淋液”中所含ClO2可通过向酸性氯酸钠溶液中加入葡萄糖的方法制备,同时产生CO2等物质,则该反应的离子方程式为 ,还可将葡萄糖替换为 (填字母标号)。
A.FeCl3溶液 B.SO3 C.甲醇 D.酸性KMnO4溶液
(3)利用ClO2协同氨水进行脱硫脱硝净化时,污染性气体脱除效率变化情况如右图所示,则该脱除技术的最佳温度应为 ℃,喷淋塔中可能产生的一种副产物的化学式为 ,该物质的常见用途是 。
(4)传统湿式氨法烟气处理技术以尿素[CO(NH2)2]热水解产生的NH3溶于水为喷淋液。在催化剂作用下,喷淋除去NO过程中有一种无污染气体生成,该反应的化学方程式为 。
(5)该化工小组设定模拟烟气流量a m3/h,进口NO质量浓度b mg/m3,吸收液循环量c L/h,通过离子色谱测定脱除前后吸收液中主要离子浓度如下表所示,则NO的脱除率为
(用含有a、b、c的代数式表示)。
注:“——”表示该离子低于检测极限,可以认为不存在。
28.(14分)
三甲胺【N(CH3)3】是重要的化工原料。最近我国科学家实现了使用铜催化剂将N,N-二甲基甲酰胺【(CH3)2NCHO,简称DMF】转化为三甲胺的合成路线。回答下列问题:
(1)结合实验与计算机模拟结果,研究单一DMF分子在铜催化剂表面的反应历程,如下图所示:
该历程中最大能垒(活化能)= eV,该步骤的化学方程式为 。
(2)该反应变化的△H 0(填“<”、“>”或“=”),制备三甲胺的热化学方程式为 。
(3)160℃时,将DMF(g)和H2(g)以物质的量之比为1:2充入盛有催化剂的刚性容器中,容器内起始压强为p0,达到平衡时DMF的转化率为25%,则该反应的平衡常数Kp= (Kp为以分压表示的平衡常数);能够增大DMF平衡转化率同时加快反应速率的操作是 。
(4)三甲胺是鱼腥臭的主要来源,是判断海水鱼类鲜度的化学指标之一。通过传感器产生的电流强度可以监测水产品中三甲胺的含量,一种燃料电池型三甲胺气体传感器的原理如右图所示。外电路的电流方向为 (填“a→b”或“b→a”),负极的电极反应式为 。
(二)选考题:
35.[化学——选修3:物质结构与性质](15分)
2019年10月1日,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态铁原子的价电子排布式为 。
(2)与Gr同周期且基态原子最外层电子数相同的元素,可能位于周期表中的 区。
(3)实验室常用KSCN溶液、苯酚()检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为 (用元素符号表示),苯酚中碳原子的杂化轨道类型为 。
(4)铁元素能与CO形成Fe(CO)5。羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1 mol Fe(CO)5分子中含 mol σ键,与CO互为等电子体的一种离子的化学式为 。
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的 空隙和 空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B(,0,),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为 。
(6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为 ,晶胞参数为428 pm,则晶体密度为 g/m3(NA表示阿伏伽德罗常数的值,列出表达式)。
36.[化学——选修5:有机化学基础](15分)
化合物J是一种重要的医药中间体,其合成路线如下:
回答下列问题:
(1)G中官能团的名称是 ;③的反应类型是 。
(2)通过反应②和反应⑧推知引入-SO3H的作用是 。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出F与足量氢气反应生成产物的结构简式,并用星号(*)标出其中的手性碳 。
(4)写出⑨的反应方程式 。
(5)写出D的苯环上有三个不相同且互不相邻的取代基的同分异构体结构简式 。
(6)写出以对硝基甲苯为主要原料(无机试剂任选),经最少步骤制备含肽键聚合物的合成路线 。
【参考答案】