- 389.00 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020届一轮复习人教版 电化学 课时作业
1.(2018·黄石调研)纸电池是一种有广泛应用的“软电池”,碱性纸电池采用薄层纸片作为载体和传导体,纸的两面分别附着锌和二氧化锰。下列有关该纸电池的说法不合理的是( )
A.Zn为负极,发生氧化反应
B.电池工作时,电子由MnO2流向Zn
C.正极反应:MnO2+H2O+e-===MnO(OH)+OH-
D.电池总反应:Zn+2MnO2+2H2O===Zn(OH)2+2MnO(OH)
解析:选B 纸电池采用薄层纸片作为载体和传导体,纸的两面分别附着锌和二氧化锰,Zn是活泼金属,作该电池的负极,失去电子发生氧化反应,A正确;电池工作时,电子由负极流向正极,即电子由Zn流向MnO2,B错误;类似于锌锰干电池,MnO2在正极上得电子被还原生成MnO(OH),则正极的电极反应为MnO2+H2O+e-===MnO(OH)+OH-,C正确;负极反应为Zn+2OH--2e-===Zn(OH)2,结合正、负极反应式及得失电子守恒可知,该电池的总反应为Zn+2MnO2+2H2O===Zn(OH)2+2MnO(OH),D正确。
2.用钠金属片和碳纳米管作为电极材料,以高氯酸钠—四甘醇二甲醚为电解液,可制得“可充室温钠—二氧化碳电池”,电池总反应为4Na+3CO22Na2CO3+C,生成的固体Na2CO3沉积在碳纳米管上,下列关于该电池的叙述正确的是( )
A.放电时的正极反应为CO2+4e-===C+2O2-
B.充电时碳纳米管接直流电源的负极
C.放电时每消耗3 mol CO2,转移4 mol电子
D.充电时阴极反应为
C+2Na2CO3-4e-===4Na++3CO2↑
解析:选C 该电池放电时,正极上CO2得电子,结合Na+生成C和Na2CO3,A选项不正确;充电时,碳纳米管应接直流电源的正极,作阳极,B选项不正确;放电时每消耗3 mol CO2,可生成1 mol C,转移4 mol电子,C选项正确;充电时阴极反应式为Na++e-===Na,D选项不正确。
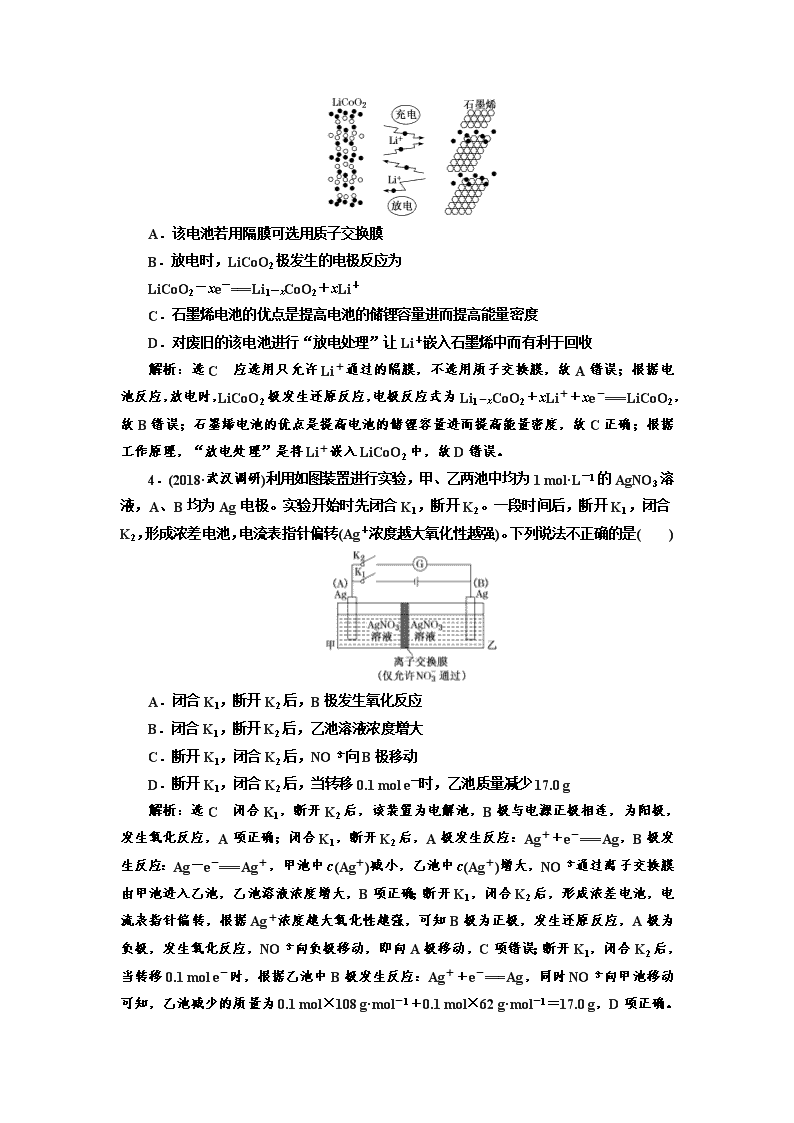
3.(2018·青岛质检)中国企业华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2C6+
LiCoO2,其工作原理如图。下列关于该电池的说法正确的是( )
A.该电池若用隔膜可选用质子交换膜
B.放电时,LiCoO2极发生的电极反应为
LiCoO2-xe-===Li1-xCoO2+xLi+
C.石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
D.对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
解析:选C 应选用只允许Li+通过的隔膜,不选用质子交换膜,故A错误;根据电池反应,放电时,LiCoO2极发生还原反应,电极反应式为Li1-xCoO2+xLi++xe-===LiCoO2,故B错误;石墨烯电池的优点是提高电池的储锂容量进而提高能量密度,故C正确;根据工作原理,“放电处理”是将Li+嵌入LiCoO2中,故D错误。
4.(2018·武汉调研)利用如图装置进行实验,甲、乙两池中均为1 mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始时先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流表指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是( )
A.闭合K1,断开K2后,B极发生氧化反应
B.闭合K1,断开K2后,乙池溶液浓度增大
C.断开K1,闭合K2后,NO向B极移动
D.断开K1,闭合K2后,当转移0.1 mol e-时,乙池质量减少17.0 g
解析:选C 闭合K1,断开K2后,该装置为电解池,B极与电源正极相连,为阳极,发生氧化反应,A项正确;闭合K1,断开K2后,A极发生反应:Ag++e-===Ag,B极发生反应:Ag-e-===Ag+,甲池中c(Ag+)减小,乙池中c(Ag+)增大,NO通过离子交换膜由甲池进入乙池,乙池溶液浓度增大,B项正确;断开K1,闭合K2后,形成浓差电池,电流表指针偏转,根据Ag+浓度越大氧化性越强,可知B极为正极,发生还原反应,A极为负极,发生氧化反应,NO向负极移动,即向A极移动,C项错误;断开K1,闭合K2后,当转移0.1 mol e-时,根据乙池中B极发生反应:Ag++e-===Ag,同时NO向甲池移动可知,乙池减少的质量为0.1 mol×108 g·mol-1+0.1 mol×62 g·mol-1=17.0 g,D项正确。
5.下列有关金属腐蚀与防护的说法正确的是( )
A.常温下,断开K时,若M溶液为浓硫酸,则铁发生化学腐蚀
B.闭合K,若M为氯化钠,则铁极的电极反应式为O2+4e-+2H2O===4OH-
C.闭合K,若M为硫酸铵,则石墨极的电极反应式为2H++2e-===H2↑
D.闭合K,若M溶液为海水,石墨换成铜或银,则为外加电流的阴极保护法
解析:选C 常温下,断开K时,M溶液为浓硫酸,Fe在浓硫酸中发生钝化,不能发生化学腐蚀,A错误;闭合K,M溶液为NaCl溶液,则Fe发生吸氧腐蚀,Fe作负极,电极反应式为Fe-2e-===Fe2+,B错误;闭合K,M为(NH4)2SO4,由于NH发生水解而使溶液呈酸性,发生析氢腐蚀,石墨作正极,电极反应式为2H++2e-===H2↑,C正确;闭合K,M为海水,石墨换成Cu或Ag,由于Fe的活泼性强于Cu、Ag,形成原电池时,Cu或Ag作正极受到保护,这种方法称为牺牲阳极的阴极保护法,D错误。
6.NaS电池的结构如图所示,电池反应为2Na+S8===Na2Sn。下列说法不正确的是( )
A.熔钠电极作电池的负极
B.放电时,Na+向正极移动
C.充电时,熔钠电极与电源的正极相连
D.充电时,阳极反应式为8S-16e-===nS8
解析:选C 由电池总反应可知,Na发生氧化反应生成Na+,则熔钠电极作电池的负极,A正确;放电时,阳离子向正极移动,阴离子向负极移动,则Na+向正极移动,B正确;充电时,二次电池的正极与外加电源的正极相连,负极与外加电源的负极相连,故熔钠电极与电源的负极相连,C错误;充电时,阳极上S发生氧化反应生成S8,电极反应式为8S-16e-===nS8,D正确。
7.(2018·太原一模)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2===H2O2+S,已知甲池中发生的反应为
下列说法正确的是( )
A.甲池中碳棒上发生的电极反应式为
AQ+2H+-2e-===H2AQ
B.乙池溶液中发生的反应式为
H2S+I===3I-+S↓+2H+
C.该装置中电能转化为光能
D.H+从甲池移向乙池
解析:选B 根据题图中的电子流向可判断出甲池中碳棒是正极,该电极上发生得电子的还原反应,即AQ+2H++2e-===H2AQ,A错误;在乙池中,硫化氢失电子生成硫单质,I得电子生成I-,发生的反应式为H2S+I===3I-+S↓+2H+,B正确;根据题图中信息可知该装置将光能转化为电能,C错误;该装置是原电池装置,原电池中阳离子移向正极,甲池中碳棒是正极,所以H+从乙池移向甲池,D错误。
8.(2018·潍坊统考)根据光合作用原理,设计如图原电池装置。下列说法正确的是( )
A.a电极为原电池的正极
B.外电路电流方向是a→b
C.b电极的电极反应式为O2+2e-+2H+===H2O2
D.a电极上每生成1 mol O2,通过质子交换膜的H+为2 mol
解析:选C 根据题图可知,a电极上H2O转化为H+和O2,发生氧化反应,则a电极为原电池的负极,A项错误;a电极为负极,b电极为正极,外电路电流方向应从正极到负极,即b→a,B项错误;根据题图可知,b电极上O2得电子转化为H2O2
,电极反应式为O2+2e-+2H+===H2O2,C项正确;a电极上每生成1 mol O2,转移4 mol电子,则通过质子交换膜的H+为4 mol,D项错误。
9.(2018·衡水中学模拟)一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是( )
A.电极丁的电极反应式为MnO-e-===MnO
B.电极乙附近溶液的pH减小
C.KOH溶液的质量分数:c%>a%>b%
D.导线中流过2 mol电子时,理论上有2 mol K+移入阴极区
解析:选C 分析两装置的特点可以判断左边是燃料电池,右边是电解池。通氧气的甲电极是燃料电池的正极,与此电极相连的丁电极是电解池的阳极,则丁电极上MnO被氧化为MnO。丙电极为阴极,阴极上水电离产生的H+放电被还原为H2,所以X为H2。丁电极的电极反应式为MnO-e-===MnO,A正确;乙电极上发生的反应式为H2-2e-+2OH-===2H2O,氢氧根离子浓度减小,所以附近溶液的pH减小,B正确;丙电极上发生反应式为2H2O+2e-===H2↑+2OH-,甲电极上发生反应式为O2+4e-+2H2O===4OH-,根据溶液流向可判断KOH溶液的质量分数:c%>b%>a%,C不正确;导线中流过2 mol电子时,理论上有2 mol K+移入阴极区,D正确。
10.目前固体电解质在制备全固态电池及传感器、探测器等方向的应用日益广泛。利用RbAg4I5(靠Ag+迁移)晶体可制成电化学气敏传感器,如图是一种测定O2含量的气体传感器示意图。被分析的O2可以透过聚四氟乙烯薄膜,由电池电动势变化可以得知O2的含量。下列说法正确的是( )
A.传感器中的反应为4AlI3+3O2===2Al2O3+6I2
B.传感器工作过程中Ag+向Ag电极迁移
C.正极反应式为I2+2Rb++2e-===2RbI
D.通过11.2 L O2时有2 mol电子通过电位计
解析:选A 分析题图可知,O2透过聚四氟乙烯膜与碘化铝反应生成I2,I2在石墨电极上发生还原反应,所以,负极反应式为Ag-e-===Ag+,正极反应过程为I2+2e-===2I
-、I-+Ag+===AgI,正极总反应式为2Ag++I2+2e-===2AgI。A项,碘离子的还原性强,O2氧化碘化铝生成氧化铝和碘单质,正确;B项,银离子向正极迁移,石墨电极为正极,错误;C项,正极反应式为2Ag++I2+2e-===2AgI,错误;D项,没有指明温度、压强,不能根据O2体积计算氧气的物质的量,错误。
11.(2019届高三·潍坊统考)如图是发表于《科技进展》的一种能够捕捉CO2的电化学装置。下列说法正确的是( )
A.该装置将电能转化为化学能
B.正极的电极反应式为2CO2+2e-===C2O
C.每生成1 mol的草酸铝,外电路中转移3 mol电子
D.随着反应的进行,草酸盐的浓度减小
解析:选B 该装置为原电池,能将化学能转化为电能,A项错误;根据题图,正极上CO2发生还原反应,转化为C2O,电极反应式为2CO2+2e-===C2O,B项正确;草酸铝的化学式为Al2(C2O4)3,每生成1 mol草酸铝,外电路中转移6 mol电子,C项错误;电池总反应式为2Al+6CO2===Al2(C2O4)3,电池工作过程中消耗的是空气中的CO2和Al电极,而没有消耗草酸盐,故D项错误。
12.(2018·湖北联考)通过电解乙二醛制备乙二酸(HOOC—COOH)的装置如图所示,通电后,b电极上产生的氯气将乙二醛氧化为乙二酸,下列说法正确的是( )
A.b极接电源的负极,发生还原反应
B.a极上的电极反应为2H2O-4e-===O2↑+4H+
C.盐酸的作用是提供Cl-和增强导电性
D.电路上每转移1 mol电子产生45 g乙二酸
解析:选C b极上Cl-发生失电子的氧化反应,生成氯气,b极为电解池的阳极,应接电源的正极,故A错误;a极是阴极,电极反应为2H++2e-===H2↑,故B错误;盐酸的作用是提供Cl-和增强导电性,故C正确;b极产生的氯气将乙二醛氧化为乙二酸:2Cl2+OHC—CHO+2H2O===HOOC—COOH+4HCl,电路上每转移1 mol电子产生0.25 mol乙二酸,即22.5 g,故D错误。
13.电解法处理氮氧化物废气有较高的环境效益和经济效益(图中电极均为石墨)。
(1)电解NO制备NH4NO3原理如图1所示。
①阳极为________(填“X”或“Y”),Y的电极反应式为
________________________________________________________________________。
②为使电解产物完全转化为NH4NO3,需要补充的物质A的化学式为________。
(2)用图2装置进行模拟电解NO2气体实验,可回收硝酸。
①电解时NO2发生反应的电极反应式为___________________________________
_____________________________________________________________________________
________________________________________________________________________。
②若有标准状况下2.24 L NO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为________mol。
解析:(1)①通过分析装置图1可知Y极上NO转化为NO,则该电极是阳极,失去电子发生氧化反应,电极反应式为NO+2H2O-3e-===NO+4H+。②X电极反应式为NO+6H++5e-===NH+H2O;生成一个NH需要得到5个电子,生成一个NO需要失去3个电子,根据转移电子相等知,生成的NH浓度小于NO浓度,要使NO完全转化为NH4NO3,应该加入NH3,所以加入的A为NH3。(2)①通过分析装置图2知左室为电解池的阴极,电极反应式为2H2O+2e-===H2↑+2OH-,右室为电解池的阳极,NO2发生氧化反应生成硝酸,电极反应式为NO2+H2O-e-===NO+2H+。②根据阴、阳两极的电极反应式知若有标准状况下 2.24 L NO2被吸收,转移电子0.1 mol,阴极区生成的OH-为0.1 mol,为维持电荷守恒通过阳离子交换膜的H+为0.1 mol。
答案:(1)①Y NO+2H2O-3e-===NO+4H+ ②NH3
(2)①NO2+H2O-e-===NO+2H+ ②0.1
14.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作为电解质,向负极充入燃料气CH4,用空气与CO2的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中,CO移向________(填“正”或“负”)极,已知CH4发生反应的电极反应式为CH4+4CO-8e-===5CO2+2H2O,则另一极的电极反应式为___
________________________________________________。
(2)利用上述燃料电池,按如图1所示装置进行电解,A、B、C、D均为铂电极,回答下列问题。
Ⅰ.甲槽电解的是200 mL一定浓度的NaCl与CuSO4的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。
①原混合溶液中NaCl的物质的量浓度为______mol·L-1,CuSO4的物质的量浓度为________mol·L-1。
②t2时所得溶液的pH=________。
Ⅱ.乙槽为200 mL CuSO4溶液,乙槽内电解的总离子方程式:____________________
_____________________________________________:
①当C极析出0.64 g物质时,乙槽溶液中生成的H2SO4为________mol。电解后,若使乙槽内的溶液完全复原,可向乙槽中加入________(填字母)。
A.Cu(OH)2 B.CuO
C.CuCO3 D.Cu2(OH)2CO3
②若通电一段时间后,向所得的乙槽溶液中加入0.2 mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为________。
解析:(1)燃料电池工作过程中,熔融盐中的阴离子向负极移动,即CO移向负极。CH4在负极发生氧化反应生成CO2和H2O,该燃料电池的总反应式为CH4+2O2===CO2+2H2O,结合得失电子守恒、负极反应式和电池总反应式推知,正极反应式为O2+2CO2+4e-===2CO。(2)Ⅰ.①A、B、C、D均为惰性电极Pt,甲槽电解NaCl和CuSO4的混合液,阳极上离子放电顺序为Cl->OH->SO,阴极上离子放电顺序为Cu2+>H+>Na+,开始阶段阴极上析出Cu,阳极上产生Cl2,则题图2中曲线Ⅰ代表阴极产生气体体积的变化,曲线Ⅱ代表阳极产生气体体积的变化。阳极上发生的反应依次为2Cl--2e-===Cl2↑、4OH--4e-===2H2O+O2↑,由曲线Ⅱ可知,Cl-放电完全时生成224 mL Cl2,根据Cl原子守恒可知,溶液中c(NaCl)==0.1 mol·L-1;阴极上发生的反应依次为Cu2++2e-===Cu、2H++2e-===H2↑,由曲线Ⅱ可知Cu2+放电完全时,阳极上产生224 mL Cl2和112 mL O2,则电路中转移电子的物质的量为0.01 mol×2+0.005 mol×4=0.04 mol,据得失电子守恒可知n(Cu2+)=0.04 mol×=0.02 mol,故混合液中c(CuSO4)==0.1 mol·L-1。②0~t1时间内相当于电解CuCl2,电解反应式为CuCl2Cu+Cl2↑,t1~t2
时间内相当于电解CuSO4,而电解CuSO4溶液的离子反应为2Cu2++2H2O2Cu+O2↑+4H+,则生成H+的物质的量为0.005 mol×4=0.02 mol,则有c(H+)==0.1 mol·L-1,故溶液的pH=1。Ⅱ.电解CuSO4溶液时,Cu2+在阴极放电,水电离的OH-在阳极放电,电解的总离子方程式为2Cu2++2H2O2Cu+O2↑+4H+。①C极为阴极,电极反应式为Cu2++2e-===Cu,析出0.64 g Cu(即0.01 mol)时,生成H2SO4的物质的量也为0.01 mol。电解CuSO4溶液时,阴极析出Cu,阳极上产生O2,故可向电解质溶液中加入CuO、CuCO3等使电解质溶液完全复原。②加入0.2 mol Cu(OH)2相当于加入0.2 mol CuO和0.2 mol H2O,则电解过程中转移电子的物质的量为0.2 mol×2+0.2 mol×2=0.8 mol,即0.8NA个电子。
答案:(1)负 O2+2CO2+4e-===2CO
(2)Ⅰ.①0.1 0.1 ②1
Ⅱ.2Cu2++2H2O2Cu+O2↑+4H+
①0.01 BC ②0.8NA