- 399.58 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
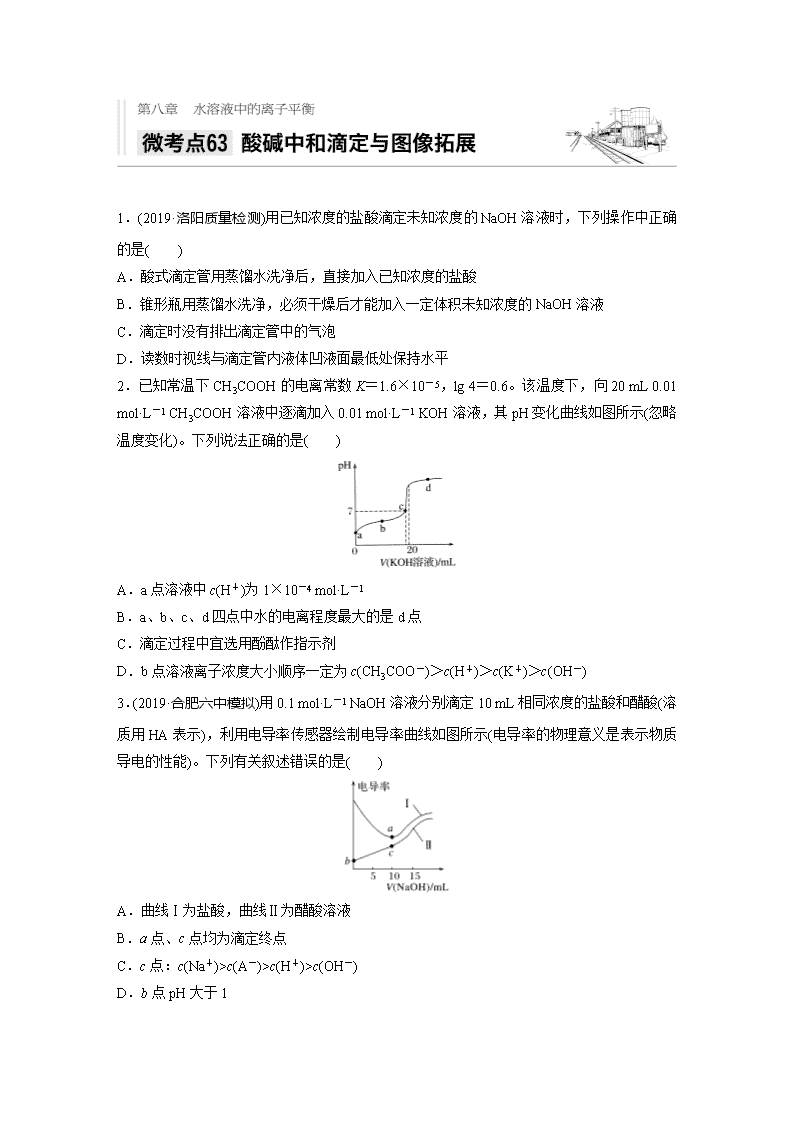
1.(2019·洛阳质量检测)用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确的是( )
A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸
B.锥形瓶用蒸馏水洗净,必须干燥后才能加入一定体积未知浓度的NaOH溶液
C.滴定时没有排出滴定管中的气泡
D.读数时视线与滴定管内液体凹液面最低处保持水平
2.已知常温下CH3COOH的电离常数K=1.6×10-5,lg 4=0.6。该温度下,向20 mL 0.01 mol·L-1 CH3COOH溶液中逐滴加入0.01 mol·L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法正确的是( )
A.a点溶液中c(H+)为1×10-4 mol·L-1
B.a、b、c、d四点中水的电离程度最大的是d点
C.滴定过程中宜选用酚酞作指示剂
D.b点溶液离子浓度大小顺序一定为c(CH3COO-)>c(H+)>c(K+)>c(OH-)
3.(2019·合肥六中模拟)用0.1 mol·L-1 NaOH溶液分别滴定10 mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示(电导率的物理意义是表示物质导电的性能)。下列有关叙述错误的是( )
A.曲线Ⅰ为盐酸,曲线Ⅱ为醋酸溶液
B.a点、c点均为滴定终点
C.c点:c(Na+)>c(A-)>c(H+)>c(OH-)
D.b点pH大于1
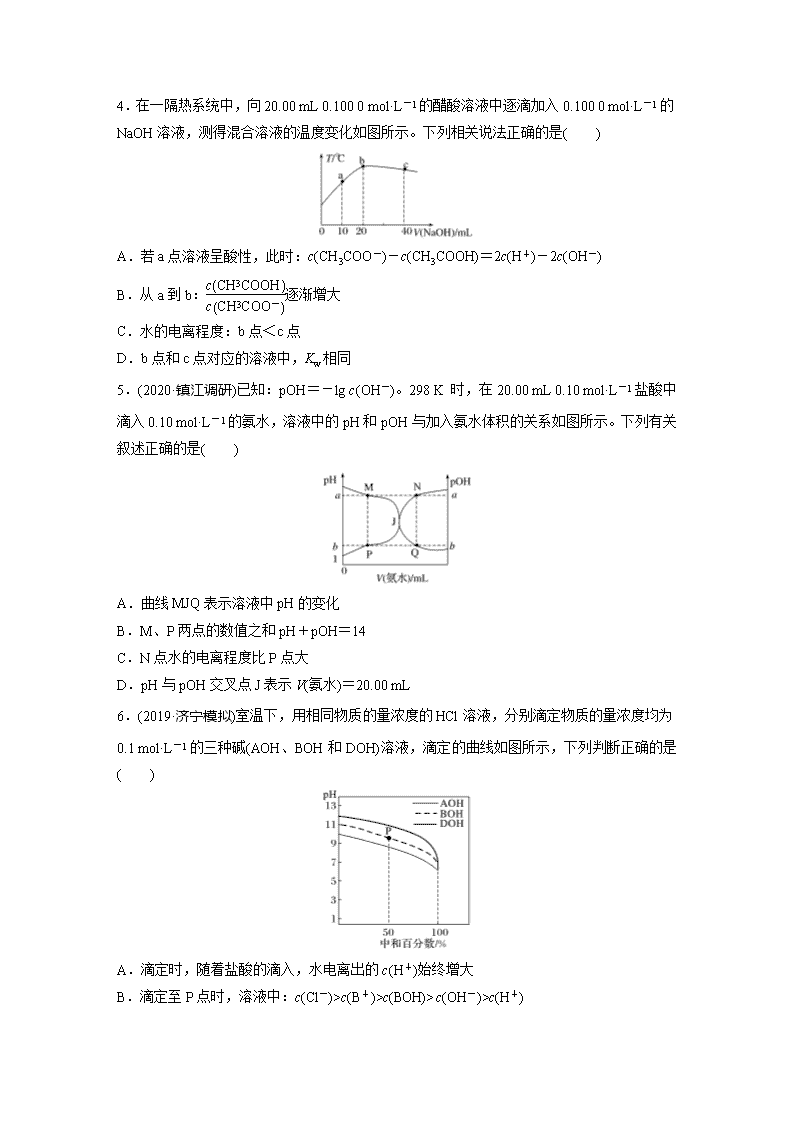
4.在一隔热系统中,向20.00 mL 0.100 0 mol·L-1的醋酸溶液中逐滴加入0.100 0 mol·L-1的
NaOH溶液,测得混合溶液的温度变化如图所示。下列相关说法正确的是( )
A.若a点溶液呈酸性,此时:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-)
B.从a到b:逐渐增大
C.水的电离程度:b点<c点
D.b点和c点对应的溶液中,Kw相同
5.(2020·镇江调研)已知:pOH=-lg c(OH-)。298 K 时,在20.00 mL 0.10 mol·L-1盐酸中滴入0.10 mol·L-1的氨水,溶液中的pH和pOH与加入氨水体积的关系如图所示。下列有关叙述正确的是( )
A.曲线MJQ表示溶液中pH的变化
B.M、P两点的数值之和pH+pOH=14
C.N点水的电离程度比P点大
D.pH与pOH交叉点J表示V(氨水)=20.00 mL
6.(2019·济宁模拟)室温下,用相同物质的量浓度的HCl溶液,分别滴定物质的量浓度均为0.1 mol·L-1的三种碱(AOH、BOH和DOH)溶液,滴定的曲线如图所示,下列判断正确的是( )
A.滴定时,随着盐酸的滴入,水电离出的c(H+)始终增大
B.滴定至P点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
C.pH=7时,三种溶液中c(Cl-)相等
D.当中和百分数达100%时,将三种溶液混合后,c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH
-)
7.(2019·金华联考)常温下,向100 mL 0.1 mol·L-1的H2A溶液中滴加0.1 mol·L-1 NaOH溶液,含A元素相关微粒的物质的量随pH的变化如图所示。下列说法正确的是( )
A.H2A在水中的电离方程式是H2A===H++HA-,HA-H++A2-
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C.Y点溶液中存在以下关系:
c(H+)+c(Na+)=c(OH-)+3c(HA-)
D.X点溶液中含A元素相关微粒:
c(H2A)+c(HA-)+c(A2-)=0.1 mol·L-1
8.(2020·安阳模拟)25 ℃时,向浓度均为0.1 mol·L-1、体积均为100 mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中lg 随n(NaOH)的变化如图所示。下列说法不正确的是( )
A.HX为强酸,HY为弱酸 B.b点时溶液呈中性
C.水的电离程度:d>c D.c点时溶液的pH=4
9.现用中和滴定测定某盐酸的浓度,有关数据记录如表:
滴定
序号
待测液体积/mL
所消耗烧碱标准液的体积/mL
滴定前
滴定后
消耗的体积
1
25.00
0.50
25.12
24.62
2
25.00
3
25.00
5.00
29.58
24.58
(1)实验中有石蕊和酚酞两种指示剂,该实验应选用____________作指示剂。用______________式滴定管盛装0.250 0 mol·L-1烧碱标准液,锥形瓶中装有25.00 mL待测盐酸。
(2)如图表示第二次滴定时50 mL滴定管中滴定前后液面的位置。该次滴定所用标准烧碱溶液体积为____ mL。
(3)根据所给数据,计算出该盐酸的物质的量浓度,c(HCl)=________(注意保留合适的有效数字)。
10.(2019·贵港质检)常温下,用0.100 0 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HCl溶液和20.00 mL 0.100 0 mol·L-1 CH3COOH溶液,得到2条滴定曲线如图所示:
(1)由A、C点判断,滴定HCl溶液的曲线是__________(填“图1”或“图2”)。
(2)a=________ mL。
(3)c(Na+)=c(CH3COO-)的点是________。
(4)E点对应离子浓度由大到小的顺序为___________________________________________
_____________________________________________________________________________。
答案精析
1.D
2.C [选项A,由K≈得,c(H+)≈ mol·L-1=4×10-4mol·L-1,错误;选项B,a点是醋酸溶液,b点是醋酸和少量CH3COOK的混合溶液,c点是CH3COOK和少量醋酸的混合溶液,d点是CH3COOK和KOH的混合溶液,酸、碱均能抑制水的电离,CH3COOK水解促进水的电离,所以c点溶液中水的电离程度最大,错误;选项C,由于酸碱恰好完全反应时溶液显碱性,故应该选择在碱性范围内变色的指示剂酚酞,正确;选项D,b点溶液中离子浓度也可能为c(CH3COO-)>c(K+)>c(H+)>c(OH-),错误。]
3.C 4.A
5.B [选项A,把碱溶液滴入酸溶液中,溶液的pH逐渐增大,故曲线PJN表示溶液pH的变化,而曲线MJQ表示溶液pOH的变化,错误;选项B,298 K时,水的离子积Kw=1.0×10-14,M、P两点为滴定过程中相同时刻的溶液,故pH+pOH=-lg c(H+)-lg c(OH-)=-lg[c(H+)·c(OH-)]=-lg Kw=14,正确;选项C,N点溶液的pH与M点溶液的pOH相等,故N、M两点水的电离程度相同,而M、P两点为滴定过程中相同时刻的溶液,故N、P两点水的电离程度相同,错误;选项D,J点pH=pOH=7,故氨水过量,即J点表示V(氨水)>20.00 mL,错误。]
6.D
7.C [A项,从图像分析,溶液中含有H2A分子,说明H2A为弱酸,则电离方程式为H2AH++HA-,HA-H++A2-,错误;B项,等体积等浓度的NaOH溶液与H2A溶液混合后,溶液中主要以NaHA的电离为主,溶液显酸性,溶液中的H+会抑制水的电离,溶液中水的电离程度比纯水中小,错误;C项,存在电荷守恒:c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),从图像分析,c(HA-)=c(A2-),从而得c(H+)+c(Na+)=c(OH-)+3c(HA-),正确;D项,100 mL 0.1 mol·L-1的H2A溶液中滴加0.1 mol·L-1 NaOH溶液,到X点时溶液的体积肯定比原来的大,所以根据物料守恒分析,有c(H2A)+c(HA-)+c(A2-)<0.1 mol·L-1,错误。]
8.C
9.(1)酚酞 碱
(2)24.60 (3)0.246 0 mol·L-1
解析 (1)石蕊变色范围较大,而且颜色变化不易观察,不能作酸碱指示剂,因此该实验应选用酚酚作指示剂;NaOH溶液是碱性溶液,应盛放在碱式滴定管中。(2)滴定前读数为0.30 mL,滴定后读数为24.90 mL,消耗烧碱溶液的体积为24.60 mL。(3)消耗烧碱溶液的平均体积为V(NaOH)= mL=24.60 mL,则c(HCl)==
=0.246 0 mol·L-1。
10.(1)图1 (2)20.00 (3)D
(4)c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
解析 (1)盐酸是强酸,完全电离,醋酸是弱酸,部分电离,A点pH=1,说明溶液中氢离子浓度是0.1 mol·L-1,所以是HCl溶液,因此滴定HCl溶液的曲线是图1。(2)图1中a点pH=7,二者恰好反应,所以a=20.00 mL。(3)根据电荷守恒可知c(Na+)=c(CH3COO-)时溶液显中性,则对应的点是D。(4)E点醋酸与氢氧化钠恰好完全反应,生成的醋酸钠水解,溶液显碱性,则对应离子浓度由大到小的顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。