- 582.67 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1.(2017·北京,10)根据二氧化硫通入不同溶液中的实验现象,所得结论不正确的是( )
选项
溶液
现象
结论
A
含HCl、BaCl2的FeCl3溶液
产生白色沉淀
SO2有还原性
B
H2S溶液
产生黄色沉淀
SO2有氧化性
C
酸性KMnO4溶液
紫红色溶液褪色
SO2有漂白性
D
Na2SiO3溶液
产生胶状沉淀
酸性:
H2SO3>H2SiO3
2.当我们查看葡萄酒标签上的成分信息时,常发现其成分中含有少量SO2。下列关于SO2的说法正确的是( )
A.SO2属于非法添加剂,不该添加到葡萄酒中
B.SO2具有还原性,少量的SO2可防止葡萄酒氧化变质
C.SO2具有还原性,不能用浓硫酸干燥
D.SO2可以使酸性KMnO4溶液褪色,体现了它的漂白性
3.(2020·天津模拟)下列有关硫元素及其化合物的说法或描述正确的是( )
A.硫黄矿制备硫酸经历两步:SSO3H2SO4
B.酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中
C.在燃煤中加入石灰石可减少SO2的排放,发生的反应为2CaCO3+2SO2+O2===2CO2+2CaSO4
D.土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性
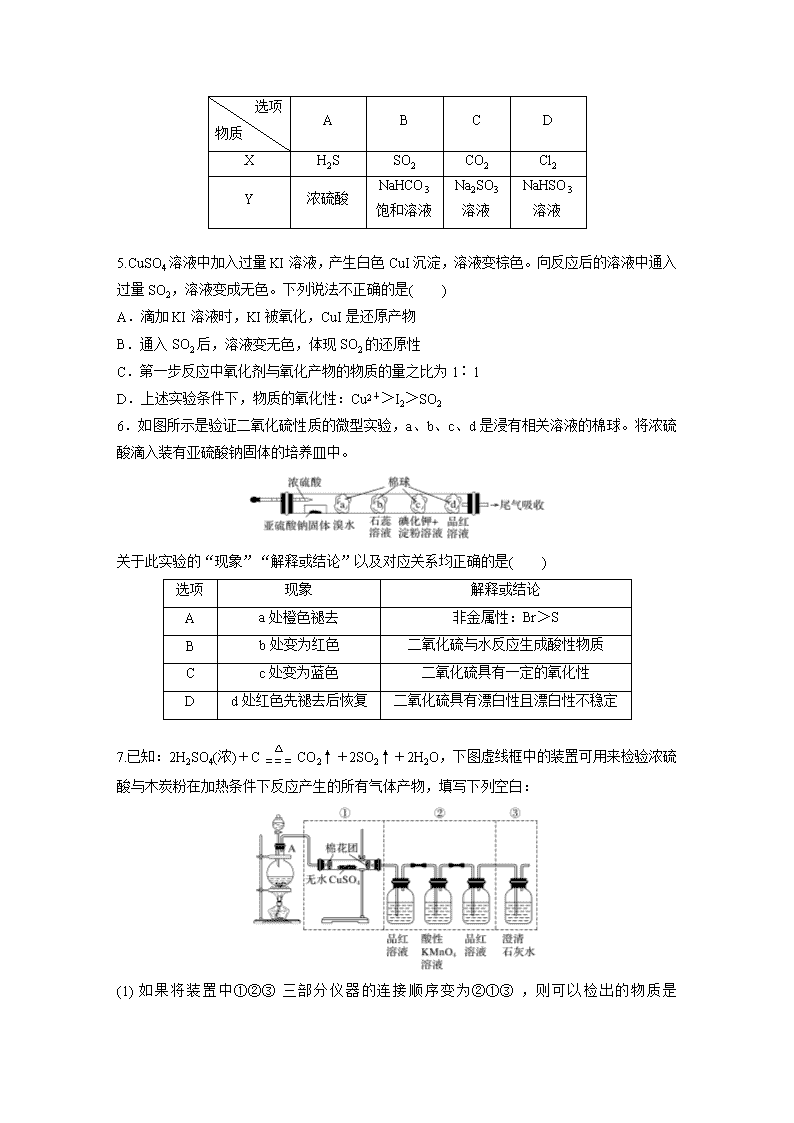
4.(2019·宜昌模拟)如图是检验气体性质的实验装置。向装置中缓慢通入气体X,若关闭止水夹K,品红溶液无变化、澄清石灰水变浑浊;若打开止水夹K,品红溶液褪色。据此判断,气体X和液体Y可能是( )
选项
物质
A
B
C
D
X
H2S
SO2
CO2
Cl2
Y
浓硫酸
NaHCO3
饱和溶液
Na2SO3
溶液
NaHSO3
溶液
5.CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变棕色。向反应后的溶液中通入过量SO2,溶液变成无色。下列说法不正确的是( )
A.滴加KI溶液时,KI被氧化,CuI是还原产物
B.通入SO2后,溶液变无色,体现SO2的还原性
C.第一步反应中氧化剂与氧化产物的物质的量之比为1∶1
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
6.如图所示是验证二氧化硫性质的微型实验,a、b、c、d是浸有相关溶液的棉球。将浓硫酸滴入装有亚硫酸钠固体的培养皿中。
关于此实验的“现象”“解释或结论”以及对应关系均正确的是( )
选项
现象
解释或结论
A
a处橙色褪去
非金属性:Br>S
B
b处变为红色
二氧化硫与水反应生成酸性物质
C
c处变为蓝色
二氧化硫具有一定的氧化性
D
d处红色先褪去后恢复
二氧化硫具有漂白性且漂白性不稳定
7.已知:2H2SO4(浓)+CCO2↑+2SO2↑+2H2O,下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:
(1)如果将装置中①②③三部分仪器的连接顺序变为②①③,则可以检出的物质是
________________;不能检出的物质是________________。
(2)如果将仪器的连接顺序变为①③②,则可以检出的物质是________________;不能检出的物质是__________。
(3)如果将仪器的连接顺序变为②③①,则可以检出的物质是________________;不能检出的物质是__________。
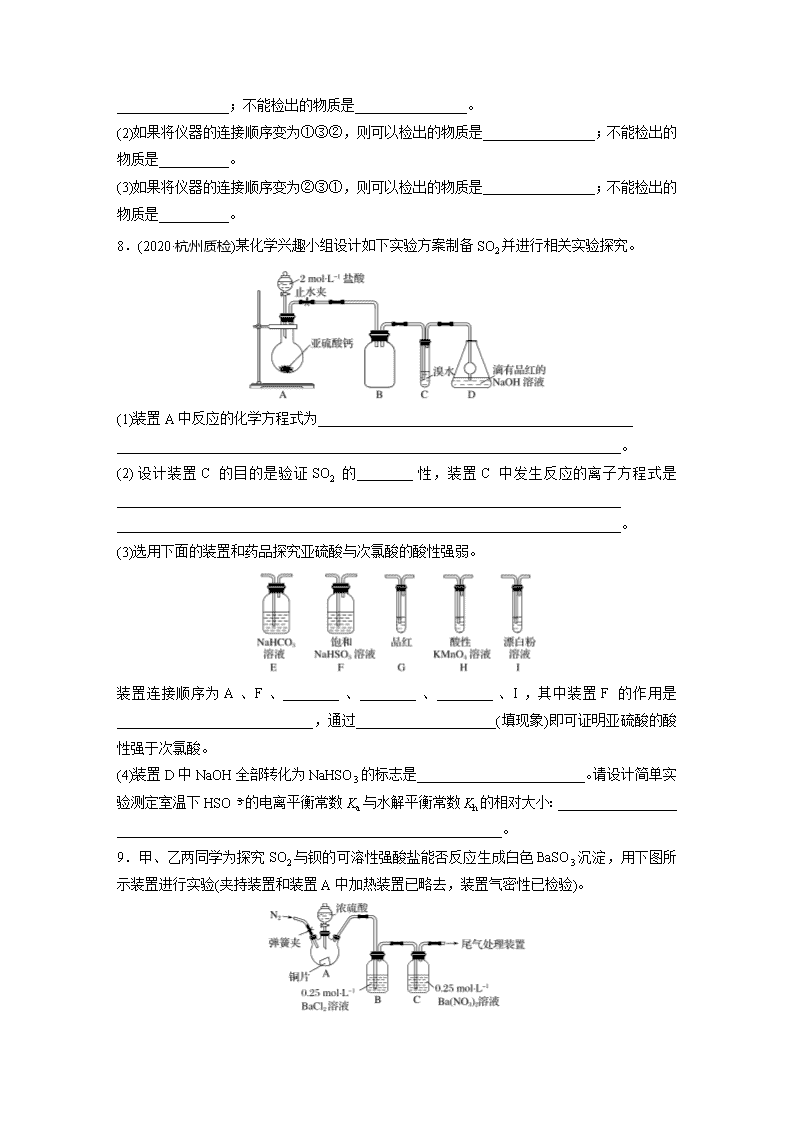
8.(2020·杭州质检)某化学兴趣小组设计如下实验方案制备SO2并进行相关实验探究。
(1)装置A中反应的化学方程式为_____________________________________________
________________________________________________________________________。
(2)设计装置C的目的是验证SO2的________性,装置C中发生反应的离子方程式是________________________________________________________________________
________________________________________________________________________。
(3)选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱。
装置连接顺序为A、F、________、________、________、I,其中装置F的作用是____________________________,通过____________________(填现象)即可证明亚硫酸的酸性强于次氯酸。
(4)装置D中NaOH全部转化为NaHSO3的标志是________________________。请设计简单实验测定室温下HSO的电离平衡常数Ka与水解平衡常数Kh的相对大小:_________________
_______________________________________________________。
9.甲、乙两同学为探究SO2与钡的可溶性强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和装置A中加热装置已略去,装置气密性已检验)。
实验操作和现象如下表所示:
操作
现象
关闭弹簧夹,滴加一定量浓硫酸,加热
装置A中有白雾生成,铜片表面产生气泡
装置B中有气泡冒出,产生大量白色沉淀
装置C中产生白色沉淀,液面上方略显红棕色并逐渐消失
打开弹簧夹,通入N2,停止加热,一段时间后关闭弹簧夹
从装置B、C中分别取少量白色沉淀,加入稀盐酸
均未发现白色沉淀溶解
(1)装置A中反应的化学方程式是_____________________________________________
________________________________________________________________________。
(2)装置C中白色沉淀是______________,该沉淀的生成表明SO2具有________性。
(3)装置C中液面上方生成红棕色气体的化学方程式是
________________________________________________________________________。
(4)分析装置B中产生不溶于稀盐酸的沉淀的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是________________________________________________________________________;
乙在装置A、B间增加洗气瓶D,D中盛放的试剂是________________。
②进行实验,装置B中出现的现象不同,
甲:大量白色沉淀;
乙:少量白色沉淀。
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:________________________________________________________________________
________________________________________________________________________。
(5)合并(4)中两同学的方案进行实验。装置B中无沉淀生成,而装置C中产生白色沉淀,由此得出的结论是
________________________________________________________________________
________________________________________________________________________。
答案精析
1.C [本题考查SO2的氧化性、还原性等知识。SO2使酸性KMnO4溶液褪色是因为SO2具有还原性,与KMnO4发生了氧化还原反应。]
2.B 3.C
4.B [H2S不能使品红溶液褪色,A项错误;SO2可与NaHCO3饱和溶液反应生成二氧化碳,若关闭止水夹K,则品红溶液无变化,生成的二氧化碳气体使澄清石灰水变浑浊;若打开止水夹K,则品红溶液褪色,B项正确;二氧化碳不能使品红溶液褪色,所以打开止水夹K,品红溶液不会褪色,C项错误。]
5.C [根据题意知,CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变棕色,发生的反应为2CuSO4+4KI===2K2SO4+2CuI↓+I2,反应中氧化剂与氧化产物的物质的量之比为2∶1,选项C错误;向反应后的溶液中不断通入SO2气体,发生的反应为SO2+2H2O+I2===H2SO4+2HI。滴加KI溶液时,部分碘元素的化合价升高,I2为氧化产物,铜元素的化合价降低,CuI为还原产物,选项A正确;通入SO2后溶液变无色,硫元素的化合价升高,体现SO2的还原性,选项B正确;根据上述反应结合氧化还原反应中物质的氧化性强弱规律判断,氧化性:Cu2+>I2>SO2,选项D正确。]
6.B
7.(1)SO2、CO2 H2O (2)H2O、SO2 CO2 (3)SO2、CO2 H2O
解析 装置①为检验产物H2O,只能放在装置②③之前,因为若放在装置②③之后或装置②③之间,则气流通过装置②或③溶液后会带出水蒸气,则无法验证使无水CuSO4变蓝的水蒸气是否是反应生成物。装置③和装置②位置也不得变更,因为SO2、CO2均能使澄清石灰水变浑浊。故在用澄清石灰水来验证CO2前一定要排除SO2的干扰。
8.(1)CaSO3+2HCl===CaCl2+SO2↑+H2O
(2)还原 Br2+SO2+2H2O===4H++2Br-+SO
(3)E H G 除去HCl气体 G中品红不褪色,I中出现白色沉淀
(4)溶液由红色变为无色 常温下,用pH试纸(或pH计)测定NaHSO3溶液的pH,若pH<7,则Ka>Kh;若pH>7,则Ka