- 116.42 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
【学习目标】
1.理解电解原理,初步掌握一般电解反应产物的判断方法
2.掌握电解质溶液中离子的放电顺序及电解质溶液的电解规律(惰性电极)
3.掌握电解电极方程式的书写。
【教学重点】
电解原理
【教学难点】
电解原理
【自主学习】
1.电解的定义:使____________通过电解质溶液而在阴、阳两极引起_____________________的过程。
2.电解池或电解槽的定义:________________转变为_____________的装置。阴极:在电解池中与直流电源的___________________相连的电极,发生______________反应;阳极:与直流电源的_____________相连的电极,发生______________反应;电子的流向:电源的______________→电解池的_____________,电解池的________________→电源的______________;离子:阳离子向电解池的________________移动,阴离子移向电解池的__________________。
3.
装置类别
原电池
电解池
原理(能量转化)
离子迁移方向
发生氧化反应的电极
发生还原反应的电极
相同点(从原理分析)
合作探究
【问题1】完成课本实验4-2,判断实验电解前,溶液中含有离子有哪些?现象是什么?
【问题2】根据实验4-2的现象,为什么得到的是Cu和氯气,而不是氢气等?
【问题3】写出H2SO4、盐酸、NaCl、CuSO4,惰性材料作电极时的电极反应式,得出什么结论。
【问题4】区分电离和电解,
电离
电解
条件
过程
举例
特点
联系
【自主练习】判断正误
(1)电解是将电能转化为化学能
(2)电解质溶液导电是化学变化,金属导电是物理变化
(3)电解时,电子会通过电解质溶液
(4)电解质溶液导电过程是电解的过程,电离也必须通电才能实现
1.下列说法正确的是
①电解是把电能转变成化学能 ②电解是化学能转变成电能 ③电解质溶液导电是化
学变化,金属导电是物理变化 ④不能自发进行的氧化还原反应,通过电解的原理可以实现 ⑤任何溶液被电解时,必然导致氧化还原反应的发生
A.①②③④ B.②③⑤ C.③④ D.①③④⑤
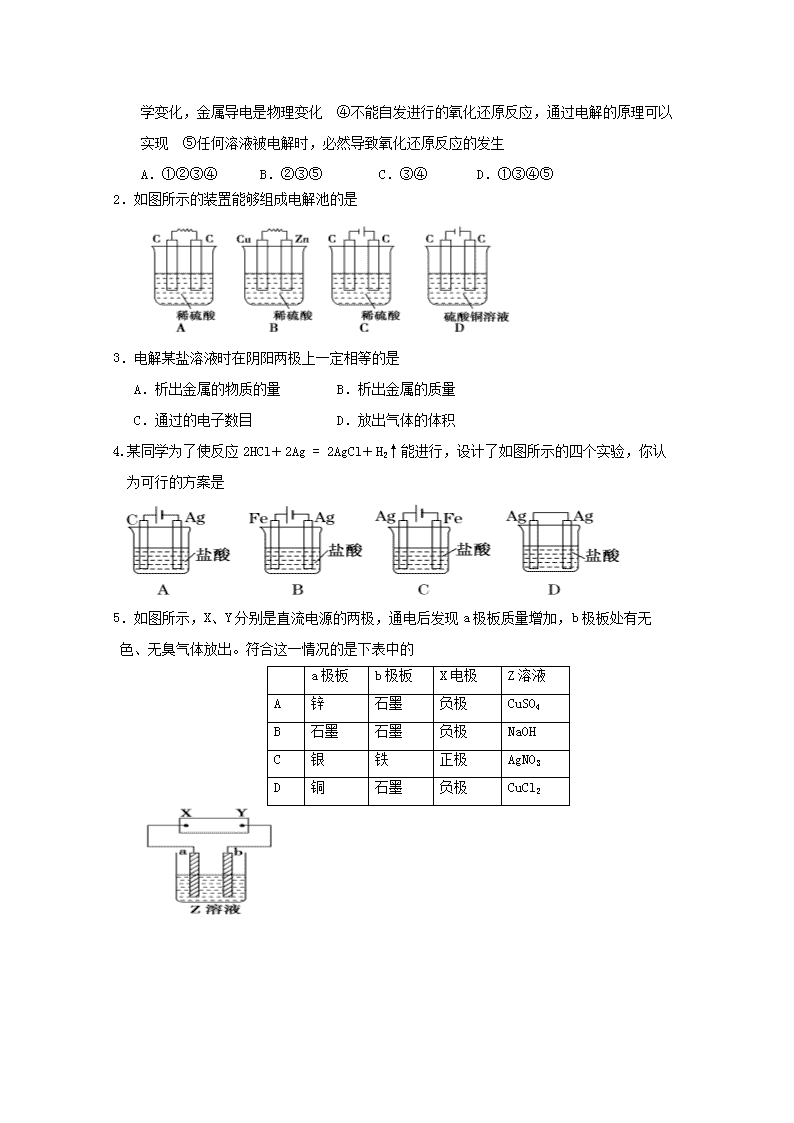
2.如图所示的装置能够组成电解池的是
3.电解某盐溶液时在阴阳两极上一定相等的是
A.析出金属的物质的量 B.析出金属的质量
C.通过的电子数目 D.放出气体的体积
4.某同学为了使反应2HCl+2Ag = 2AgCl+H2↑能进行,设计了如图所示的四个实验,你认为可行的方案是
5.如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无臭气体放出。符合这一情况的是下表中的
a极板
b极板
X电极
Z溶液
A
锌
石墨
负极
CuSO4
B
石墨
石墨
负极
NaOH
C
银
铁
正极
AgNO3
D
铜
石墨
负极
CuCl2
自主学习
1.电流 氧化还原反应。2.电能 化学能 负极 还原 正极 氧化 负极 阴极 阳极 正极 阴极 阳极。
3.
装置类别
原电池
电解池
原理(能量转化)
化学能转化成电能
电能转化成化学能
离子迁移方向
阴离子向负极移动
阳离子向正极移动
阴离子向阳极移动
阳离子向阴极移动
发生氧化反应的电极
负极
阳极
发生还原反应的电极
正极
阴极
相同点(从原理分析)
都是氧化还原反应
合作探究
【问题1】电解前溶液中含有的离子,CuCl2电离产生的Cu2+和Cl-,还有H2O微弱电离产生的H+和OH-,现象是:阴极石墨上有一层红色物质析出,经检验此红色物质为Cu,阳极上产生黄绿色气体,此气体能使湿润的KI-淀粉试纸变蓝,说明此气体为氯气。
【问题2】涉及到离子放电顺序,惰性材料作电极:阳离子:Ag+>Hg2+>Cu2+>Fe2+>Zn2+>H+>Al3+
>Na+>K+ 阴离子:S2->I->Br->Cl->OH->含氧酸根;惰性材料一般指金属Pt和石墨,剩余金属一般是活动性金属,如果是活动性金属作电极,阳离子:Ag+>Hg2+>Cu2+>Fe2+>Zn2+>H+>Al3+>Na+>K+ 阴离子:活动性金属>S2->I->Br->Cl->OH-
>含氧酸根,注意一般情况下,是按照此顺序进行分析,但有时需要结合题目中所给信息完成,也就是灵活运用。
【问题3】(1) 电解质分解型:无氧酸(HCl)、不活泼金属的无氧酸盐溶液(CuCl2)的电解,水不参加反应
(2) 电解水型:强碱、活泼金属的含氧酸(如KNO3)、含氧酸等溶液的电解,只有水参加
(3) 放氢生碱型:电解活泼金属的无氧酸盐(如NaCl)时,电解质的阴离子和水电离的H+放电,溶质和水都参加反应,pH增大
(4) 放氧生酸型:电解不活泼金属的含氧酸盐(如CuSO4)时,电解质电离的阳离子和水电离的OH―离子放电,溶质和水都参加反应,pH减小。
【问题4】
电离
电解
条件
电解质溶于水或熔化状态
电解质电离后,再通直流电
过程
电解质电离成为自由移动的离子
阴、阳离子定向移动,
在两极上放电
举例
CuCl2 ==Cu2++2Cl―
CuCl2Cu+Cl2↑
特点
只产生自由移动的离子
发生氧化还原反应,形成新物质
联系
电解必须建立在电离的基础上
【自主练习】 √√××
【随堂检测】1.D 2.C D 3.C 4. C 5. A