- 409.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第三节 物质的制备
一、气体的发生装置和收集装置
1.重要气体的发生装置
依据制备气体所需的反应物状态和反应条件,可将制备气体的发生装置分为三类:
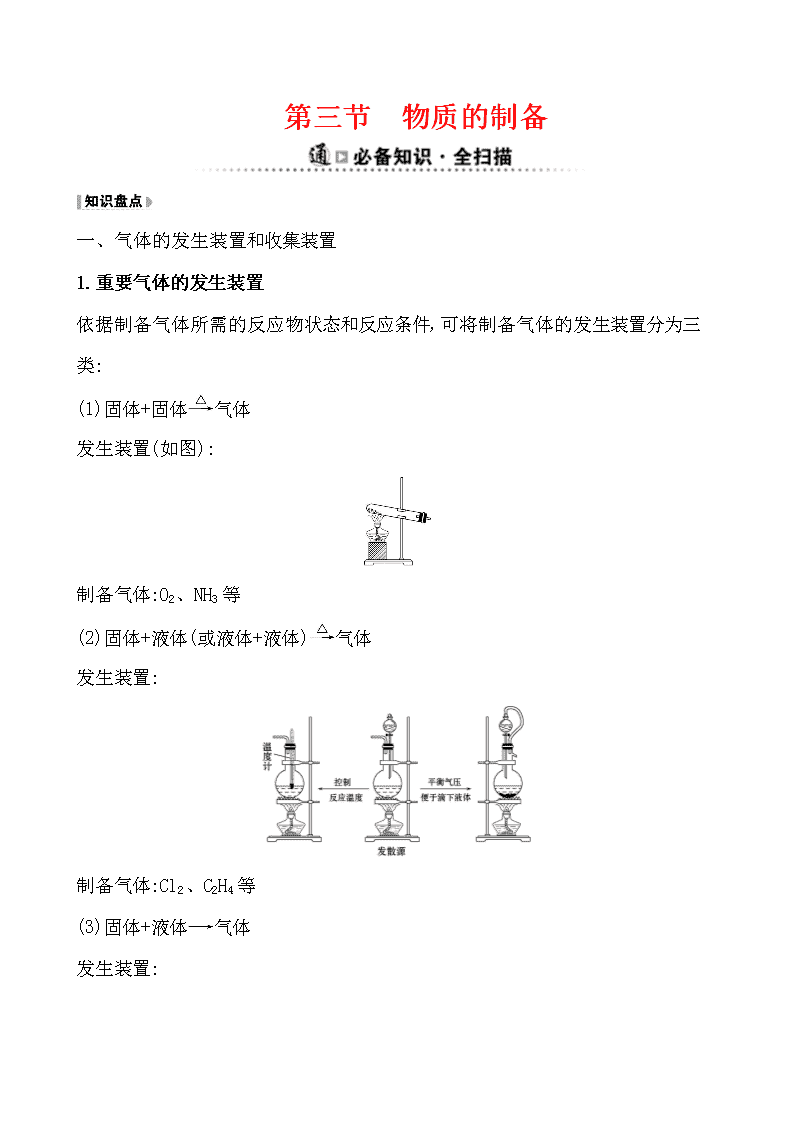
(1)固体+固体气体
发生装置(如图):
制备气体:O2、NH3等
(2)固体+液体(或液体+液体)气体
发生装置:
制备气体:Cl2、C2H4等
(3)固体+液体气体
发生装置:
2.气体的除杂方法
(1)除杂试剂选择的依据:主体气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性。
除杂原则:①不损失主体气体;②不引入新的杂质气体;③在密闭装置内进行;④先除易除的杂质气体。
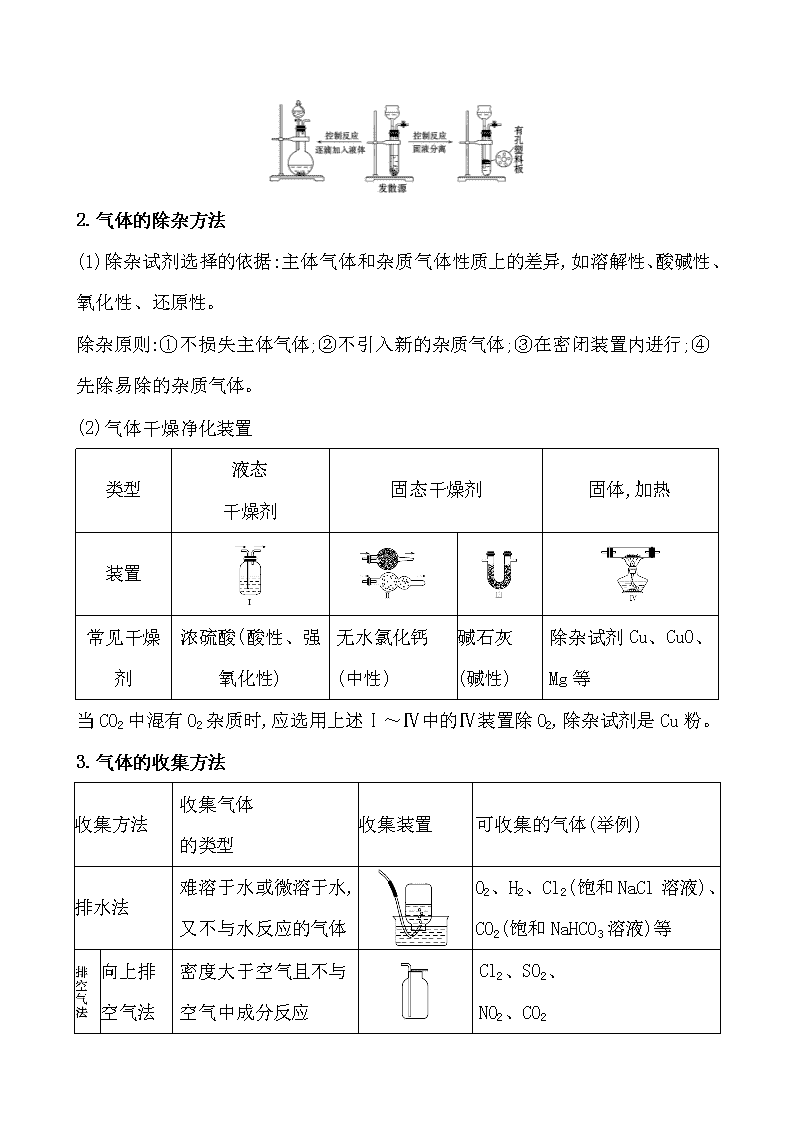
(2)气体干燥净化装置
类型
液态
干燥剂
固态干燥剂
固体,加热
装置
常见干燥
剂
浓硫酸(酸性、强氧化性)
无水氯化钙(中性)
碱石灰
(碱性)
除杂试剂Cu、CuO、
Mg等
当CO2中混有O2杂质时,应选用上述Ⅰ~Ⅳ中的Ⅳ装置除O2,除杂试剂是Cu粉。
3.气体的收集方法
收集方法
收集气体
的类型
收集装置
可收集的气体(举例)
排水法
难溶于水或微溶于水,又不与水反应的气体
O2、H2、Cl2(饱和NaCl溶液)、CO2(饱和NaHCO3溶液)等
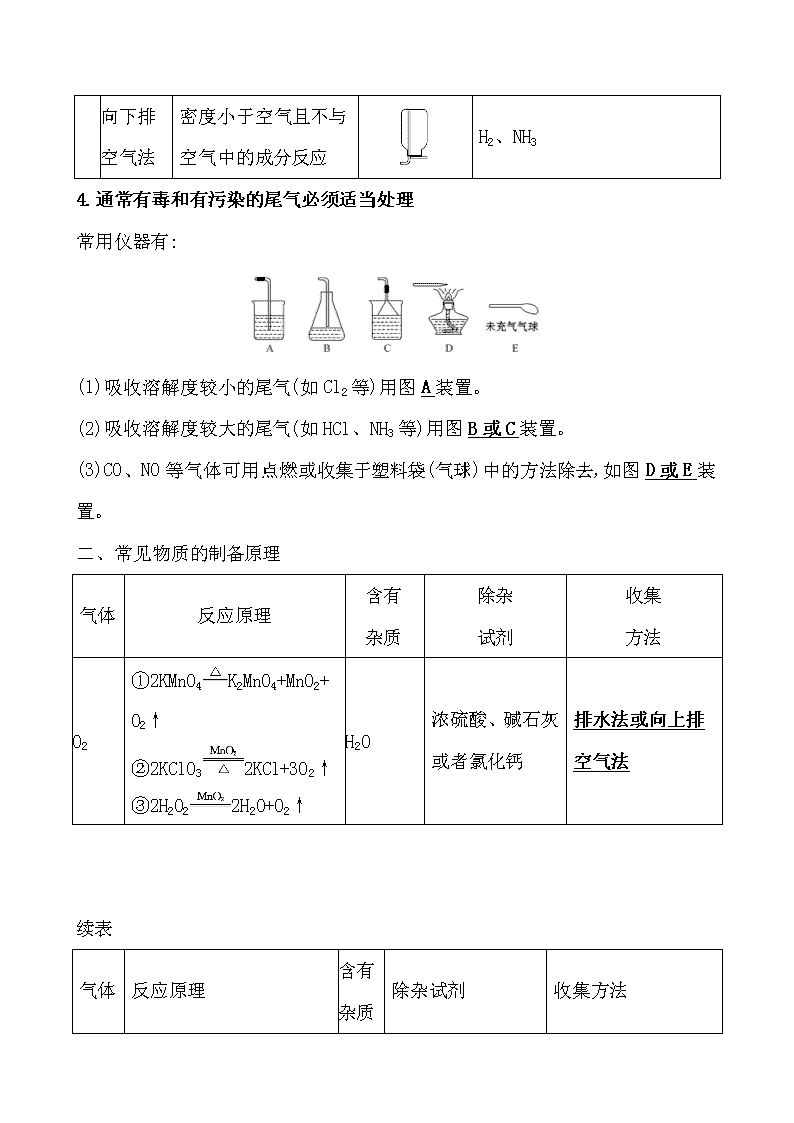
向上排
空气法
密度大于空气且不与空气中成分反应
Cl2、SO2、
NO2、CO2
向下排
空气法
密度小于空气且不与空气中的成分反应
H2、NH3
4.通常有毒和有污染的尾气必须适当处理
常用仪器有:
(1)吸收溶解度较小的尾气(如Cl2等)用图A装置。
(2)吸收溶解度较大的尾气(如HCl、NH3等)用图B或C装置。
(3)CO、NO等气体可用点燃或收集于塑料袋(气球)中的方法除去,如图D或E装置。
二、常见物质的制备原理
气体
反应原理
含有
杂质
除杂
试剂
收集
方法
O2
①2KMnO4K2MnO4+MnO2+
O2↑
②2KClO32KCl+3O2↑
③2H2O22H2O+O2↑
H2O
浓硫酸、碱石灰或者氯化钙
排水法或向上排空气法
续表
气体
反应原理
含有
杂质
除杂试剂
收集方法
H2
Zn+H2SO4ZnSO4+H2↑
H2O
浓硫酸、碱石灰或者氯化钙
排水法或向下排空气法
CO2
CaCO3+2HClCaCl2+
CO2↑+H2O
HCl、
H2O
饱和碳酸氢钠溶液和浓硫酸
向上排空气法
Cl2
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
HCl、
H2O
饱和食盐水和浓硫酸
排饱和食盐水法或向上排空气法
NH3
Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O
H2O
碱石灰
向下排空气法
三、几种非气体物质的制备
1.铜盐的制备
(1)用铜制取硫酸铜:2Cu+O22CuO、
CuO+H2SO4CuSO4+H2O
(2)用铜制取硝酸铜:2Cu+O22CuO、
CuO+2HNO3Cu(NO3)2+H2O
2.从废旧线路板中回收铜
发生反应的化学方程式为a:Cu+2FeCl3CuCl2+2FeCl2
d:2FeCl2+H2O2+2HCl2FeCl3+2H2O
3.氢氧化亚铁
(1)原理
离子方程式:Fe2++2OH-Fe(OH)2↓。
(2)注意事项
①Fe(OH)2有强还原性,易被氧化而迅速变色,因此用于配制硫酸亚铁溶液和氢氧化钠溶液的蒸馏水要煮沸,以便除去水中氧气。
②将吸有氢氧化钠溶液的胶头滴管伸入硫酸亚铁溶液液面下,再将氢氧化钠溶液挤出。
③还可在硫酸亚铁溶液上加一层植物油,尽量减少与空气(或氧气)的接触。
4.氢氧化铁胶体的制备
(1)原理
化学方程式:FeCl3+3H2OFe(OH)3(胶体)+3HCl。
(2)操作步骤:加热蒸馏水至沸腾,逐滴滴加饱和氯化铁溶液,加热至液体呈红褐色停止加热,不可搅拌。
1.(RJ必修1·P63改编题)制备FeSO4最适宜的方法是 ( )
A.过量的铁与稀硫酸反应
B.FeO与稀硫酸反应
C.FeCO3与稀硫酸反应
D.Fe(OH)2与稀硫酸反应
【解析】选A。制备FeSO4要加Fe防止Fe2+被氧化。
2.(RJ必修1·P87改编题)设计四种制备气体的方案:①加热NH4Cl制备氨气;②加热稀盐酸和MnO2制备氯气;③用稀硫酸和大理石制备二氧化碳;④用浓硫酸和锌粒制备氢气,不宜采用的方案有 ( )
A.只有①和② B.只有②和③
C.只有③和④ D.①②③④
【解析】选D。①中NH4ClNH3↑+HCl↑,冷却时,NH3+HClNH4Cl;②中应使用浓盐酸;③中应使用盐酸;④中应使用稀硫酸或盐酸。
3.化学实验装置的正确连接是实验成功的关键,如图是中学化学中常见的实验装置。
(1)用上述装置制备气体:
①若B中盛放浓硫酸,则A、B、C组合后能制取并收集的气体是________。
a.H2 b.H2S c.CO2 d.C2H2
②要快速制取并得到干燥的NH3,正确的仪器组合是________(按制气装置顺序填仪器的编号字母),制气所选用的固体药品是________。
③若用H2O2和MnO2来制取和收集干燥的O2,则应选择的仪器正确组合是________ (按制气装置顺序填仪器的编号字母),检验气体收集满的方法是___________ ___________________________。
(2)甲同学用A、B组合来验证稀硫酸、碳酸、次氯酸的酸性强弱,稀硫酸应装入________(填仪器名称)中,B装置中发生反应的离子方程式为_____________ ___________________。
【解析】(1)①B中的浓硫酸可以和硫化氢反应,C装置只能收集密度比空气大的气体,氢气、乙炔不符合,所以只能选c。②利用固体氢氧化钠(或生石灰)和浓氨水反应可以快速制取氨气,氨气密度比空气小,所以采用向下排空气法收集。③氧气的密度比空气大,所以采用向上排空气法收集,正确的仪器组合为ABC,检验O2收集满的方法是将带火星的木条靠近集气瓶口,若木条复燃,则说明氧气收集满了。
(2)在利用A、B组合验证稀硫酸、碳酸、次氯酸的酸性强弱时,可以采用强酸制弱酸的方法,A中利用稀硫酸和碳酸钠反应制取二氧化碳,将二氧化碳通入B中的次氯酸钙溶液中,可反应生成次氯酸和CaCO3沉淀。
答案:(1)①c ②AFE 固体氢氧化钠(合理即可) ③ABC(合理即可) 将带火星的木条靠近集气瓶口,若木条复燃,则说明氧气收集满了 (2)分液漏斗 Ca2++2ClO-+CO2+H2OCaCO3↓+2HClO
关闭Word文档返回原板块
相关文档
- 2020届高考化学一轮复习化学能与热2021-07-065页
- 2021届高考化学一轮复习化学反应与2021-07-066页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-066页
- 2021届高考化学一轮复习化学平衡常2021-07-0623页
- 2021届高考化学一轮复习化学实验方2021-07-0613页
- 2020届高考化学一轮复习化学反应的2021-07-066页
- 2020届高考化学一轮复习化学反应速2021-07-0610页
- 2020届高考化学一轮复习化学反应与2021-07-0612页
- 2021届高考化学一轮复习化学键学案2021-07-067页
- 2021届高考化学一轮复习化学反应速2021-07-065页