- 513.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
学案六 化学速率平衡图表分析与数据处理
【学习目标】
1.理解化学平衡图像的意义,掌握化学平衡图像题的解法。
2.借助速率和平衡的图像,了解平衡在生活、生产和科学研究领域中的重要作用。
3.通过对“化学反应速率和化学平衡”的图表以及“化学反应的过程图像”的分析,提高学生对图表信息进行综合处理和加工的能力。
4.通过同学之间对图像题的解题方法的讨论分析,体会同伴间互助学习的必要性。
【学习重点】 阅读表格数据、图像,对化学平衡的综合分析,解决实际问题。
【学习难点】 平衡图像解题思路、方法与技巧。
【考情分析】 从近几年看,化学反应速率和化学平衡的考查,试题的创新性、探究性逐年提升,如:考查问题多样化的平衡图像问题,通过设计新颖的速率、平衡计算以及通过图像、表格获取信息、数据等试题在情境上、取材上都有所创新,而且化学反应速率与化学平衡还与元素化合物知识相互联系,综合考查,并且两者的结合也日趋紧密。如2015·全国卷Ⅰ·28,2016·全国卷Ⅱ·27,2017·全国卷Ⅰ·28等。
1.常见速率、平衡图像
(1)物质的量(或浓度)-时间图像
例如,某温度时,在定容(V L)容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
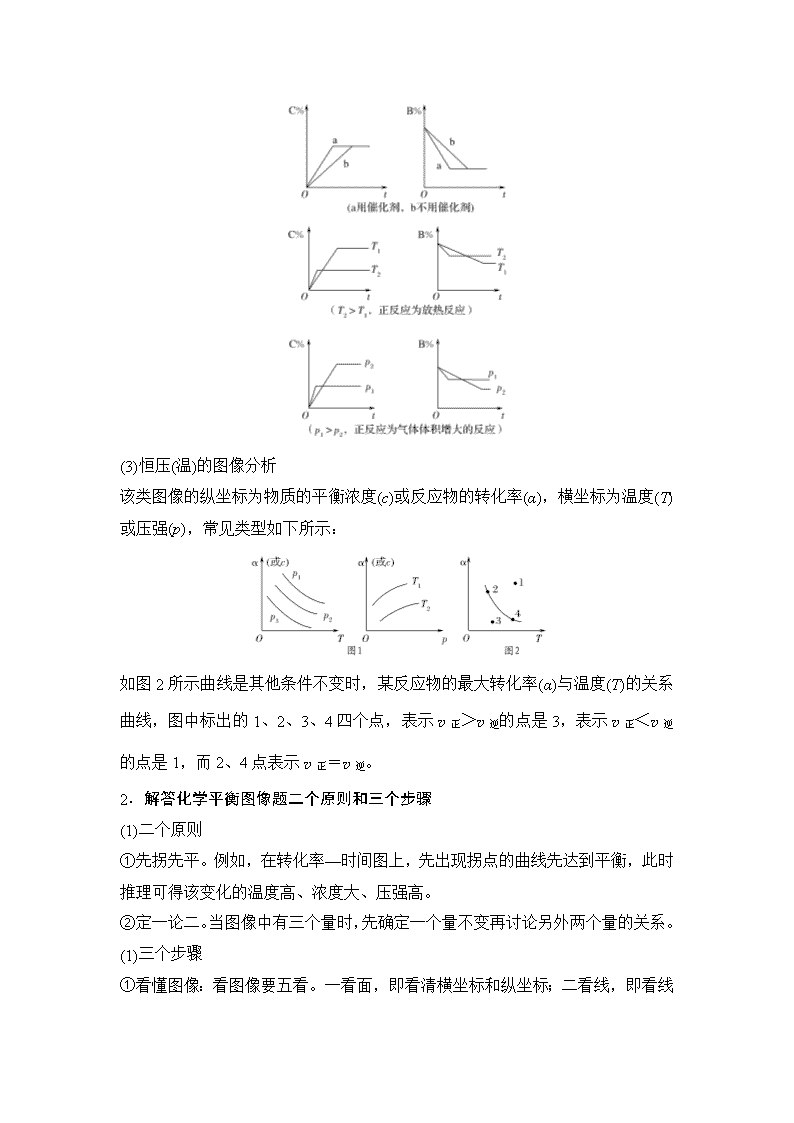
(2)含量—时间—温度(压强)
常见形式有如下几种。(C%指生成物的质量分数;B%指某反应物的质量分数)
(3)恒压(温)的图像分析
该类图像的纵坐标为物质的平衡浓度(c)或反应物的转化率(α),横坐标为温度(T)或压强(p),常见类型如下所示:
如图2所示曲线是其他条件不变时,某反应物的最大转化率(α)与温度(T)的关系曲线,图中标出的1、2、3、4四个点,表示v正>v逆的点是3,表示v正<v逆的点是1,而2、4点表示v正=v逆。
2.解答化学平衡图像题二个原则和三个步骤
(1)二个原则
①先拐先平。例如,在转化率—时间图上,先出现拐点的曲线先达到平衡,此时推理可得该变化的温度高、浓度大、压强高。
②定一论二。当图像中有三个量时,先确定一个量不变再讨论另外两个量的关系。
(1)三个步骤
①
看懂图像:看图像要五看。一看面,即看清横坐标和纵坐标;二看线,即看线的走向、变化趋势;三看点,即看曲线的起点、终点、交点、拐点、原点、极值点等;四看要不要作辅助线、如等温线、等压线;五看定量图像中有关量的多少。②联想规律:联想外界条件对化学反应速率和化学平衡的影响规律。③推理判断:结合题中给定的化学反应和图像中的相关信息,根据有关知识规律分析作出判断。
考点指导1 化学平衡中的表格数据处理
【典例1】 某温度下进行反应:COCl2(g)Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
t/s
0
2
4
6
8
n(Cl2)/mol
0
0.30
0.39
0.40
0.40
(1)0~2 s内,v(Cl2)=________。
(2)保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol·L-1,则反应的ΔH________(填“>”、“<”或“=”)0。
(3)该温度下,此反应的平衡常数K=________;若在2 L恒容绝热(与外界没有热量交换)密闭容器中进行该反应,则该反应K将________(填“增大”、“减小”或“不变”)。
(4)保持其他条件不变,起始时向容器中充入1.2 mol COCl2、0.60 mol Cl2和0.60 mol CO,反应达到平衡前的速率:v(正)________(填“>”、“<”或“=”)v(逆)。
(5)若起始时向该容器中充入2.0 mol COCl2(g),经过一段时间后达到平衡,n(Cl2)________(填“>”、“<”或“=”)0.8 mol。
(6)保持其他条件不变,起始向容器中充入1.0 mol Cl2和1.2 mol CO,达到平衡时,Cl2的转化率________(填“>”、“<”或“=”)60%。
(7)若该反应是在恒温恒压下进行,则达到平衡时反应物的转化率将________(填“>”、“<”或“=”)40%。
解析 (1)v(Cl2)==0.075 mol·L-1·s-1。
(2)对于题中原平衡,c(Cl2)==0.2 mol·L-1,温度升高,c(Cl2)=0.22 mol·L
-1,说明平衡正向移动,正反应吸热。
K==0.133 (mol·L-1)。
因为正反应是吸热反应,随着反应的进行,温度降低,平衡逆向移动,K减小。
(4)Q==0.15>K,反应逆向进行。
(5)若起始充入2.0 mol COCl2(g),体积扩大2倍,则达到平衡时n(Cl2)=0.8 mol,压回原体积,即增大压强,平衡逆向移动,n(Cl2)减小。(6)若充入1.0 mol Cl2和1.0 mol CO,则与原平衡等效,达到平衡时,Cl2的转化率等于60%,现在是充了1.0 mol Cl2和1.2 mol CO,多充入CO,则Cl2的转化率增大。(7)恒温恒容的容器中,随着反应的进行,压强增大,平衡逆向移动,转化率减小。所以恒温恒压的容器中转化率大些。
答案 (1)0.075 mol·L-1·s-1 (2)> (3)0.133 mol·L-1 减小 (4)< (5)< (6)> (7)>
【课堂对点训练】
1.某同学学习了化学反应速率后,联想到曾用H2O2制备氧气,于是设计了下面的实验方案并进行实验探究。
实验编号
反应物
催化剂
甲
试管中加入3 mL 2% H2O2溶液和3滴蒸馏水
无
乙
试管中加入3 mL 5% H2O2溶液和3滴蒸馏水
无
丙
试管中加入3 mL 5% H2O2溶液和3滴蒸馏水
1 mL 0.1 mol·L-1 FeCl3溶液
丁
试管中加入3 mL 5% H2O2溶液和3滴稀盐酸溶液
1 mL 0.1 mol·L-1 FeCl3溶液
戊
试管中加入3 mL 5% H2O2溶液和3滴NaOH溶液
1 mL 0.1 mol·L-1 FeCl3溶液
(1)上述实验发生反应的化学方程式为_______________________________
_______________________________________________________________。
(2)实验甲和实验乙的实验目的是______________________________________;
实验丙、实验丁和实验戊的实验目的是______________________________。
(3)分析H2O2的性质,解释实验甲和实验乙能否达到实验目的:_________________________________________________________________
_______________________________________________________________。
(4)实验过程中该同学对实验丙、丁、戊中产生的气体进行收集,并在2 min内6个时间点对注射器内气体进行读数,记录数据如表。
时间/s
20
40
60
80
100
120
气体体
积/mL
实验丙
9.5
19.5
29.0
36.5
46.0
54.5
实验丁
8.0
16.0
23.5
31.5
39.0
46.5
实验戊
15.5
30.0
44.5
58.5
71.5
83.0
①对实验戊,0~20 s的反应速率v1=________ mL·s-1,100~120 s的反应速率v2=________ mL·s-1。不考虑实验测量误差,二者速率存在差异的主要原因是_______________________________________________________________
_______________________________________________________________。
②如图是根据实验收集到最大体积的气体时所用时间绘制的图像。曲线c表示的是实验________(填“丙”、“丁”或“戊”)。
解析 (1)过氧化氢在催化剂作用下分解生成氧气和水。(2)对比实验甲和乙,可知不同的是过氧化氢的浓度;对比实验丙、丁、戊,可知不同的是H2O2溶液的酸碱性。(3)过氧化氢在不加热且没有催化剂作用的条件下性质比较稳定,故实验甲和乙尽管H2O2浓度不同,但H2O2均不会分解生成氧气。(4)由于实验戊产生氧气的速率最快,实验丁产生氧气的速率最慢,可推知图像中曲线a、b、c对应的分别为实验戊、丙、丁。
答案 (1)2H2O22H2O+O2↑
(2)反应物浓度不同对反应速率的影响 不同酸碱性条件下,催化剂对反应速率的影响
(3)实验甲和实验乙不能达到实验目的,因H2O2在常温且无催化剂作用的条件下比较稳定
(4)①0.775 0.575 随反应的不断进行,H2O2浓度逐渐降低,反应速率减小 ②丁
考点指导2 速率、平衡图像分析
【典例2】 用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:
反应Ⅰ:4NH3(g)+6NO(g)5N2(g)+6H2O(l) ΔH1
反应Ⅱ:2NO(g)+O2(g)2NO2(g) ΔH2(且|ΔH1|=2|ΔH2|)
反应Ⅲ:4NH3(g)+6NO2(g)5N2(g)+3O2(g)+6H2O(l) ΔH3
反应Ⅰ和反应Ⅱ在不同温度时的平衡常数及其大小关系如下表:
温度/K
反应Ⅰ
反应Ⅱ
已知:
K2>K1>K′2>K′1
298
K1
K2
398
K′1
K′2
(1)推测反应Ⅲ是________反应(填“吸热”或“放热”)
(2)相同条件下,反应Ⅰ在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=________。
②下列说法正确的是________。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H—O键与N—H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已达到平衡
(3)一定条件下,反应Ⅱ达到平衡时体系中n(NO)∶n(O2)∶n(NO2)=2∶1∶2。在其他条件不变时,再充入NO2气体,分析NO2体积分数——φ(NO2)的变化情况:恒温恒压容器,φ(NO2)________;恒温恒容容器,φ(NO2)________(填“变大”、“变小”或“不变”)。
(4)一定温度下,反应Ⅲ在容积可变的密闭容器中达到平衡,此时容积为3 L,c(N2)与反应时间t变化曲线X如图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z。则:
①变为曲线Y改变的条件是___________________________________。
变为曲线Z改变的条件是______________________________________。
②若t2时降低温度,t3时达到平衡,请在图中画出曲线X在t2~t4内c(N2)的变化曲线。
解析 (1)分析表中数据可知,对于反应Ⅰ和反应Ⅱ,温度升高时,K值减小,平衡逆向移动,故两个反应都是放热反应,焓变小于0。将反应Ⅰ-反应Ⅱ×3得反应Ⅲ,则ΔH3=ΔH1-3ΔH2=2ΔH2-3ΔH2=-ΔH2,因为ΔH2<0,所以ΔH3>0,反应Ⅲ是吸热反应。(2)①v(NO)=v(N2)=×=0.375 mol·L-1·min-1。②单位时间内生成的N2越多,则活化分子越多,活化能越低,A错误;增大压强能使反应速率加快,是因为增加了活化分子的浓度,活化分子的百分数不变,B错误;单位时间内H—O键与N—H键断裂的数目相等时,说明正反应速率等于逆反应速率,反应已经达到平衡,C正确;若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡,D正确。(3)恒温恒压容器中的平衡是等效平衡,φ(NO2)不变;恒温恒容容器,再充入NO2气体,等效于增大压强,平衡正向移动,φ(NO2)变大。(4)①曲线Y比曲线X先达到平衡,但平衡状态相同,改变的条件是加入催化剂;曲线Z条件下,N2的浓度由2 mol·L-1
瞬间增大到3 mol·L-1,容器体积应由3 L减小到2 L,改变的条件是:将容器的体积快速压缩至2 L。②该反应是吸热反应,降低温度时,平衡逆向移动,c(N2)在原有基础上逐渐减小,直到达到新的平衡。
答案 (1)吸热 (2)①0.375 mol·L-1·min-1 ②CD
(3)不变 变大 (4)①加入催化剂 将容器的体积快速压缩至2 L ②图像如图
【课堂对点训练】
2.(1)将0.05 mol SO2(g)和0.03 mol O2(g)放入容积为1 L的密闭容器中发生反应,反应2SO2(g)+O2(g)2SO3(g)的能量变化如图所示,在一定条件下达到平衡,测得c(SO3)=0.04 mol·L-1,则该条件下反应的平衡常数K为________,若温度升高,K将________(填“增大”或“减小”)。
(2)600 ℃时,在1 L的密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示。据图判断:
①0~10 min,v(O2)=________。
②10 min到15 min内曲线变化的原因可能是________(填写编号)。
a.使用了催化剂
b.缩小容器体积
c.降低温度
d.增加SO3的物质的量
答案 (1)1 600 L·mol-1 减小
(2)①0.000 5 mol·L-1·min-1 ②ab
考点指导3 平衡图表题综合应用
【典例3】 甲醇是重要的化工原料,又可做为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
Ⅰ.CO(g)+2H2(g)CH3OH(g) ΔH1
Ⅱ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH2=-58 kJ/ mol
Ⅲ.CO2(g)+H2(g)CO(g)+H2O(g) ΔH3
回答下列问题:
(1)物质的标准生成热是常用的化学热力学数据,可以用来计算化学反应热。即化学反应热:ΔH=生成物标准生成热总和-反应物标准生成热总和。
已知四种物质的标准生成热如下表:
物质
CO
CO2
H2
CH3OH(g)
标准生成
热(kJ/ mol )
-110.52
-393.51
0
-201.25
A.计算ΔH1=________kJ/ mol B.ΔH3________0(填“=”“<”或“>”)
(2)由甲醇在一定条件下制备甲醚。一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g)。实验数据见下表:
容器
编号
温度
(℃)
起始物质的量(mol)
平衡物质的量(mol)
CH3OH(g)
CH3OCH3(g)
H2O(g)
CH3OCH3(g)
H2O(g)
a
387
0.20
0
0
0.080
0.080
b
387
0.40
0
0
c
207
0.20
0
0
0.090
0.090
下列说法正确的是________。
A.该反应的正反应为放热反应
B.达到平衡时,容器a中的CH3OH体积分数比容器b中的小
C.容器a中反应到达平衡所需时间比容器c中的长
D.若起始时向容器a中充入CH3OH 0.15 mol 、CH3OCH3 0.15 mol 和H2O 0.10 mol,则反应将向正反应方向进行
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图所示。
①α(CO)值随温度升高而________(填“增大”或“减小”),其原因是_______________________________________________________________。
②图中p1、p2、p3的大小关系为________,其判断理由是
________________________________________________________________。
(4)甲醇可以制成燃料电池,与合成气制成燃料电池相比优点是________;若以硫酸作为电解质其负极反应为______________________________________。
解析 (1)利用标准生成热可计算反应的焓变ΔH1=(-201.25)-[(-110.52)-2×0]kJ/ mol=-90.73 kJ/ mol ;利用盖斯定律Ⅱ-Ⅰ即可得到Ⅲ,所以ΔH3=ΔH2-ΔH1 =-58 kJ/ mol-(-90.73 kJ/ mol)=32.73 kJ/ mol >0。(2)容器a、c中CH3OH的物质的量相同,而容器a的温度比容器c高,平衡时CH3OCH3的物质的量:a
相关文档
- 2020届高考化学一轮复习化学能与热2021-07-065页
- 2021届高考化学一轮复习化学反应与2021-07-066页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-066页
- 2021届高考化学一轮复习化学平衡常2021-07-0623页
- 2021届高考化学一轮复习化学实验方2021-07-0613页
- 2020届高考化学一轮复习化学反应的2021-07-066页
- 2020届高考化学一轮复习化学反应速2021-07-0610页
- 2020届高考化学一轮复习化学反应与2021-07-0612页
- 2021届高考化学一轮复习化学键学案2021-07-067页
- 2021届高考化学一轮复习化学反应速2021-07-065页