- 807.40 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1.化学与生产、生活、科技密切相关,下列说法正确的是( )
A. 在抗击新冠肺炎疫情中,84 消毒液、酒精用作环境消毒剂,是因为它们具有强氧化性
B. “地沟油”经加工处理后,可用来制肥皂、生物柴油,从而实现厨余废物合理利用
C. 工业上,采用雾化技术燃煤的目的是提高煤的燃烧效率、减少 SO2 的排放
D. “玉兔二号”月球车首次实现在月球背面着陆,其太阳能电池帆板的材料是二氧化硅
【答案】B
【解析】
【分析】
【详解】A. 84 消毒液具有强氧化性,用于杀菌消毒;酒精能够使蛋白质发生变性,使细菌、
病毒失去生理活性,因此用作环境消毒剂,不是因为它具有强氧化性,A 错误;
B. “地沟油”主要成分是高级脂肪酸的甘油酯,对人体健康有害,不能食用,经皂化反应后可
用来制肥皂,经与甲醇发生酯交换反应可制取生物柴油,从而实现厨余废物合理利用,变废
为宝,B 正确;
C. 工业上,采用雾化技术燃煤的目的是扩大接触面积,提高煤的燃烧效率、但不能减少 SO2
的排放,C 错误;
D. 太阳能电池帆板的材料是晶体硅,利用其导电性,而二氧化硅则用于制光导纤维,D 错误;
故合理选项是 B。
2.有机物 A 的相对分子质量为 128,燃烧只生成 CO2 和 H2O,已知 A 中含有一个六元碳环且 A
可与 NaHCO3 溶液反应,则该有机物碳环上一氯代物的数目为(不考虑立体异构)( )
A. 2 B. 3 C. 4 D. 5
【答案】C
【解析】
【分析】
【详解】A 含有一个六元碳环且能与 NaHCO3 溶液反应生成二氧化碳,则 A 中含有-COOH,
有机物 A 完全燃烧后只生成 CO2 和 H2O,说明没有 C、H、O 以外的元素,A 的相对分子质量
为 128 的,A 含有一个六碳环,6 个碳原子式量为 72,-COOH 的式量为 45,故分子含有 1 个
-COOH,利用残余法可知,剩余基团或原子的总式量为 128-72-45=11,故还有 11 个 H 原子,
A 的结构简式为 ,环上的取代物,除了-COOH 的邻、间、对位置外,羧基连接的
碳也还有氢原子,可以取代,故其环上的一氯代物有 4 种,故合理选项是 C。
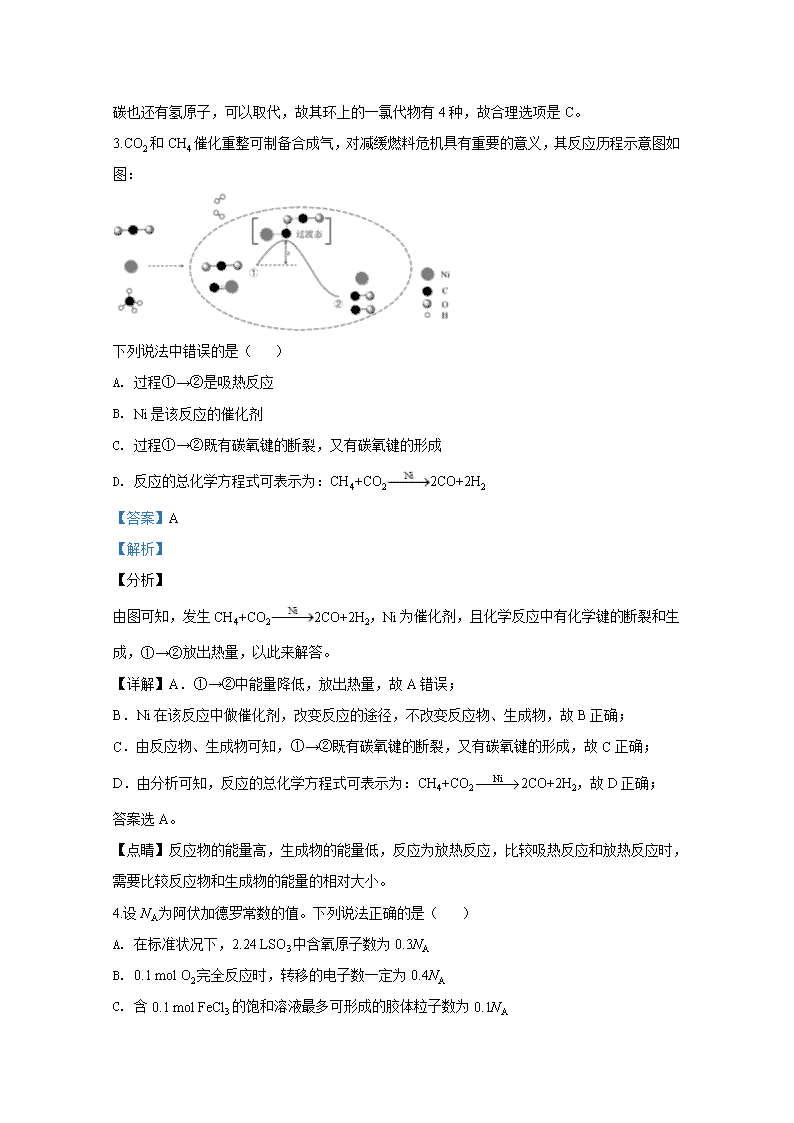
3.CO2 和 CH4 催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如
图:
下列说法中错误的是( )
A. 过程①→②是吸热反应
B. Ni 是该反应的催化剂
C. 过程①→②既有碳氧键的断裂,又有碳氧键的形成
D. 反应的总化学方程式可表示为:CH4+CO2 2CO+2H2
【答案】A
【解析】
【分析】
由图可知,发生 CH4+CO2 2CO+2H2,Ni 为催化剂,且化学反应中有化学键的断裂和生
成,①→②放出热量,以此来解答。
【详解】A.①→②中能量降低,放出热量,故 A 错误;
B.Ni 在该反应中做催化剂,改变反应的途径,不改变反应物、生成物,故 B 正确;
C.由反应物、生成物可知,①→②既有碳氧键的断裂,又有碳氧键的形成,故 C 正确;
D.由分析可知,反应的总化学方程式可表示为:CH4+CO2 Ni 2CO+2H2,故 D 正确;
答案选 A。
【点睛】反应物的能量高,生成物的能量低,反应为放热反应,比较吸热反应和放热反应时,
需要比较反应物和生成物的能量的相对大小。
4.设 NA 为阿伏加德罗常数的值。下列说法正确的是( )
A. 在标准状况下,2.24 LSO3 中含氧原子数为 0.3NA
B. 0.1 mol O2 完全反应时,转移的电子数一定为 0.4NA
C. 含 0.1 mol FeCl3 的饱和溶液最多可形成的胶体粒子数为 0.1NA
D. 常温常压下,1.8 g 甲基(-CD3)中含有的中子数为 0.9NA
【答案】D
【解析】
【分析】
【详解】A. 在标准状况下,SO3 呈固态,不能使用气体摩尔体积计算微粒数目,A 错误;
B. 若 O2 与金属 Na 反应产生 Na2O2,每 1 mol O2 反应转移 2 mol 电子,则 0.1 mol O2 完全发生
该反应时,转移电子数为 0.2NA,B 错误;
C. Fe(OH)3 胶体的胶粒是许多 Fe(OH)3 的集合体,所以含 0.1 mol FeCl3 的饱和溶液形成的胶体
粒子数小于 0.1NA,C 错误;
D. 甲基(-CD3)的式量是 18,一个该甲基中含有 9 个中子,1.8 g 甲基(-CD3)的物质的量是 0.1
mol,所以其中含有的中子数为 0.9NA,D 正确;
故合理选项是 D。
5.W、X、Y、Z 均为短周期元素且原子序数依次增大,W 和 X 同族。Y 原子最外层电子数是
W 与 X 原子最外层电子数之和的 3 倍,是 Z 原子最外层电子数的 2 倍。下列说法正确的是
A. 离子半径:W-<X+
B. Z 的最高价氧化物的水化物是强碱
C. 化合物 XZW4 具有强还原性
D. W 与 Y 只能形成 10 电子化合物
【答案】C
【解析】
【分析】
W、X、Y、Z 均为短周期元素且原子序数依次增大,W 和 X 同族。Y 原子最外层电子数是 W
与 X 原子最外层电子数之和的 3 倍,Y 最外层电子是 6,W 和 X 同族是 IA,是 Z 原子最外层
电子数的 2 倍,Z 最外层电子是 3。W 为 H,X 为 Li,Y 为 O,Z 为 Al。
【详解】A. 电子层结构相同的粒子,核电荷数越大,半径越小,离子半径:H->Li+,故 A 错
误;
B. Al 的最高价氧化物的水化物是 Al(OH)3 ,是两性氢氧化物,故 B 错误;
C. 化合物 LiAlH4 中 H 是-1 价,具有强还原性,故 C 正确;
D. W 与 Y 能形成 10 电子化合物 H2O ,还能形成 18 电子的化合 H2O2 ,故 D 错误;
故选 C。
【点睛】本题考查元素周期表及其推断,解题关键:W 和 X 同族,Y 原子最外层电子数是 W
与 X 原子最外层电子数之和的 3 倍,W 和 X 同族只能是 IA,易错点 D,氢和氧可形成水和双
氧水两种化合物。
6.联胺是火箭的燃料,一种用联胺制成的燃料电池示意图如图(总反应为:N2H4+O2=N2+2H2O),
下列说法正确的是( )
A. 该电池工作时,电子从负极经电解质溶液到正极
B. 电池工作一段时间后,溶液的 pH 减小
C. 负极的电极反应式为:N2H4-4e-=N2↑+4H+
D. 当电路中通过 0.1 mol 电子时,负极消耗 0.56 L 的氧气
【答案】B
【解析】
【详解】A. 电子不能经过电解质溶液,在溶液中是离子定向移动,A 错误;
B. 电池的总反应为 N2H4+O2=N2+2H2O,反应生成水,溶液的浓度减小,pH 减小,B 正确;
C. 燃料电池的负极发生氧化反应,是肼在反应,肼中的 N 从-2 价升高到 0 价,碱性环境中不
可能大量存在 H+,碱性电池中,其电极反应式应为 N2H4+4OH--4e-=N2↑+4H2O,C 错误;
D. 没有说明是否是标准状况下,无法计算气体的体积,D 错误;
故合理选项是 B。
7.依据下列实验现象,所得结论不正确...的是
实验 实验现象
①品红溶液红色褪去,经检验溶液中含有 SO4
2-
②加热褪色后的溶液至沸腾,未见颜色恢复,有气
体溢出,可使蓝色石蕊试纸变红,遇淀粉碘化钾试
纸,无明显变化。
A. 品红溶液褪色是氯水漂白所致
B. 集气瓶中发生了反应:Cl2 + SO2 + 2H2O H2SO4 + 2HCl
C. 依据现象②可确定产生的气体为 SO2
D. 检验 SO4
2-的试剂为:盐酸、BaCl2 溶液
【答案】C
【解析】
【详解】A.氯水中的次氯酸能使品红溶液褪色,选项 A 正确;
B. 集气瓶中氯气与二氧化硫发生氧化还原反应生成硫酸和盐酸,反应方程式为:Cl2 + SO2 +
2H2O H2SO4 + 2HCl,选项 B 正确;
C. 依据现象②加热褪色后的溶液至沸腾,未见颜色恢复,有气体溢出,说明不含有二氧化硫,
产生的气体可能为次氯酸分解产生的 O2,选项 C 不正确;
D. 检验 SO42-的试剂为:盐酸、BaCl2 溶液,往溶液中加入过量的盐酸酸化,再滴加 BaCl2 溶
液,若产生白色沉淀则溶液中含有 SO42-,选项 D 正确。
答案选 C。
【点睛】本题考查常见漂白剂的性质及应用,注意二氧化硫为暂时性的漂白,氯水为永久性
的漂白,二者按 1:1 若完全反应,则生成硫酸和盐酸,失去漂白作用,这也是本题的易错点。
二、非选择题
8.汽车用汽油的抗爆剂约含 17%的 1,2—二溴乙烷(无色液体,沸点:131℃,熔点:9.3℃)。
同学们在实验室拟制备少量 1,2—二溴乙烷,流程如图:
任务 I:1,2—二溴乙烷的制备(利用如图装置,完成流程图中步骤①和②)
(i)在冰水冷却下,将 24 mL 浓硫酸注入 12 mL 乙醇中混合均匀。
(ii)向 D 装置的试管中加入 3.0 mL 液溴(0.10 mol),加入适量水液封,并向烧杯中加入冷却剂。
(ⅲ)连接仪器并检查装置的气密性。向三颈烧瓶中加入碎瓷片,通过 M 向三颈烧瓶中加入部
分硫酸与乙醇的混合物,一部分留在 M 中。
(iv)先切断 C、D 的连接处,加热三颈烧瓶,待温度上升到 120℃,连接 C、D,待温度升到 180℃~
200℃,通过 M 慢慢滴入混合液。
(v)继续加热三颈烧瓶,待 D 中试管内的颜色完全褪去,切断 C、D 的连接,停止加热。
回答问题:
(1)图中仪器 M 的名称是_______。
(2)图中 B 装置中玻璃管的作用是_________。
(3)步骤ⅳ中“先切断 C、D 的连接处,再加热三颈烧瓶”的原因是______。
(4)装置 D 的烧杯中需加入冷却剂,下列冷却剂合适的为_______。
A. 冰水混合物 B. 5℃的水 C. 10℃的水
任务Ⅱ:1,2—二溴乙烷的纯化(流程图中步骤③④⑤)
步骤③冷却后,把装置 D 试管内的产物转移至分液漏斗,用 1%的 NaOH 水溶液洗涤。
步骤④:用水洗涤至中性。
步骤⑤:向所得的有机层中加适量无水氯化钙,过滤,转移至蒸馏烧瓶中蒸馏,收集 130℃~
132℃的馏分,得到产品 4.70 g。
(5)步骤③中加入 1%的 NaOH 水溶液时,发生反应的化学方程式为________。
(6)步骤⑤中加入无水氯化钙的作用为_____。该实验所得产品的产率为_______。
【答案】 (1). 恒压漏斗 (2). 安全瓶,指示 B 中压强变化,避免气流过快仪器压强过
大 (3). 减 少 气 体 对 溴 水 搅 动 , 减 少 溴 蒸 气 的 挥 发 (4). C (5).
Br2+2OH-=Br-+BrO-+H2O (6). 干燥产品(除去产品中的水) (7). 25%
【解析】
【分析】
结合装置图知,A 装置是浓硫酸与乙醇混合加热用于乙烯的制备,B 是安全瓶,防止倒吸,C
进行乙烯的净化,除去杂质 CO2、SO2,D 装置进行 1,2 -二溴乙烷的制备,E 进行尾气吸收。
B 中玻璃管的作用是指示 B 中的压强变化,避免气流过快引起 B 中压强过大,在 1,2 一二
溴乙烷的净化阶段,第一步加入 NaOH 溶液是为了吸收剩余的 Br2,第二步水洗是为了洗去
NaOH 溶液,第三步的无水氯化钙用来干燥生成的 1,2 一二溴乙烷,据此分析解答。
【详解】(1)根据图示可知图中仪器 M 的名称是恒压漏斗;
(2)不论是 C 装置中 NaOH 溶液吸收 CO2 和 SO2 等酸性杂质气体,倒吸到装置 B 中,还是装置
A 中一旦堵塞,装置 B 中内的液体进入到长玻璃管内,所以装置 B 的作用是用作安全瓶的作
用,可指示 B 中压强变化,避免气流过快引起压强过大;
(3)加热三口瓶前,先切断瓶 C 和瓶 D 的连接处,气体就不能进入到装有溴的装置内,减少气
体对溴水搅动,减少溴蒸气的挥发;
(4)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,故
开始反应时为防止液溴挥发,要给装置 D 的烧杯中降温,又已知:1,2-二溴乙烷的沸点为
131℃,熔点为 9.3℃,在 D 中制备时防止产品堵塞试管,要确保 1,2 一二溴乙烷呈液态,
故最好用 10℃的冷水,故合理选项是 C;
(5)由于溴有挥发性、有毒,根据 Br2 能够与碱反应产生可溶性物质的性质,用 1%的 NaOH 水
溶液吸收多余的 Br2,Br2 与 NaOH 反应产生 NaBr、NaBrO 和 H2O,发生反应的离子方程式为:
Br2+2OH-=Br-+BrO-+H2O;
(6)分液后,加干燥剂除去产品中的水分,加入无水氯化钙目的是干燥生成的 1,2-二溴乙烷;
根据反应方程式为:Br2+CH2=CH2→CH2Br-CH2Br,通入 0.10 mol Br2,则理论上产生 0.10 mol
CH2Br-CH2Br,则 1,2 -二溴乙烷理论产量是 m(CH2Br-CH2Br)=n·M=0.10 mol×188 g/mol=18.8 g,
实际产量是 4.70 g,因此 1,2-二溴乙烷的产率是 4.70
18.8
g
g ×100%=25%。
【点睛】本题考查了 1,2-二溴乙烷的制取及物质转化率的计算,解题的关键是把握制备实验
的原理,能正确理解设计的实验顺序,清楚每一个实验装置的作用,牢固把握实验基本操作
是解答该类题目的保证。
9.氟碳铈矿(主要成分为 CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,根据如图以氟
碳铈矿为原料提取铈的工艺流程图,回答问题:
(1)CeFCO3 中 Ce 的化合价为_____;氧化焙烧时不能使用陶瓷容器,原因是______。
(2)氧化焙烧后的产物之一为 CeO2,则酸浸时发生反应的离子方程式为_________。
(3)HT 是一种难溶于水的有机溶剂,则操作 I 的名称为________。
(4)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是
__________。
(5)已知有机物 HT 能将 Ce3+从水溶液中萃取出来,该过程可表示为:Ce3+(水层)+3HT(有机
层) CeT3(有机层)+3H+(水层)。向 CeT3(有机层)中加入稀硫酸能获得较纯的含 Ce3+水溶液,从平衡
角度解释其原因:________。
(6)写出向 Ce(OH)3 悬浊液中通入氧气得到产品 Ce(OH)4 的化学方程式:________。
(7)298K 时,向 c(Ce3+)=0.02 mol/L 的溶液中加入氢氧化钠来调节溶液的 pH,若反应后溶液
pH=10,此时 Ce3+是否沉淀完全?______。【要求列式计算,已知:Ksp[Ce(OH)3]=1.0×10-20,
c(Ce3+)<1.0×10-5 mol/L 视为沉淀完全】。
【 答 案 】 (1). +3 (2). 陶 瓷 会 与 生 成 的 HF 反 应 (3).
2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O (4). 分液 (5). 温度升高,双氧水发生分解,造成
浸出率偏小 (6). 向混合液中加入稀硫酸,使 c(H+)增大,平衡向生成 Ce3+水溶液方向移动
(7). 4Ce(OH)3+O2+2H2O=4Ce(OH)4 (8). 是
【解析】
【分析】
氟碳铈矿主要化学成分为 CeFCO3,由流程可知,氧化焙烧生成二氧化碳、HF 气体及 CeO2,
再加稀硫酸、过氧化氢,发生氧化还原反应:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O,溶液中加
入萃取剂 HT,操作 I 为分液将溶液中的 Ce3+萃取出来,再加入稀硫酸得含有 Ce3+的溶液,调
节溶液的 pH 得到 Ce(OH)3 沉淀,再经过氧气氧化发生 4Ce(OH)3+O2+2H2O=4Ce(OH)4,过滤、
洗涤、干燥可得 Ce(OH)4 产品,以此来解答。
【详解】(1)CeFCO3 中 CO32-整体显-2 价,F 显-1 价,根据化合物中正、负化合价代数和为 0,
可知 Ce 的价态为+3 价;氧化焙烧时不能使用陶瓷容器,这是由于陶瓷容器中含有 SiO2,SiO2
与 HF 发生反应:SiO2+4HF=SiF4↑+2H2O,因此在该流程氧化焙烧时不能使用陶瓷容器;
(2)氧化焙烧后的产物之一为 CeO2,酸浸时,CeO2 与硫酸、H2O2 发生氧化还原反应,产生
Ce2(SO4)3、O2、H2O,该反应的离子方程式为 2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O;
(3)操作 I 是得到溶液和有机相,是分离互不相容的两层液体物质,因此操作 I 的名称为分液;
(4)酸浸时加入 H2O2,H2O2 不稳定,在高温下会发生分解,造成浸出率偏小;
(5)该过程中存在 Ce3+(水层)+3HT(有机层) CeT3(有机层)+3H+(水层),向混合液中加入稀硫
酸,使溶液中 c(H+)增大,化学平衡逆向移动,即向生成 Ce3+水溶液的方向移动,从而能获得
较纯的含 Ce3+水溶液;
(6)向 Ce(OH)3 悬浊液中通入氧气,发生氧化还原反应得到产品 Ce(OH)4,该反应的化学方程式
为:4Ce(OH)3+O2+2H2O=4Ce(OH)4;
(7)298K 时,向 c(Ce3+)=0.02 mol/L 的溶液中加入 NaOH 溶液来调节溶液的 pH,若反应后溶液
pH=10,则 c(OH-)=1.0×10-4 mol/L, Ce3+若形成沉淀,c(Ce3+)×c3(OH-)>Ksp[Ce(OH)3],而此时
溶液中 c(Ce3+)=
20
34
1.0 10
1.0 10
mol/L=1.0×10-8 mol/L<1.0×10-5 mol/L,因此 Ce3+沉淀完全。
【点睛】本题考查了化学方程式和离子方程式的书写、混合物分离提纯及溶度积常数的应用,
把握物质的性质、混合物分离方法、实验技能为解答的关键,侧重考查学生的分析与实验能
力,注意氧化还原反应规律及元素化合物知识的应用。
10.中科院一项新研究成果实现了甲烷高效生产乙烯,其反应为:2CH4(g) C2H4(g)+2H2(g)
ΔH>0
物质 燃烧热(kJ/mol)
氢气 285.8
甲烷 890.3
乙烯 1411.5
(1)已知相关物质的燃烧热如表,完成热化学方程式:2CH4(g) C2H4(g)+2H2(g)
ΔH=__。
(2)温度为 T1℃时,向 1 L 的恒容反应器中充入 2 mol CH4,仅发生上述反应,反应 0~15 min
CH4 的物质的量随时间变化如图 1,实验测得 10~15 min 时 H2 的浓度为 1.6 mol/L。
①若图 1 中曲线 a、b 分别表示在 T1℃时,使用等质量的两种不同的催化剂时,达到平衡过程
中 n(CH4)变化曲线,判断:催化剂 a_____b(填“优于”或“劣于”)。
②在 15 min 时改变反应条件,导致 n(CH4)发生变化(见图 1),则改变的条件可能是:_____(任
答一条即可)。
(3)实验测得 v 正=k 正 c2(CH4),v 逆=k 逆 c(C2H4)·c2(H2),其中 k 正、k 逆为速率常数仅与温度有
关,温度为 1T 时,k 正与 k 逆的比值为______(填数值)。若将温度由 T1 升高到 T2,则反应速率
增大的倍数 v 正_______ v 逆(填“>”、“=”或“<”),判断的理由是_________。
(4)科研人员设计了甲烷燃料电池并用于电解(如图 2)。电解质是掺杂了 Y2O3 与 ZrO2 的固体,
可在高温下传导 O2-。
①图中 C 处的 Pt 为_______(填“阴”或“阳”)极。
②该电池工作时负极的电极反应式为________。
③用该电池电解饱和食盐水,一段时间后收集到标准状况下气体总体积为 112 mL,则阴极区
所得溶液在 25℃时 pH=_______(假设电解前后 NaCl 溶液的体积均为 500 mL)。
【答案】 (1). +202.5 kJ/mol (2). 劣于 (3). 升高温度或减小压强 (4). 12.8
(5). > (6). 升高温度,正、逆反应速率都加快,平衡正向移动,v(正)>v(逆),说明正反应速
率增大的倍数多于逆反应速率增大的倍数 (7). 阳 (8). CH4-8e-+4O2-=CO2+2H2O (9).
12
【解析】
【详解】(1)根据已知条件,可得热化学方程式:
①H2(g)+ 1
2 O2(g)=H2O(l) ;ΔH=-285.8 kJ/mol;
②CH4(g)+2O2(g)=CO2(g)+2H2O(l); ΔH=-890.3 kJ/mol;
③C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ;ΔH=-1411.5kJ/mol;
根据盖斯定律,将②×2-①×2-③,整理可得:2CH4(g) C2H4(g)+2H2(g) ΔH=+202.5
kJ/mol;
(2)①若图 1 中曲线 a、曲线 b 分别表示在温度 T1 时,使用质量相同但表面积不同的催化剂时,
达到平衡过程中 n(CH4)变化曲线,可知:b 催化剂表面积大,反应速率越快,达到平衡所需时
间越短,先达到平衡,该催化剂性能好,b 先达到平衡,说明催化剂 a 劣于催化剂 b;
②15 min 时,若改变外界反应条件,n(CH4)发生图中所示变化,物质的量随时间变化减小,
说明平衡正向进行,正反应为气体体积增大的吸热反应,升高温度或减小压强,平衡正向进
行,符合图象变化,故改变的条件是升高温度或减小压强;
(3) v 正=k 正 c2(CH4),v 逆=k 逆 c(C2H4)·c2(H2),其中 k 正、k 逆为速率常数仅与温度有关,温度
不变平衡常数不变,反应达到平衡状态时,正、逆反应速率相同,得到 T1 温度时 k 正与 k 逆的
比值;k 正 c2(CH4)=k 逆 c(C2H4)·c2(H2),
2
2 4 2
2
4
c C H c Hk
k c CH
正
逆
,对于反应
2CH4(g) C2H4(g)+2H2(g) ,反应开始时 n(CH4)=2 mol,n(C2H4)=n(H2)=0,反应达到平
衡时,H2 的浓度为 1.6 mol/L,由于容器的容积是 1 L,所以平衡时气体的物质的量与浓度数
值相等,各种物质的平衡浓度分别是:c(CH4)=(2 -1.6)mol/L=0.4 mol/L,n(C2H4)=0.8 mol/L,
n(H2)=1.6 mol/L,因此平衡时 K=
2 2
2 4 2
2 2
4
c C H c H 0.8 1.6
c CH 0.4
mol/L=12.8 mol/L,即
2
2 4 2
2
4
c C H Hk Kk c CH
c 正
逆
=12.8 mol/L;升高温度,正、逆反应速率都加快。由于该反应
的正反应为吸热反应,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,说明正反
应速率增大的倍数大于逆反应速率增大的倍数,速率增大后,由于 v(正)>v(逆),使化学平衡正
向移动;
(4)①甲烷燃料电池中通入甲烷的电极为原电池负极,通入氧气的电极为原电池的正极,C 极
与原电池的正极连接为阳极;
②在原电池负极,CH4 失去电子生成 CO2,传导离子是 O2-,结合电荷守恒、原子守恒,可得
负极的电极反应式:CH4-8e-+4O2-=CO2+2H2O;
③n(H2+Cl2)= 0.112
22.4 /
L
L mol
=0.005 mol,根据电解反应方程式:
2NaCl+2H2O Cl2↑+H2↑+2NaOH,可知每反应产生 2 mol 气体,同时在阴极得到 2 mol
NaOH,现在反应产生 0.005 mol 气体,因此反应产生了 0.005 mol NaOH,由于溶液的体积
是 0.5 L,则阴极附近溶液中 c(NaOH)= 0.005
0.5
mol
L
=0.01 mol/L,在室温下水的离子积常数
Kw=10-14(mol/L)2,c(H+)=
1410
0.01
mol/L=10-12 mol/L,所以溶液的 pH=12。
11.氮、磷化合物用途非常广泛,如:磷化硼(BP)、磷青铜(Cu3SnP)等。回答问题:
(1)锡(Sn)是第五周期ⅣA 元素。基态锡原子的价电子排布式为_____。
(2)PH3 分子的空间构型为______。PH3 的键角小于 NH3 的原因是_____。
(3)羟基磷灰石[Ca5(PO4)3OH]是牙齿中的重要矿物质,其中羟基(-OH)中氧原子的杂化方式为
_____,该化合物所含元素中电负性最大的是_______。
(4)磷酸和亚磷酸(H3PO3)是磷元素的两种含氧酸。亚磷酸与 NaOH 反应只生成 Na2HPO3 和
NaH2PO3 两种盐,则 H3PO3 的结构式为______,其为_____元酸,原因是_____。
(5)磷化硼(BP)是倍受关注的耐磨材料,可用作金属表面的保护层,其结构与金刚石类似,晶
胞结构如图所示。
①磷化硼晶胞沿 z 轴在平面的投影图中,B 原子构成的几何形状是_______。
②已知晶胞边长 a pm,阿伏加德罗常数为 NA。则磷化硼晶体的密度为_____g/cm3。
【答案】 (1). 5s25p2 (2). 三角锥形 (3). 元素的电负性 N>P,成键电子对离中心原
子越近,成键电子对之间的排斥力越大,键角越大 (4). sp3 杂化 (5). O (6).
(7). 二 (8). 酸的元数与其形成的盐种类数目相同 (9). 正方形
(10). 310
A
4 42
N a 10
【解析】
【分析】
(1)Sn 是 50 号元素,位于元素周期表第五周期第 IVA 族,根据构造原理书写基态锡原子的价
电子排布式;
(2)PH3 与 NH3 空间构型相同,结合 P、N 元素的电负性及电子对之间的排斥力大小比较;
(3)根据价层电子对数判断 O 原子杂化轨道类型;根据元素的非金属性越强,其电负性越大分
析判断;
(4)只有羟基(-OH)氢能够与 NaOH 发生中和反应,酸是几元酸,就可形成几种盐据此分析判断;
(5)①该 BP 晶体在 Z 轴上投影,构成的是平面正方形结构;
②根据晶体密度ρ= m
V
计算;
【详解】(1)Sn 是 50 号元素,位于元素周期表第五周期第 IVA 族,价层电子排布式是 5s25p2;
(2) P 原子价层电子对数为 3+ 5 1 3
2
=4,VSEPR 构型为正四面体形,由于 P 原子上有 1 对
孤对电子占据四面体的一个顶点,所以 PH3 呈三角锥形;由于元素的电负性:N>P,键合电子
对偏向 N,成键电子对之间的斥力大增大,电子对离中心原子更近,成键电子对之间的排斥力
越大,键角越大,所以键角 NH3 比 PH3 的大;
(3)在-OH 中 O 原子价层电子对数为 4,因此杂化轨道类型为 sp3 杂化;在羟基磷灰石
[Ca5(PO4)3OH]中含有的元素有 Ca、P、O、H 四种,由于元素的非金属性最强的元素是 O 元素,
元素的非金属性越强,其电负性越大,因此物质所含元素电负性最大的是 O 元素;
(4)由于酸的元数与其和碱反应产生的盐种类数目相同,亚磷酸与NaOH反应只能生成Na2HPO3
和 NaH2PO3 两种盐,说明 H3PO3 是二元酸,分子中含有 2 个与 P 原子连接的-OH,其结构式
为 ;
(5)①根据磷化硼(BP)晶胞结构可知 B 原子在 Z 轴上投影,形成的是平面正方形结构;
②在 1 个晶胞中,含有 P 原子数目为 8× 1
8 +6× 1
2 =4,4 个 B 原子在晶胞内,所以含有 B 原子
数目为 4 个,则该晶胞的密度ρ=
3 310 10
A A
4 31 11 gm 4 42
V N a 10 cm N a 10
g/cm3。
【点睛】本题考查物质结构和性质,涉及原子核外电子排布式的书写、原子的杂化、物质空
间构型、酸的元数的判断、晶胞计算等,掌握物质结构基础知识是本题解答的关键,侧重考
查学生知识运用、空间想象等能力,难点是(5)中投影图原子位置判断,明确晶胞内 4 个 B 原
子形成的空间结构排布式关键,在晶胞计算时要结合均摊方法,利用物质密度公式计算。
12.芳香族化合物 A(C9H12O)常用于药物及香料的合成, A 有如图转化关系:
已知:①A 的苯环上只有一个支链,支链上有 2 种不同化学环境的氢原子
② +CO2
回答问题:
(1)A 的结构简式为_________,A 生成 B 的反应类型为________。
(2)C 的化学式为___________。
(3)由 D 生成 E 的反应条件为__________。
(4)H 中所含官能团的名称为_____________。
(5)I 的结构简式为___________。
(6)由 E 生成 F 的化学方程为________。
(7)F 有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式________。
①能够发生水解反应和银镜反应;
②属于芳香族化合物且分子中只有一个甲基;
③核磁共振氢谱具有 5 种不同的吸收峰。
【答案】 (1). (2). 消去反应 (3). C8H8O (4). NaOH 水溶液、
加 热 (5). 羟 基 、 羧 基 (6). (7).
2 +O2 2 +2H2O (8).
或
【解析】
【分析】
A 是 芳 香 族 化 合 物 且 苯 环 侧 链 上 有 两 种 处 于 不 同 环 境 下 的 氢 原 子 , A 的 不 饱 和 度
= 9 2 2 12
2
=4,则侧链没有不饱和键,根据 A 的分子式,可知 A 为 ;B
能 发 生 加 成 反 应 , 说 明 B 分 子 中 含 有 碳 碳 双 键 , 则 A 发 生 消 去 反 应 生 成 B, B 为
;B 和溴发生加成反应生成 D 为 ;B 发生氧化反应生
成 C,结合信息②,可知 C 为 ;D 发生水解反应生成 E 为 ;
E 发生催化氧化反应生成 F 为 ,F 含有醛基,与银氨溶液水浴加热,发生银
镜反应,然后酸化得到 H 为 ,H 发生缩聚反应生成 I 为 。
【 详 解 】 根 据 上 述 分 析 可 知 : A 是 , B 是 , C 是
,D 是 ,E 是 ,F 是 ,
H 是 ,I 是 。
(1)根据上述分析可知 A 的结构简式为 ,A 与浓硫酸混合加热,发生消去反应
产生 B: ,所以 A 生成 B 的反应类型为消去反应。
(2)C 结构简式是 ,化学式为 C8H8O。
(3) D 是 ,E 是 ,D 是氯代烃,与 NaOH 的水溶液混
合加热,发生取代反应产生 E,所以由 D 生成 E 的反应条件为 NaOH 水溶液、加热。
(4)H 是 ,H 中所含官能团的名称为羟基、羧基。
(5)I 的结构简式为 。
(6) E 是 ,F 是 ,由于 E 中含有-CH2OH,该羟基可在
Cu 为催化剂条件下,加热,被氧化变为醛基:-CHO,物质由 E 变为 F。则由 E 生成 F 的化学
方程为 2 +O2 2 +2H2O;
(7)F 是 ,F 有多种同分异构体,其同分异构体符合下列条件:
①能够发生水解反应和银镜反应,根据物质分子中含有的 O 原子数可知含有 HCOO—;
②属于芳香族化合物且分子中只有一个甲基;
③核磁共振氢谱具有 5 种不同的吸收峰,说明分子中含有 5 种不同位置的 H 原子,则其可能
的结构为: 或 。
【点睛】本题考查有机物推断和有机合成,熟练掌握有机物官能团性质及其转化是本题解答
的关键。注意对给予信息的理解,明确官能团变化、碳链变化,注意采用正、逆推断向结合
的方法进行推断,侧重考查学生知识综合运用、知识迁移能力。