- 481.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学实验仪器和基本操作
一、选择题(本题包括4小题,每题6分,共24分)
1.下列操作正确的是 ( )
A.制取硝基苯实验配制混合酸时,先将浓硫酸注入容器,再慢慢注入浓硝酸
B.先用水润湿pH试纸,然后测定某溶液的pH
C.将硝酸银溶液盛放在棕色瓶里,并贮放在阴暗处
D.如果烧碱浓溶液沾到皮肤上,应立即用大量水冲洗,并涂上硫酸溶液
【解析】选C。实验室制硝基苯时,先将浓硝酸注入容器中,然后再慢慢注入浓硫酸,并及时搅拌,浓硝酸和浓硫酸混合后,在50~60 ℃的水浴中冷却后再滴入苯,故A错误;若测定前用水润湿试纸,会稀释被测液,使酸性溶液的pH偏大,碱性溶液的pH偏小,故B错误;硝酸银见光易分解,应放在棕色试剂瓶中,故C正确;NaOH浓溶液沾到皮肤上,应立即用大量水冲洗,并涂上硼酸中和碱性,故D错误。
2.下列实验操作导致所读出的数值比真实值小的是(假设其他操作均正确)( )
A.滴定终点时对滴定管仰视读数:28.80 mL
B.将NaCl固体置于托盘天平右盘称量:左盘砝码(8 g)和游码(0.6 g)读数的和为8.6 g
C.中和热测定时用铜棒代替环形玻璃搅拌棒搅拌,测定反应的最高温度:30.4 ℃
D.用量筒量取硝酸时,俯视读数:5.8 mL
【解析】选C。滴定终点时对滴定管仰视读数,读出的数值比真实值大,故A错误;由用托盘天平称量药品时,砝码和药品放反了,已知砝码质量为8 g,游码质量为
0.6 g,再根据左盘的质量=右盘的质量+游码的质量,即8 g=药品质量+0.6 g,所以药品实际质量为7.4 g,读出的数值比真实值大,故B错误;铜棒导热,使反应中放出的热量散失,温度降低,比真实值小,故C正确;俯视液面偏高,所读出的数值比真实值大,故D错误。
3.下列各种试剂中:①浓溴水 ②食盐溶液 ③浓硫酸 ④Na2SO3溶液 ⑤石灰水 ⑥氢硫酸 ⑦NaClO溶液,长期放置在空气中不容易变质而浓度变小的组合是 ( )
A.①③④ B.④⑤⑥
C.②④⑦ D.只有①③
【解析】选D。浓溴水,溴单质易挥发浓度变小,故①正确;食盐溶液长期放置在空气中不容易变质,水挥发使溶液浓度变大,故②错误;浓硫酸长期放置在空气中不容易变质,浓硫酸吸水使溶液浓度变小,故③正确;Na2SO3溶液长期放置在空气中易被空气中的氧气氧化为硫酸钠,故④错误;石灰水的化学成分是氢氧化钙,能与空气中的二氧化碳反应生成碳酸钙,故⑤错误;氢硫酸能被空气中的氧气氧化为硫单质,故⑥错误;强酸能与弱酸的盐反应制弱酸,碳酸的酸性比次氯酸的强,空气中的二氧化碳能与NaClO溶液反应生成碳酸钠和次氯酸,次氯酸见光易分解,故⑦错误。
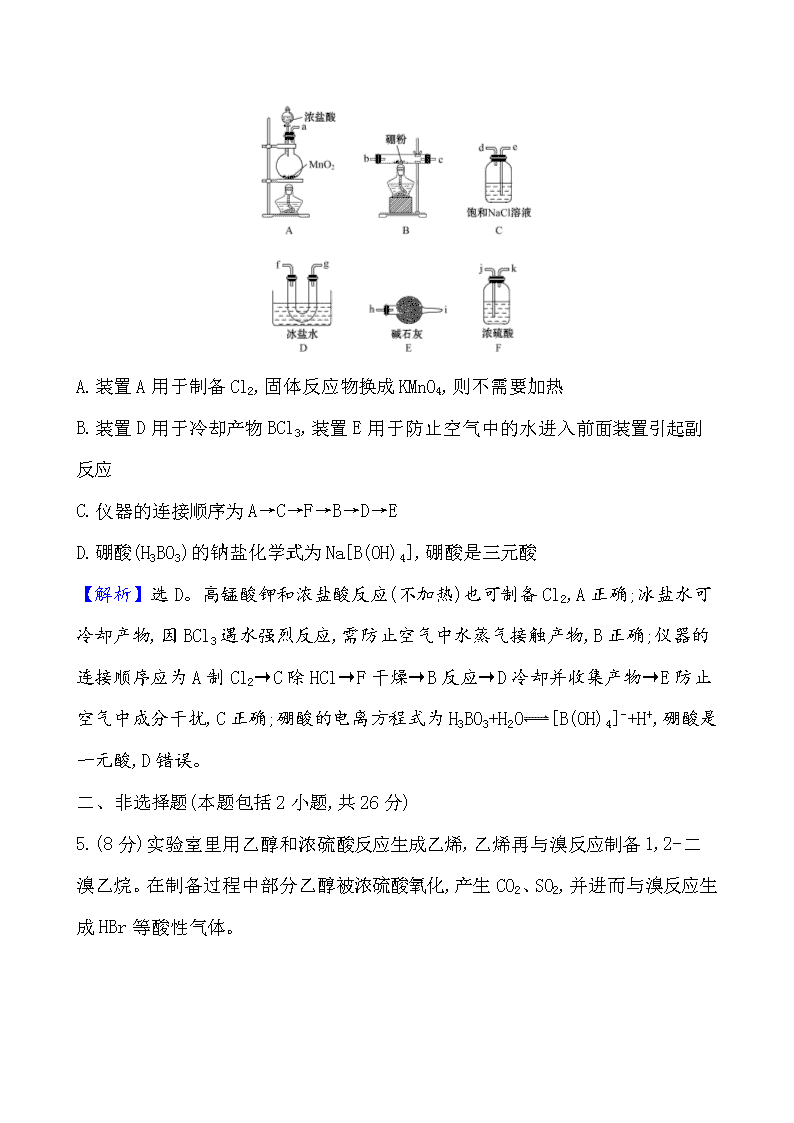
4.(金榜原创)BCl3常用作半导体硅的掺杂源或有机合成催化剂,若选择下图所示装置(装置可重复使用),以化合反应的方法制备BCl3(已知BCl3的熔点为
-107.3 ℃,沸点为12.5 ℃;遇水剧烈反应生成盐酸和硼酸)。下列说法错误的是 ( )
A.装置A用于制备Cl2,固体反应物换成KMnO4,则不需要加热
B.装置D用于冷却产物BCl3,装置E用于防止空气中的水进入前面装置引起副反应
C.仪器的连接顺序为A→C→F→B→D→E
D.硼酸(H3BO3)的钠盐化学式为Na[B(OH)4],硼酸是三元酸
【解析】选D。高锰酸钾和浓盐酸反应(不加热)也可制备Cl2,A正确;冰盐水可冷却产物,因BCl3遇水强烈反应,需防止空气中水蒸气接触产物,B正确;仪器的连接顺序应为A制Cl2→C除HCl→F干燥→B反应→D冷却并收集产物→E防止空气中成分干扰,C正确;硼酸的电离方程式为H3BO3+H2O [B(OH)4]- +H+,硼酸是一元酸,D错误。
二、非选择题(本题包括2小题,共26分)
5.(8分)实验室里用乙醇和浓硫酸反应生成乙烯,乙烯再与溴反应制备1,2-二溴乙烷。在制备过程中部分乙醇被浓硫酸氧化,产生CO2、SO2,并进而与溴反应生成HBr等酸性气体。
(1)用下列仪器,以上述三种物质为原料制备1,2-二溴乙烷。如果气体流向为从左到右,正确的连接顺序是(短接口或橡皮管均已略去):B经A①插入A中,D接A②;A③接 接 接 接 ;
(2)装置C的作用是 ;
(3)在装置E反应管中进行的主要反应的化学方程式为
。
【解析】(1)在浓硫酸作用下,乙醇共热发生消去反应生成乙烯的化学方程式为CH3CH2OHCH2CH2↑+H2O,由化学方程式可知制取乙烯时应选用A、B、D组装,为防止制取1,2-二溴乙烷时出现倒吸或堵塞,制取装置后应连接安全瓶C,为防止副反应产物CO2和SO2干扰1,2-二溴乙烷的生成,应在安全瓶后连接盛有氢氧化钠溶液的洗气瓶F,除去CO2和SO2,为尽量减少溴的挥发,将除杂后的乙烯通入冰水浴中盛有溴水的试管中制备1,2-二溴乙烷,因溴易挥发有毒,为防止污染环境,在制备装置后应连接尾气吸收装置,则仪器组装顺序为制取乙烯气体(用A、B、D组装)→安全瓶(C,兼防堵塞)→净化气体(F,用NaOH溶液吸收CO2和SO2等酸性杂质气体)→制备1,2-二溴乙烷的主要反应装置(E)→尾气处理(G);
(2)为防止制取1,2-二溴乙烷时出现倒吸或堵塞,制取装置后应连接安全瓶C;
(3)在装置E反应管中进行的主要反应为乙烯和溴发生加成反应生成1,2-二溴乙烷,反应的方程式为CH2CH2+Br2BrCH2CH2Br。
答案:(1)C F E G (2)作安全瓶,防止倒吸现象的发生 (3)CH2CH2+Br2CH2Br—CH2Br
6.(18分)以下是实验室常用的部分仪器,请回答下列问题:
(1)序号为⑧和⑩的仪器的名称分别为 、 。
(2)在分液操作中,必须用到上述仪器中的 (填序号)。
(3)能作反应容器且可直接加热的仪器是上述中的 (填名称)。
(4)配制一定物质的量浓度的溶液时要用到的仪器是 (填序号)。
(5)仪器上标有温度的有 (填序号)。
(6)如图是温度计、量筒、滴定管的一部分,下述读数(虚线对应刻度)及说法正确的是 。
A.①是量筒,读数为2.5 mL
B.②是量筒,读数为2.5 mL
C.③是滴定管,读数为2.5 mL
D.②是温度计,读数为2.5 ℃
【解析】(1)序号为⑧和⑩的仪器分别是容量瓶和直形冷凝管;(2)在分液操作中用到分液漏斗和烧杯;(3)能作为反应容器且能够直接加热的仪器是试管;(4)配制溶液时要用到的玻璃仪器是容量瓶、量筒、烧杯、玻璃棒、胶头滴管;(5)容量瓶、量筒上标有温度;(6)分析刻度可知①是温度计,②是量筒,读数精确到小数点后一位,③是滴定管,读数精确到小数点后两位,只有B合理。
答案:(1)容量瓶 直形冷凝管 (2)②⑥
(3)试管 (4)②④⑧⑨ (5)⑧⑨ (6)B
一、选择题(本题包括3小题,每题6分,共18分)
1.(金榜原创)实验室有下列试剂:①浓硝酸②铁粉③稀盐酸④硅酸钠溶液,应保存在相应的试剂瓶(甲、乙、丙、丁)中,下列试剂瓶选择正确的是 ( )
A.②③④① B.②④③①
C.②①③④ D.①②④③
【解析】选B。①浓硝酸见光易分解,应保存在棕色试剂瓶中;②铁粉是固体,应保存在广口瓶中;稀盐酸是液体,应保存在玻璃塞细口瓶中;④硅酸钠溶液呈碱性,应保存在橡胶塞细口瓶中。
2.下列实验操作或装置能达到目的的是 ( )
A
B
C
D
混合浓硫酸和乙醇
配制一定浓度的溶液
收集NO2气体
证明乙炔可使溴水褪色
【解析】选B。A、乙醇的密度小于浓硫酸,混合时应将浓硫酸沿烧杯壁倒入乙醇中,边倒边搅拌,若顺序相反则容易引起液体飞溅,故A不能达到目的;B、容量瓶上的刻度与凹液面的最低处相切,胶头滴管垂直位于容量瓶的正上方,故B能达到目的;C、二氧化氮的密度大于空气,集气瓶中的导气管应长进短出,故C不能达到目的;D、电石中含有硫化物与水反应生成H2S,乙炔中的H2S等杂质也能使溴水褪色,应先通过一个盛碱液的洗气瓶将杂质除去,故D不能达到目的。
3.下列说法中正确的是 ( )
A.60%~70%的甲醛水溶液称为福尔马林,具有防腐杀菌的效果
B.液溴可以加少量水保存在棕色的试剂瓶中
C.苯酚溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液
D.油脂不能使溴水褪色
【解析】选B。35%~40%的甲醛水溶液称为福尔马林,具有防腐杀菌的效果,故A错误;液溴见光、受热易挥发,可以加少量水保存在棕色的试剂瓶中,故B正确;苯酚溶液的腐蚀性很强,如果不马上清洗掉,皮肤很快就会起泡,应马上用有机溶剂清洗,常用的有机溶剂就是乙醇(苯酚在水中的溶解度很小),故C错误;油脂是油和脂肪的统称。从化学成分上来讲油脂都是高级脂肪酸与甘油形成的酯。油脂是烃的衍生物。其中,油是不饱和高级脂肪酸甘油酯,
脂肪是饱和高级脂肪酸甘油酯,所以油脂中的油含有不饱和键,可以使溴水褪色,而脂肪不能使溴水褪色,故D错误。
二、非选择题(本题包括3小题,共32分)
4.(10分)(1)用18 mol·L-1硫酸配制100 mL 1.0 mol·L-1硫酸。若实验仪器有:A.100 mL量筒、B.托盘天平、C.玻璃棒、D.50 mL容量瓶、E.10 mL量筒、F.胶头滴管、G.50 mL 烧杯、H.100 mL容量瓶。实验时选用仪器的先后顺序是 (填写编号)。
(2)下列实验操作或对实验事实的叙述正确的是 (填序号)。
①用稀硝酸清洗做过银镜反应实验的试管
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加到浓硝酸中,并不断搅拌
③用碱式滴定管量取20.00 mL 0.100 0 mol·L-1的KMnO4溶液
④用托盘天平称取10.50 g干燥的NaCl固体
⑤实验台上的酒精灯不慎碰翻起火,立即用湿抹布扑灭
⑥用瓷坩埚高温熔融NaOH和Na2CO3的固体混合物
⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
⑧配制Al2(SO4)3溶液时,加入少量的稀硫酸
【解析】(1)配制1 mol·L-1的稀硫酸100 mL,需要浓硫酸的体积为V==0.005 6 L=5.6 mL,应选择10 mL量筒,因配制一定物质的量浓度的溶液需要量取、稀释、移液、洗涤、定容、摇匀等操作,所以正确顺序为EFGCHF。
(2)由于稀硝酸能够与银反应,所以用稀硝酸清洗做过银镜反应实验的试管,故①正确;类比稀释浓硫酸的方法,
浓硝酸和浓硫酸混合的方法为将浓硫酸沿器壁慢慢加到浓硝酸中,并不断搅拌,故②正确;高锰酸钾溶液具有强氧化性,能够氧化碱式滴定管的橡胶管,应该使用酸式滴定管量取高锰酸钾溶液,不能用碱式滴定管量取20.00 mL 0.100 0 mol·L-1的KMnO4溶液,故③错误;托盘天平的准确度为0.1 g,不能用托盘天平称取10.50 g干燥的NaCl固体,故④错误;酒精灯碰翻起火,应立即用湿抹布盖灭,故⑤正确;陶瓷中含有二氧化硅,二氧化硅能够与碳酸钠、氢氧化钠高温下反应,所以不能用瓷坩埚高温熔融NaOH和Na2CO3的固体混合物,故⑥错误;向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,生成的是氢氧化铁沉淀,不是氢氧化铁胶体,制取氢氧化铁胶体方法应该是将饱和氯化铁溶液加入沸水中,故⑦错误;配制Al2(SO4)3溶液时,铝离子能够发生水解,所以加入少量的稀硫酸,抑制铝离子的水解,故⑧正确。
答案:(1)EFGCHF (2)①②⑤⑧
5.(10分)氮氧化物(NOx)是大气污染物之一。工业上在一定的温度和催化剂条件下,可用NH3来消除NOx的污染,生成两种对环境无害的物质。
(1)请写出NH3与NO2反应的化学方程式 。
(2)①写出实验室中由固体物质制取氨气的化学方程式 ;
②欲收集一瓶干燥的氨气,选择下图中的装置,其连接顺序为发生装置→ (按气流方向,用小写字母表示)。
【解析】(1)由已知一定的温度和催化剂条件下,可用NH3来消除NOx的污染,生成两种对环境无害的物质,则NH3与NO2的反应的化学方程式为6NO2+8NH37N2+12H2O;
(2)①实验室中由固体物质制取氨气的原料为Ca(OH)2和NH4Cl,在加热的条件下发生反应,生成氨气、氯化钙和水,其反应的化学方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;
②A为发生装置,制得的氨气携带水蒸气,通过碱石灰进行干燥,气流方向为a→d→c,用装置D收集氨气,因氨气密度比空气小,所以按f进气,e出气方向连接,为了处理多余的氨气,需要用装置F进行处理,因氨气极易溶于水,所以要采用防倒吸装置,连接装置F 中的i,其顺序为发生装置→d→c→f→e→i 。
答案:(1)6NO2+8NH37N2+12H2O
(2)①2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O ②d→c→f→e→i
6.(12分)水蒸气通过灼热的焦炭后,出来气体的主要成分是CO和H2,还有CO2和水蒸气等。请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气体中有CO和H2。(加热装置和导管等在图中略去)。
回答下列问题:
(1)盛浓硫酸的装置作用是 ,
盛NaOH溶液的装置作用是 。
(2)B中加入的试剂是 ,发生反应的化学方程式是 。
(3)C中加入试剂是 ,其目的是 。
(4)按气流方向连接各仪器,用字母表示接口的连接顺序:g—ab— 。
【解析】(1)浓硫酸用于除去水蒸气,干燥气体;NaOH溶液用于除去CO2气体,防止干扰后续实验。(2)硬质玻璃管中加入氧化铜,氧化还原性气体H2和CO。(3)干燥管中加入无水硫酸铜,用于检验生成的水蒸气。(4)仪器连接顺序为水蒸气发生装置——与焦炭反应生成H2和CO——NaOH溶液吸收CO2——浓硫酸干燥——还原性气体还原氧化铜——无水硫酸铜检验产物水——澄清石灰水检验产物CO2
答案:(1)除去水蒸气 除去CO2
(2)氧化铜 CuO+H2Cu+H2O、CuO+COCu+CO2
(3)无水硫酸铜 检验H2O
(4)k j—h i—c d(或d c)—f e—l m
【加固训练】
1.玻璃棒是中学化学实验中常用的仪器,下列实验过程中,一般不需要用玻璃棒的是 (填写编号)
①用湿润的红色石蕊试纸检验氨气;
②将蒸发结晶所得NaCl固体从蒸发皿中转移至称量纸上进行称量;
③探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化;
④用蒸馏法分离两种沸点差距较大的液体;
⑤过滤分离互不相溶的固体和液体;
⑥用已知浓度的盐酸滴待测浓度的NaOH溶液的酸碱中和滴定过程;
⑦稀释浓硫酸的过程。
【解析】将湿润的红色石蕊试纸沾在玻璃棒一端,靠近待测气体,即可检验氨气,故①需要;蒸发皿中的NaCl用玻璃棒刮下,转移到称量纸上进行称量,故②需要;探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化,用玻璃棒搅拌两固体的混合物,需要使用玻璃棒,故③需要;蒸馏需要使用温度计测量温度,蒸馏操作中不需要使用玻璃棒,故④不需要;过滤操作中需要使用玻璃棒引流,避免液体流到漏斗以外,故⑤需要;酸碱中和滴定中不需要使用玻璃棒,故⑥不需要;稀释浓硫酸的过程中,需要使用玻璃棒搅拌,加速稀释过程,故⑦需要。
答案:④⑥
2.熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求。试回答以下问题:
(1)在仪器:a.分液漏斗 b.试剂瓶 c.集气瓶 d.滴定管 e.容量瓶 f.量筒 g.托盘天平中,标有“0”刻度的是(填序号) 。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,在下列仪器中,没有用到“磨砂”工艺处理的有(填序号) 。
a.试管 b.分液漏斗 c.带滴管的试剂瓶(滴瓶) d.集气瓶 e.酸式滴定管 f.碱式滴定管
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体.可供选择的液体试剂有浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液,请回答下列问题:
①若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为 ,制取该气体利用了B的性质有 、 。
②通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满,若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为 ;
③若在乙中收集氨气,气体流经装置的顺序是:a→ → →d(填接口代号)。
【解析】(1)标有“0”刻度的仪器有滴定管、托盘天平;
(2)凡是玻璃连接处,不能漏水漏气的要磨砂处理,用到“磨砂”工艺处理的玻璃仪器有分液漏斗、细口瓶、广口瓶、滴瓶、集气瓶、酸式滴定管等;
(3)①酸或酸性物质可使紫色石蕊溶液变红,丙中的石蕊溶液变红,所以制取的是氯化氢气体,可以用浓硫酸滴入浓盐酸中来制取,浓硫酸具有吸水性、溶于水放出大量的热的性质特点;氨气显碱性,能使石蕊溶液变蓝,可以将浓氨水滴加到NaOH或CaO或碱石灰中来制取;
②氨气密度比空气的小,收集氨气时导气管要短进长出。
答案:(1)dg (2)af
(3)①浓盐酸 吸水性 溶于水放出大量热
②NaOH或CaO或碱石灰 ③c b