- 341.00 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
福建省莆田第九中学2017-2018学年高二上学期期中考试
化学试题
可能用到的相对原子质量:H 1 K 39 Al 27 S 32 O 16 Fe 56 Na 23 Cl 35.5
一、选择题(每小题只有一个选项符合题意,每小题2分,共40分)
1.朱自清先生在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影…”月光穿过薄雾所形成的种种美景的本质原因.是...
( )
A.空气中的小水滴颗粒大小约为10﹣9m~10﹣7m B.光是一种胶体
C.雾是一种胶体 D.发生丁达尔效应
2.用如图所示装置进行下列实验,实验结果与预测的现象不一致.的是 ( )..
①中的物质
②中的物质
预测①的现象
A
酚酞溶液
浓盐酸
无明显变化
B
饱和的KNO3溶液
浓硫酸
无明显变化
C
AlCl3溶液
浓氨水
有白色沉淀
D
湿润红纸条
饱和氯水
红纸条褪色
3.已知 R2+核内共有 N 个中子,R 的质量数为 A,则 m g R2+ 中含有电子的物质的为
( )
A. m(A - N) mol
A
C.m(A - N - 2) mol
A
B.m(A - N + 2) mol
A
D.m(A + N - 2) mol
A
4.配制一定物质的量浓渡NaOH 溶液时,使所配制溶液浓度偏小的操作是( )
①将NaOH固体放在纸上称量,再转移到烧杯中溶解
②烧杯中NaOH溶液移入容量瓶后没有洗涤烧杯
③实验用的容量瓶洗净后末干燥,里面含有少量水
④读取容量瓶液面时采用俯视.
A.①② B.③④ C.①③ D.②④
5.反应C(s)+H2O(g)⇌ CO(g)+H2(g)在一密闭容器中进行,下列条件的改变对其反应速率
几乎无影响的是 ( )
A.保持体积不变,充入水蒸气使体系压强增大 B.将容器体积缩小一倍
C.增加C的量 D.加入催化剂
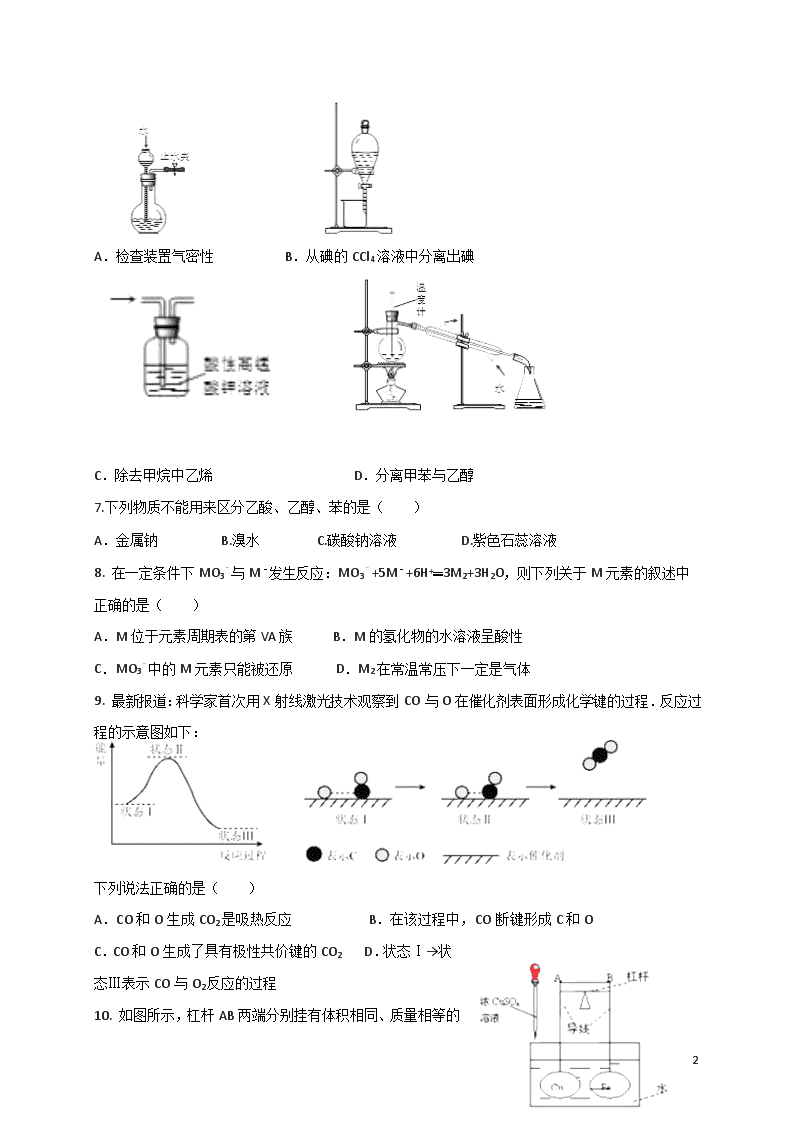
6.下列装置或操作能达到实验目的是( )
1
A.检查装置气密性 B.从碘的CCl4溶液中分离出碘
C.除去甲烷中乙烯 D.分离甲苯与乙醇
7.下列物质不能用来区分乙酸、乙醇、苯的是( )
A.金属钠 B.溴水 C.碳酸钠溶液 D.紫色石蕊溶液
8. 在一定条件下MO3﹣与M﹣发生反应:MO3﹣+5M﹣+6H+═3M2+3H2O,则下列关于M元素的叙述中
正确的是( )
A.M位于元素周期表的第VA族 B.M的氢化物的水溶液呈酸性
C.MO3﹣中的M元素只能被还原 D.M2在常温常压下一定是气体
9. 最新报道:科学家首次用X 射线激光技术观察到CO 与O在催化剂表面形成化学键的过程.反应过程的示意图如下:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应 B.在该过程中,CO 断键形成C和O
C.CO和O生成了具有极性共价键的CO2 D.状态Ⅰ→状
态Ⅲ表示CO与O2反应的过程
10. 如图所示,杠杆AB两端分别挂有体积相同、质量相等的
2
空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,
一段时间后,下列有关杠杆的偏向判断正确的是(实验中,不考虑两球的浮力变化)( )
A.杠杆为导体或绝缘体时,均为A端高B端低
B.杠杆为导体或绝缘体时,均为A端低B端高
C.当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
D.当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A 端低B端高
11.下列①~④是钠与水反应的实验现象、解释和结论,其中对应关系不正确的是
( )
序号
实验现象
解释和结论
A
钠浮在水面上
钠的密度比水小
B
钠熔成小球
钠与水反应放热且钠的熔点低
C
钠四处游动,嘶嘶作响
产生了氢气
D
向反应后的溶液中滴加酚酞,溶液变红
生成了碱性物质
12.下列说法中不正确的是 ( )
A.含有离子键的化合物一定是离子化合物B.活泼的金属和活泼的非金属原子之间形成的化学键一定是离子键
C.共价化合物中不可能存在离子键
D.某元素原子最外层只有1个电子,它跟卤素可能形成离子键也可能形成共价键
13.下列有关碱金属元素的性质判断正确的是 ( )
A.K与H2O反应最剧烈
B.Rb比Na活泼,故Rb可以从Na盐溶液中置换出Na
C.碱金属的阳离子没有还原性,所以有强氧化性
D.从Li到Cs 都易失去最外层1个电子,且失电子能力逐渐增强
14.改变反应物用量,下列反应能用同一个反应方程式表示的是 ( )
①NaAlO2溶液与CO2反应; ②Si与烧碱溶液反应; ③H2S与NaOH 溶液反应;④Fe与稀硝酸反
应; ⑤S在O2中燃烧; ⑥N2与O2的反应.
A.②⑤⑥ B.①②⑤ C.①③④ D.③④⑥
15.已知(NH4)2SO4在高温下分解,产物是SO2、H2O、N2和NH3.有关该反应的下列说法正确的是 ( )
3
A.N2既是氧化产物又是还原产物B.NH4+部分被氧化
C.氧化产物和还原产物的物质的量比为3:1
D.氧化产物和还原产物的物质的量比为1:4
16.A、B、C三种醇同足量的Na反应,在相同条件下产生相等体积的以 ,消耗这三种醇的物质的量之比为3∶6∶2,则A、B、C三种醇分子中羟基数之比为( )
A.3:2:1 B.2:6:3 C.3:1:2 D.2:1:3
17.下列对有机反应类型的描述不正确的是( )
A.乙醇使酸性KMnO4溶液褪色,是因为发生了氧化反应
B.将苯加入溴水中,振荡后水层接近无色,是因为发生了取代反应
C.乙烯使溴的四氯化碳溶液褪色,是因为发生了加成反应
D.甲烷与氯气混合,光照一段时间后黄绿色消失,是因为发生了取代反应
17. 据最新报道,科学家发现了如下反应:O2+PtF6 = O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt 为+5价,对于此反应,下列叙述正确的是( )
A.在此反应中,每生成lmolO2(PtF6),则转移1mol电子
B.在此反应中,O2是氧化剂,PtF6是还原剂
C.O2(PtF6)中氧元素的化合价是+1价 D. O2(PtF6)中仅存在离子键不存在共价键
18. 以下物质间的转化通过一步反应不能实现的是( )
A.HCl→Cl2→HClO→NaClO B.Na→Na2O2→Na2CO3→NaHCO3
C.Si→SiO2→H2SiO3→Na2SiO3 D.Al→NaAlO2→Al(OH)3→Al2O3
19. 将2.4g镁、铝混合物粉末溶于75mL 4mol/L的盐酸中,反应一段时间后,再加入250mL1.5mol/L 的NaOH溶液,待反应完全,此时溶液中除Na+、Cl﹣外,还大量存在的是( )
A.AlO2﹣ B.Al3+,Mg2+ C.Mg2+,AlO2﹣ D.Al3+,Mg2+、H+
4
二、非选择题(共60分)
21.(5分)A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1 个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3; C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族.
(1)E在周期表中的位置 ;B的原子结构示意图 ;
(2)元素的非金属性:C____E(填“>”或“<”),下列各项中,不能说明这一结论的有_____(填字母)。A.E的简单氢化物的水溶液放置在空气中会变浑浊
B.C与E之间形成的化合物中元素的化合价
C.C和E的单质的状态
D.C和E在周期表中的位置
(3)元素C、D、E形成的原子半径大小关系是 (用元素符号表示).
(4)C、D可形成化合物D2C2,D2C2含有的化学键是 ;
(5)由A、C两元素可以组成X、Y 两种化合物,X在一定条件下可以分解成Y,Y的电子式为________。
22.(9分)a、b、c、d代表四种短周期主族元素。已知:a、b、c同周期,且原子序数之和为22;元素 b的最简单氢化物与元素a 的氢化物可化合生成离子化合物M;d是短周期中金属性最强的元素.b的最高和最低化合价的代数和为2。
请回答下列问题:
(1)a、b、c的元素符号依次为____、____、____ 。d在氧气中燃烧产物的电子式为 。
(2) 三种常见离子,在化合物M的水溶液中不能大量存在的是 (填离子符
号)
(3)元素e为a的同主族短周期元素,e的单质可与水反应,写出反应的离子方程式:________,(4)c的一种氢化物的相对分子质量为78,是英国科学家法拉第在1825年首先发现的,分子中两
种元素的原子个数比为1:1,该氢化物的分子中有 个原子共平面,写出该氢化物与e的单质
在氯化铁催化作用下发生取代反应的化学方程式:____ 。
5
23.(11分)据图回答下列问题:
Ⅰ、(1)若烧杯中溶液为稀硫酸,则观察到的现象是 。
负极反应式为:______________________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg 或Al),总反应化学方程式为____________________________________。
Ⅱ、由Al、Cu、浓硝酸组成原电池,其正极的电极反应式为 。
Ⅲ、中国科学院长春应用化学研究所在甲醇燃料电池技
术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。
(1)该电池工作时,b通入的物质为_______, c通入的物质为______。
(2)该电池负极的电极反应式为:_______ 。
(3)工作一段时间后,当12.8 g甲醇完全反应生成CO2时,有_______NA个电子转移。
24.(7分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min)
1
2
3
4
5
氢气体积(mL)
50【来源:全,品…中&高*考+网】
120
232
290
310
(1)哪一时间段(指①0~1、②1~2、③2~3、④3~4、⑤4~5 min,下同)反应速率最大(填序
号,下同) ,原因是 。
(2)哪一段时段的反应速率最小 ,原因是 。【来源:全,品…中&高*考+网】(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,不要求写出计
算过程) 。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号)
6
25.(13分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式:________________________________________。
(2)装置A中的烧瓶内固体可选用_________(选填以下选项的代号)。
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:
B ,D_____________,E 。(均填编号)
(4) 通入C装置的两根导管左边较长、右边较短,目的是__ 。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应
的化学方程式:___ ;其中氧化剂与还原剂的物质的量之比为 ;
当a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗数常数为 mol-1(用含a、b的
代数式表示);
(6)从装置C的出气管口处逸出的尾气可能含有污染环境的气体,如何处理?
26.(15分) 如图是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色.
7
(1)若F是由Na+和SO42﹣组成的溶液,则甲的化学式是 ,列举A物质的一种用
途 .
(2)若D是能使澄清石灰水变浑浊的气体,则乙的化学式为 ,丁属于单质、酸、碱中
的 ;在I溶液中加入氢氧化钠溶液,可以观察到的现象是 ,对应的离子方
程式和化学方程式依次是 .
(3)写出G→A+C的化学方程式: .
(4)写出E和C反应的方程式并用单线桥法标明电子的转移方向和数目: .
(5)若A中混有杂质Al2O3,除去杂质的方法是加入过量的 ,该反应的离子方程式
为 .
(6)由E和A组成的混合物与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+
与H2的物质的量之比为4:1.则反应物中A、E、H2SO4的物质的量之比为 .
高二期中考试化学试题答案
一、选择题
ABCAC ABBCC CBDAB DBACA
二、非选择题
21. 1) 第三周期第ⅥA族 ; ;(2)__>__,__C__
(3) Na>S>O .(4) 离子键、共价键 ;(5)___ ___(每空1分)
22.(1)F;N;C; ;(2)OH-;(3)Cl2+H2O=H++Cl-+HClO;(4)12;
(最后一空2分,其余每空1分)
23.Ⅰ:(1)Mg逐渐溶解;Al片上有气泡冒出;指针偏转(2分,答案不全扣1分)
Mg-2e-=Mg2+(1分) (2)Al(1分); 2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2分)
II. NO3-+e-+2H+=NO2+H2O(1分)
III.(1)CH3OH (1分) O2或空气(1分)
(2)CH3OH-6e-+H2O=CO2+6H+ (1分) (3)2.4(1分)
24.(1)③ (1分),
因该反应是放热反应,2~3 min时温度高。(1分)
(2)⑤(1分),因为4~5 min时H+ 浓度小。(1分)
(3)0.1 mol/(L•min)(1分) (4) A、B (2分)
25. (1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O(2分) (2)A、B、E(2分)(3)Ⅰ,Ⅱ,
Ⅲ(各1分) (4) 使密度较大的Cl2和密度较小的NH3较快地混合均匀(1分)
(5) 3Cl2+8NH3=N2+6NH4Cl(2分); 3:2(1分) ;b/2a(1分)
(6) 在G连接导管,直接把尾气通往盛有NaOH溶液的烧杯中(1分)
26.(1)H2SO4;用作红色油漆和涂料;(每空1分)(2)CO;酸;生成白色沉淀,迅速变为灰绿色,最终变为红褐色;Fe2++2OH﹣=Fe(OH)2↓;4Fe(OH)2+O2+2H2O=4Fe(OH)3;(每空1分)(3)
2Fe(OH)3 Fe2O3+3H2O(1分);(4) (2分:方程式1分,单
线桥1分)(5)NaOH溶液(1分);Al2O3+2OH﹣=2AlO2﹣+H2O(2分);(6)1:2:4(2分)