- 694.91 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020届高三模拟猜题卷(全国Ⅰ卷) 化学部分
【满分:100分】
可能用到的相对原子质量:H—1 Li—7 C—12 N—14 O—16 Zn—65 Se—79
7.化学与生活、生命密切相关,下列叙述正确的是( )
A.氨基酸是由天然蛋白质水解得到的,既可以和酸反应,又可以和碱反 应,也可以和甘氨酸反应形成肽键
B.医用酒精浓度越大消毒效果越好,是因为浓度大的酒精使细菌的蛋白质发生变性的速率更快
C.新型材料聚酯纤维、人造纤维、合成纤维属于有机高分子材料,光导纤维、汽车的挡风玻璃(钢 化玻璃)属于无机非金属材料
D.装修材料会散发有毒气体甲醛,甲醛具有强还原性,所以用于制备酚醛树脂
8.设阿伏加德罗常数的值,下列说法中不正确的是( )
A. 1.9 g离子化合物中阴离子所含的电子数为
B. 0. 5 mol烷烃分子中所含非极性键数为
C. 氯碱工业中阳极产生2.24L(标准状况下)时,通过阳离子交换膜的离子数目为
D. 将1 L溶液与氨水等体积混合至溶液呈中性,则溶液中
数目为 (忽略混合过程中溶液体积的变化)
9.已知紫苏醇()具有逆转已形成肿瘤的特殊功能。下列说法错误的是( )
A.与按分子数目比1︰1加成可得到四种同分异构体(不含立体异构)
B.分子中至少有6个碳原子一定共平面
C.可用于合成高分子化合物
D.与HCl作用生成的反应是取代反应
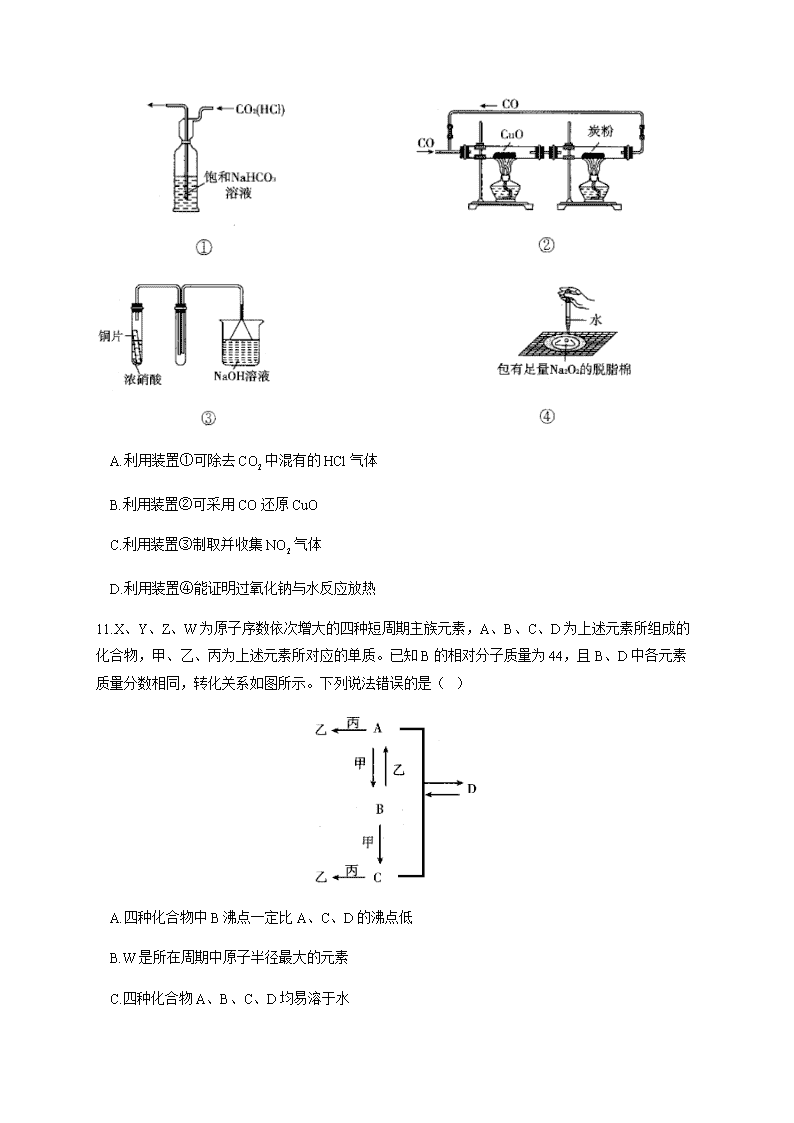
10.下列装置及实验设计中合理的是( )
A.利用装置①可除去中混有的HCl气体
B.利用装置②可采用CO还原CuO
C.利用装置③制取并收集气体
D.利用装置④能证明过氧化钠与水反应放热
11.X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D为上述元素所组成的化合物,甲、乙、丙为上述元素所对应的单质。已知B的相对分子质量为44,且B、D中各元素质量分数相同,转化关系如图所示。下列说法错误的是( )
A.四种化合物中B沸点一定比A、C、D的沸点低
B.W是所在周期中原子半径最大的元素
C.四种化合物A、B、C、D均易溶于水
D.X、Z可组成含有非极性共价键的极性分子
12.以柏林绿为代表的新型可充电钠离子电池,其放电原理如图所示。下列说法正确的是( )
A.放电时,Mo箔上的电子流向Mg箔
B.充电时,左室中的浓度增大
C.充电时,阴极上发生反应
D.放电时,外电路中通过0.2 mol电子时,右室电解质的质量增加2.4 g
13.常温下,向醋酸溶液中逐滴加入NaOH溶液,溶液pH随的变化如图所示。下列说法错误的是( )
A.常温下,约为
B.a点到b点的过程中,溶液的导电能力增强
C.c点:
D.从b点到d点,水的电离程度逐渐减小
26.(14分)除去燃煤气中的有毒气体,一直是重要的科研课题。某科研小组设计如图1装置模拟工业脱硫脱氮,探究和NO同时氧化的吸收效果。模拟烟气由(90.02%)、(4.99%)、NO(4.99%)混合而成,各气体的流量分别由流量计控制,调节三路气体相应的流量比例,充分混合后进入A。已知:
(1)洗气瓶A出气管口有两个玻璃球泡,其作用是_________ ___________。
(2)反应前装置中需要先通入一段时间,目的是_______ _______,其操作方法是_____ ___________。
(3)实验中A瓶出现黑色沉淀,写出A瓶中脱硫反应的离子方程式_______________,继续实验,发现B瓶溶液颜色不变,C瓶溶液出现棕色,这些现象说明___________________。
(4)关闭活塞e,打开活塞d,在其出气管口,用NO检测仪研究A在不同温度时的脱氮率,实验结果如图2所示,分析图中信息,得出的结论是____________________。在55 ℃ 之前,脱氮率随温度升高而变化的原因可能是__________________________。
27. (14分)硫酸锰晶体是一种重要的化工原料,利用软锰矿(主要成分为)和黄铜矿(主要成分为)可以制取,其化工生产流程如下:
已知:①、、;
②加热到280 ℃时,得到无水。
(1)将矿石混合研磨成细粉的目的是 ,“酸浸”过程中得到滤渣1为单质硫,滤液中含有,写出“酸浸”发生反应的离子方程式: 。
(2)氧化的目的是将酸性滤液中可能含有的转化为,则试剂X可能为 (填化学式)。检验滤液1中常用的试剂为 。
(3)滤渣2的成分为 (填化学式),为了得到较为纯净的,使用碱液调节pH的范围为 。(lg2 = 0. 3)(已知:①滤液2中的浓度为;②当离子浓度小于时,即可认为该离子已除净)
(4)浓缩、结晶过程中需要控制温度,不宜温度过高的原因是 。
28.(15分)近年科学家提出“绿色自由”构想。把含有大量的空气吹入溶液中,再把从溶液中提取出来,并使之与反应生成可再生能源甲醇。其工艺流程如图1所示:
(1)分解池中主要物质是 (填化学式)。
(2)在合成塔中,若有4400 g与足量反应,生成气态的和甲醇,可放出5370 kJ的热量该反应的热化学方程式为 。
(3)该工艺体现了“绿色自由”构想的“绿色”理念的方面有 (写出两条)。
(4)一定条件下,向2 L恒容密闭容器中充入1 mol和3 mol,在不同催化剂作用下发生上述反应,相同时间内的转化率随温度变化如图2所示:
①催化效果最佳的催化剂是 (填“催化剂Ⅰ”“催化剂Ⅱ”或“催化剂Ⅲ”)。
②b 点v(正) v(逆)(填“ > ”“<”或“=”)。
③若此反应在a点时已达到平衡状态,a点转化率比c点高的原因是 。
④c点时,该反应的平衡常数= 。
35.化学对人类文明及社会发展做出了巨大贡献,科学家从微观领域研究各种物质的结构与性质,以保障人类生活与社会发展的需要。回答下列问题:
(1)科学家对元素Se、Ga、As及其化合物研究发现它们都可以作半导体材料,如透明色半导体ZnSe、新型半导体GaAs。
①Se、Ga、As的第一电离能由大到小的顺序为_______________;基态Ga原子的电子排布式为______________________。
②As、Se的化合物有、、等,其中属于非极性分子的是______________,分子的中心原子的杂化轨道类型是______________,分子的空间构型是_____________。
(2)ZnSe的立方晶胞结构如下图所示,则m克该晶体中含有的晶胞个数为______________(列式表示,为阿伏加德罗常数)。
(3)是锂电池正极材料的活性物质,硫酸铜、磷酸钠与氨是合成该物质的原料:
①在硫酸铜溶液中加入过量KCN,生成配合物,则1 mol中含有的σ键与π键数目之比为_____________。
②与互为等电子体的分子、离子分别有______________、______________(各举一例)。
36.扎来普隆是一种短期治疗失眠症的药物,其合成路线如图所示:
回答下列问题:
(1)A中的官能团名称是 。
(2)B→C、E→F的反应类型依次为 、 。
(3)扎来普隆的分子式为 。
(4)C→D的化学方程式为 。
(5)不同条件对反应B→C产率的影响见下表:
实验
酸
溶剂
还原剂
产率/%
1
50%乙醇
Fe
31.4
2
50%乙醇
Fe
29.8
3
HCl
50%乙醇
Sn
25.6
4
HCl
50%乙醇
Zn
27.8
5
HCl
50%乙醇
Fe
45.7
上述实验探究了 和 对产率的影响。此外,还可以进一步探究 等对产率的影响。
(6)属于芳香族化合物,且含有硝基、能发生银镜反应、核磁共振氢谱有4组吸收峰的B的同分异构体的结构简式为 。
(7)已知:有碱性且易被氧化。设计由 和乙醇制备的合成路线(无机试剂任选) 。
答案以及解析
7.答案:C
解析:天然蛋白质水解产物都是α-氨基酸,该物质为,A项错误;酒精浓度过大,细菌表面蛋白质发生变性对内部起到保护作用,消毒效果更差,B项错误;钢化玻璃(主要成分是硅酸盐)、光导纤维 (主要成分是二氧化硅)属于无机非金属材料,C项正确;甲醛发生缩聚反应和还原性无关,D项错误。
8.答案:A
解析:离子化合物的化学式为,其中阳离子为、阴离子为,因此在0.1mol中含数目为,而每个中含2个电子,因此阴离子中所含的电子数为,A选项错误;在饱和烷烃任意一种同分异构体中均含有4个C—C单键,因此在0. 5 mol中含有2 molC-C单键,因此非极性键数目为,B选项正确;在标准状况下,生成0. 1 mol,同时转移 0.2 mol,所以溶液中会有0.2 mol通过阳离子交换膜,C选项正确;由混合溶液的电荷守恒可知,,当溶液呈中性时,即
,则,而混合后,则,所以,则溶液中数目为,D选项正确。
9.答案:B
解析:分子中的—OH可连接在四个不饱和碳原子上,A项正确;C—C单键可以自由转动,故该分子中一定共平面的碳原子不是6 个,B项错误;该醇中含有碳碳双键,能发生加聚反应,C项正确;由取代反应含义知,D项正确。
10.答案:D
解析:A项,混合气体应从左边通入,错误;B项,忽略了与C的反应是气体体积增大的反应,整个装置为密闭体系,造成CO气体不能通入,实验不能顺利进行,错误;C项,铜与浓硝酸反应的产物是,其密度比空气的大,因此应利用向上排空气法收集气体,导气管应长进短出,这样才能将装置中的空气排尽,且吸收装置能防止倒吸,错误;D项,脱脂棉燃烧能说明与水反应放热,正确。
11.答案:C
解析:借助B的相对分子质量为44,且B、D中各元素质量分数相同,排除了B为的可能,由转化关系推知:A为乙醇、B为乙醛、C为乙酸、D为乙酸乙酯;X、Y、Z、W分别对应元素为H、C、O、Na。A.四种化合物中,乙醛沸点为20.8 ℃,远低于其他三种物质,正确;B.W是Na,是其所在周期中原子半径最大的元素,正确;C.D为乙酸乙酯不溶于水,错误;D.X 、Z组成的分子可能为极性分子,正确。
12.答案:C
解析:分析题图可知,放电时,Mg箔作负极,Mo箔作正极, Mg箔上的电子流向Mo箔,故A错误;充电时,Mg箔为阴极,在阴极上得到电子生成Mg,左室中的通过阳离子交换膜向Mg箔移动,左室中的浓度减小,B错误,C正确;放电时,右室负极上发生反应,外电路中通过0.2 mol电子时,负极消耗0.1 mol Mg,同时有0.2 mol移入左室,故右室电解质的质量减少4.6 g-2.4 g=2.2 g,D错误。
13.答案:D
解析:A.未滴加NaOH溶液时,溶液的pH = 3,醋酸的电离常数,正确。
B.a点到b点的过程中,弱电解质醋酸转化为强电解质醋酸钠,溶液中总离子浓度增大,故溶液的导电能力增强,正确。
C.c点时与NaOH恰好完全反应生成,根据质子守恒得,正确。
D.b点溶液显中性,溶质为醋酸和醋酸钠,醋酸的电离抑制水的电离,c点酸碱恰好完全反应,产物为醋酸钠,此时水的电离程度最大,d点溶质为醋酸钠和氢氧化钠,和c点相比会抑制水的电离,所以从b点到d点,水的电离程度先增加后减小,错误。
26.答案:(1)消除气泡(1分)
(2)排出装置内的空气(2分);关闭d,打开e、a(2分)
(3)(3分);完全吸收,NO不完全吸收(2分)
(4)随温度升高,脱氮率先升高后降低(2分);温度升高,化学反应速率加快(2分)
解析:(1)鼓泡吸收时,可能有未破裂的气泡进入出气管口堵塞气路,此洗气瓶出气管口有两个玻璃球泡,可增大接触面积,有消除气泡防止堵塞的作用。
(2)与NO常温下即可发生反应,在溶液中也可以与发生反应,为了避免空气中对NO、的吸收或检验产生干扰,实验前应先通入一段时间,排出装置内的空气;实验中需先关闭d,打开e,形成气体通路,再打开a通入氮气。
(3)具有氧化性,可将氧化成,由题知与反应产生黑色沉淀,由元素守恒可知,该沉淀为,即被还原为,结合守恒原则可写出离子方程式;继续实验时,发现B瓶品红溶液颜色不变,说明气体中几乎除尽;C瓶溶液中出现棕色,结合题给信息“(棕色)”知,NO不完全吸收。
(4)由图2可知,脱氧率随温度升高先增大后减小。温度低于55 ℃ 时,随温度升高反应速率加快,脱氮率升高;温度高于55 ℃ 后,可能因温度过高,气体的溶解度降低,NO不能与溶液充分接触,导致反应不充分使脱氮率降低。
27.答案:(1)加快酸浸速率,提高矿石的利用率(2分); (2分)
(2)或 (2分);KSCN(2分)
(3)和(2分);7. 15 ~ 8. 15(2分)
(4)当加热到280 ℃时会失去结晶水,得到无水,所以温度不宜过高(2分)
解析:(1)将矿石研磨成细粉可以增大反应物间的接触面积,从而加快反应速率和提高矿石的利用率。
(2)将转化为且不能引进新的杂质离子,和适合作为氧化剂。
(3)加入碱液的目的是除去和,故滤渣2的成分为和,根据和的可知加入碱液时先沉淀,当除尽时其浓度为,,pH = 7. 15,浓度为,当开始沉淀时,,pH =8. 15,故使用碱液调节pH的范围为7. 15 ~ 8. 15。
28.答案:(1)(2分)
(2)(3分)
(3)减少大气中并产生清洁能源甲醇(1分);可循环使用;能量可以循环利用,低碳经济等(合理即可)(1分)
(4)①催化剂Ⅰ(2分) ②> (2分) ③该反应为放热反应,温度升高,平衡逆向移动(2分)
④(2分)
解析: (1)大量的与饱和溶液反应生成,所以分解池中的溶质主要为。
(2)合成塔中反应温度为300 ℃,生成,则发生的反应为,4400 g的物质的量,l00mol参与反应放出5370 kJ的热量,则1 mol参加反应,放出53.7 kJ的热量,反应的热化学方程式为。
(3)“绿色理念”的含义是从源头上减少或消除工业生产对环境的污染,使能量使用最大化,环境污染最小化。由流程图可知在分解池中分解生成和,溶液可以循环利用,且用合成甲醇,有助于减少大气中的,体现了低碳、环保的理念。
(4)①使用不同的催化剂,相同时 间内,的转化率不同,根据图像分析可知,之间相同时间内,使用催化剂Ⅰ时的转化率大于使用催化剂Ⅱ、催化剂Ⅲ,故催化效果最佳的是催化剂Ⅰ。②由(2)知该反应为放热反应,放热反应未达到平衡时,温度升高,反应速率加快,则相同时间内,反应物转化率增大,至达到平衡时,反应物转化率不再变化。结合图像可知,在催化剂Ⅲ作用下,相同时间内,温度由,的转化率增大,说明b点反应未达到化学平衡,则b点。③催化剂只改变反应速率,不影响平衡移动,a点反应达到平衡,对于放热反应,升高温度,平衡向逆反应方向移动,反应物转化率减小,故a点转化率大于c点转化率。④由③知,C点反应达到平衡状态,的转化率为66.67%(),起始时向2 L恒容密闭容器中充入1 mol和3 mol,则转化的,列三段式得:
起始 0 0
转化 1
平衡
则c点时该反应的化学平衡常数。
35.答案:(1)①As>Se>Ga(2分);或(1分)
②(1分);(1分);三角锥形(1分)
(2)(3分)
(3)①1︰1(2分);②或(1分);或(2分)
解析:(1)①同周期从左至右第一电离能依次递增,由于As位于第VA族,最外层s能级全充满,p能级半充满,为稳定状态,因此As>Se>Ga;Ga处于第四周期第ⅢA族,其电子排布式为或。②分子中砷的价电子均成键,属于完全对称型分子,正负电荷中心完全重合,所以是非极性分子。是三角锥形、是V形不对称结构,二者均属于极性分子。
(2)由ZnSe晶胞结构可知,每个晶胞中含有4个ZnSe,则每个晶胞的质量为,故该晶体含有的晶胞数为。
(3)①在中,一个中含有1个σ键、2个π键,每个和Cu之间有1个σ键,故σ键与π键的数目之比为1︰1。
36.答案:(1)羰基(1分)
(2)还原反应(1分);取代反应(合理即可)(1分)
(3)(2分)
(4)
(5)不同酸(1分);不同还原剂(1分);不同溶剂(1分)(合理即可)
(6)、(4分)
(7)(3分)