- 878.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019~2020学年高三5月质量检测
理科综合 化学部分
考生注意:
1.本试卷分选择题和非选择题两部分。满分300分,考试时间150分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:高考范围。
5.可能用到的相对原子质量:H1 C12 N14 O16 S32 Co59
一、选择题:本题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.苏颂《本草图经》有关不灰木(火浣布)有如下描述:“不灰木,出上党,今泽、潞山中皆有之,盖石类也。其色青白如烂木,烧之不燃,以此得名。或云滑石之根也,出滑石[Mg3(Si4O10)(OH)2]处皆有”。“不灰木”成分可能是
A.纤维素 B.硅酸盐 C.氧化铁 D.动物毛皮
8.化合物(a)与(b)的结构简式如图所示。下列叙述正确的是
A.(a)与(b)互为同分异构体 B.(a)分子中所有碳原子均共面
C.(b)的一氯取代物共有3种 D.(a)与(b)均能使Br2/CCl4褪色
9.设NA为阿伏加德罗常数的值。下列说法正确的是:
A.标准状况下,2.24 L三氯甲烷中含氢原子数为0.1NA
B.0.1 mol·L-1 Na2SO3溶液中,含硫元素的粒子数目之和为0.1NA
C.8.0 g NH4NO3发生反应5NH4NO3=4N2+2HNO3+9H2O,转移电子数为0.3NA
D.O.1 mol P35Cl2与足量37Cl2发生反应:PCl3+Cl2PCl5,产物中P-37Cl键数为0.2NA
10.硼烯是继石墨烯之后又一种“神奇纳米材料”
,具有优良的导电、导热性能。科学家已成功合成多种结构的硼烯,如图为“皱褶”式硼烯的结构,下列说法正确的是
A.“皱褶”式硼烯中含B、H两种元素
B.“皱褶”式硼烯中硼原子达到8电子稳定结构
C.硼的最高价氧化物对应水化物的酸性比碳酸的强
D.硼烯有望代替石墨烯作锂离子电池的电极材料
11.等体积两种一元酸“酸1”和“酸2”分别用等浓度的KOH溶液滴定,滴定曲线如图所示。下列说法错误的是
A.“酸1”比“酸2”的酸性强 B.“酸2”的浓度为0.01 mol·L-1
C.“酸2”的Ka的数量级约为10-5 D.滴定“酸1”和“酸2”均可用酚酞作指示剂
12.某新型离子电池电解质的化学组成为W5.7XY4.7Z1.3(各元素的化合价均为最高正价或最低负价),已知W、X、Y、Z为原子序数依次增大的短周期主族元素,X、Y、Z位于同周期,W原子的核外电子总数与Y原子的最外层电子数之和等于9,Y的最高正价与最低负价代数和为4。下列说法错误的是
A.常见单质的沸点:Y>Z B.W的单质能与冷水反应
C.X与Z原子序数之和是Y核电荷数的2倍 D.W、X、Y、Z的简单离子均能促进水的电离
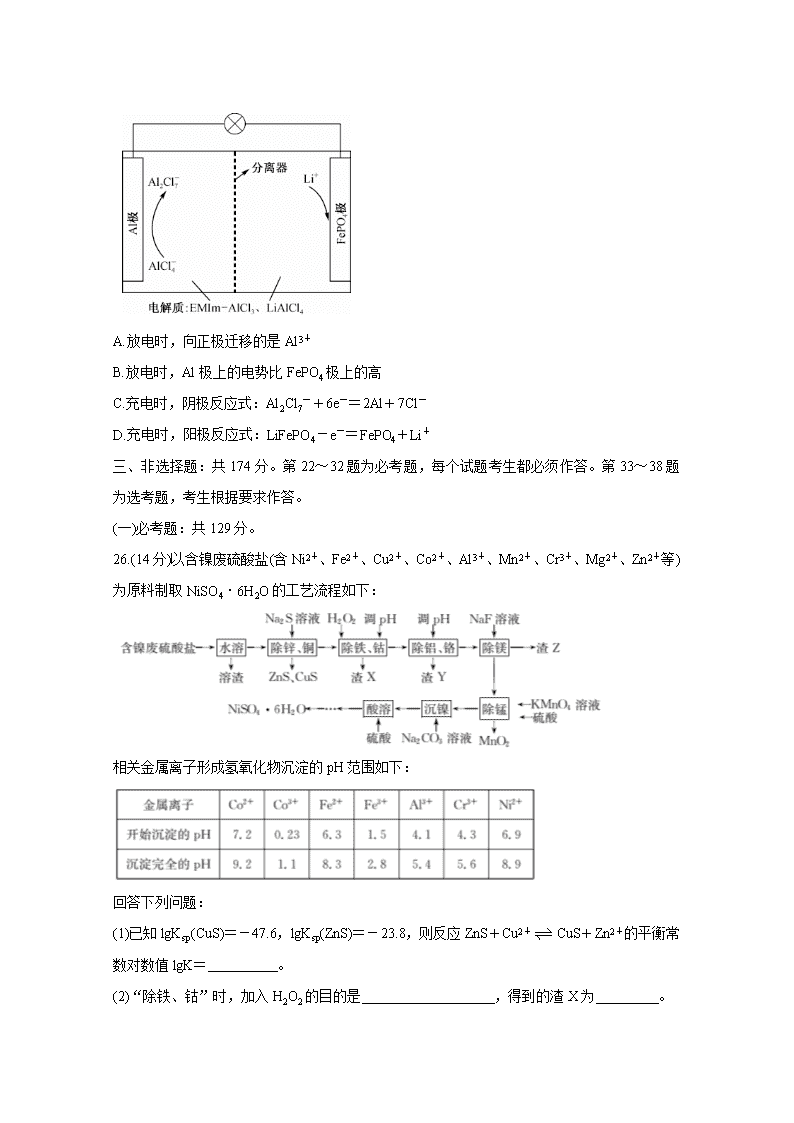
13.一种用离子液体作电解液的混合动力电池放电原理图如图所示,已知充放电时的电池反应为4LiAl2Cl7+3LiFePO4(s)Al+3FePO4+7LiAlCl4。下列说法正确的是
A.放电时,向正极迁移的是Al3+
B.放电时,Al极上的电势比FePO4极上的高
C.充电时,阴极反应式:Al2Cl7-+6e-=2Al+7Cl-
D.充电时,阳极反应式:LiFePO4-e-=FePO4+Li+
三、非选择题:共174分。第22~32题为必考题,每个试题考生都必须作答。第33~38题为选考题,考生根据要求作答。
(一)必考题:共129分。
26.(14分)以含镍废硫酸盐(含Ni2+、Fe2+、Cu2+、Co2+、Al3+、Mn2+、Cr3+、Mg2+、Zn2+等)为原料制取NiSO4·6H2O的工艺流程如下:
相关金属离子形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)已知lgKsp(CuS)=-47.6,lgKsp(ZnS)=-23.8,则反应ZnS+Cu2+CuS+Zn2+的平衡常数对数值lgK= 。
(2)“除铁、钴”时,加入H2O2的目的是 ,得到的渣X为 。
(3)“除铝、铬”时,调pH范围为 ;渣Y中含Cr(OH)3,其性质与Al(OH)3类似,写出Cr(OH)3与NaOH反应的化学方程式: 。
(4)“除锰”时,发生反应的离子方程式为 。
(5)“酸溶”得到溶液制备NiSO4·6H2O晶体,还需进行的操作工艺是 。
27.(15分)CS(NH2)2(硫脲,白色而有光泽的晶体,溶于水,20℃时溶解度为13.6 g;在150℃时转变成NH4SCN)是用于制造药物、染料、金属矿物的浮选剂等的原料。某化学实验小组同学用Ca(HS)2与CaCN2(石灰氮)合成硫脲并探究其性质。
(1)制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S):
①使装置a中反应发生的操作为 ;装置b中盛放的试剂是 。
②装置c中的长直导管的作用是 ,三颈烧瓶中通人CO2不能过量,原因是 。
(2)制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见的碱。合适的加热方式是 ;该反应的化学方程式为 。
(3)探究硫脲的性质:
①取少量硫脲溶于水并加热,验证有NH4SCN生成,可用的试剂是 (填化学式,下同)。
②向盛有少量硫脲的试管中加入NaOH溶液,有NH3放出,检验该气体的方法为 。
③可用酸性KMnO4溶液滴定硫脲,已知MnO4-被还原为Mn2+,CS(NH2)2被氧化为CO2、N2及SO42-,该反应中氧化剂与还原剂的物质的量之比为 。
28.(14分)热化学碘硫循环可用于大规模制氢气,HI分解和SO2水溶液还原I2均是其中的主要反应。回答下列问题:
(1)碘硫热化学循环中,SO2的水溶液还原I2的反应包括:SO2+I2+2H2O3H++HSO4-+2I
-、I-+I2I3-。若起始时n(I2)=n(SO2)=1 mol,I-、I3-、H+、HSO4-的物质的量随的变化如图所示:
图中表示的微粒:a为 ,d为 。
(2)起始时HI的物质的量为1 mol,总压强为0.1MPa下,发生反应HI(g)H2(g)+I2(g)。平衡时各物质的物质的量随温度变化如图所示:
①该反应的△H (填“>”或“<”)0。
②600℃时,平衡分压p(I2)= MPa,反应的平衡常数Kp= (Kp为以分压表示的平衡常数)。
(3)反应H2(g)+I2(g)2HI(g)的反应机理如下:
第一步I22I(快速平衡)
第二步I+H2H2I(快速平衡)
第三步H2I+I2HI(慢反应)
①第一步反应 (填“放出”或“吸收”)能量。
②只需一步完成的反应称为基元反应,基元反应如aA+dD=gG+hH的速率方程,v=kca(A)·cd(D),k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。H2(g)与I2(g)反应生成HI(g)的速率方程为v= (用含k1、k-1、k2…的代数式表示)。
(二)选考题:共45分。请考生从2道物理题、2道化学题、2道生物题中每科任选一题作答。如果多做,则每学科按所做的第一题计分。
35.[化学——选修3:物质结构与性质](15分)
iCo2S4g-C3N4-CNT是一类很有发展前途的化合物电催化剂。回答下列问题:
(1)基态Co2+的价层电子排布图(轨道表达式)为 ;基态S原子电子占据最高能级的电子云轮廓图为 形。
(2)g-C3N4(结构片段如图1,环上化学键与苯环类似)可由三聚氰胺()与(NH4)2SO4共热制得。
①g-C3N4分子中环上的氮原子、碳原子杂化方式依次为 、 。
②SO42-的空间构型为 。
③三聚氰胺分子中含σ键 个,它不溶于冷水,溶于热水,其主要原因是 。
(3)碳纳米管(CNT,结构如图2)具有良好的导电性,其原因是 。
(4)CoS2具有AB2型立方结构(如图3),晶胞参数为553.4 pm。设NA为阿伏加德罗常数的值,则晶体的密度为 g·cm-3(列出计算式)。
36.[化学——选修5:有机化学基础](15分)
孟鲁司特钠可用于抗新型冠状病毒肺炎,其制备中间体G的一种合成路线如下:
已知:
①B、C除苯环外还含有一一个五元环,D的苯环上只有两个取代基;
回答下列问题:
(1)A的化学名称是 。
(2)F中含氧官能团名称是 。
(3)B的结构简式为 。
(4)D生成E同时生成乙酸的化学方程式为 。
(5)E生成F的反应类型是 。
(6)化合物W与G互为同分异构体,能发生水解反应,其核磁共振氢谱有四组峰且峰面积之比为9:9:2:2,则W的结构简式为 (写一种)。
(7)设计以苯甲酸和乙醇为起始原料制备3-苯基3-戊醇()的合成路线: 。(无机试剂及有机溶剂任用)