- 642.66 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020届新课标Ⅱ卷冲刺高考考前预热卷(五)
化学试题卷
考生注意:
1.本卷共100分,考试时间50分钟。
2. 答卷前,考生务必将自己的姓名、考生号、考场号和座位号填写在答题卡上。
3. 不得在本卷上答题,请将答案填写在答题卡指定区域。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 P 31 S 32 Cl 35.5 Cu 64 Zn 65
一、选择题:本大题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.下列关于“化学与健康”的说法不正确的是( )
A.服用铬含量超标的药用胶囊会对人体健康造成危害
B.“血液透析”利用了胶体的性质
C.食用一定量的油脂能促进人体对某些维生素的吸收
D.光化学烟雾不会引起呼吸道疾病
8.实验室可用如图所示的装置实现“路线图”中的部分转化:
甲 乙
下列叙述错误的是( )。
A.铜网表面乙醇发生氧化反应
B.甲、乙烧杯中的水均起冷却作用
C.试管a收集到的液体中至少有两种有机物
D.实验开始后熄灭酒精灯,铜网仍处于红热状态,说明发生的是放热反应
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.34 g H2O2中含有的阴离子数为1NA
B.4.6 g乙醇中含有的C—H键的个数为0.6NA
C.标准状况下,V L水含有的氧原子个数约为
D.1 mol Fe2+与足量的H2O2溶液反应,转移NA个电子
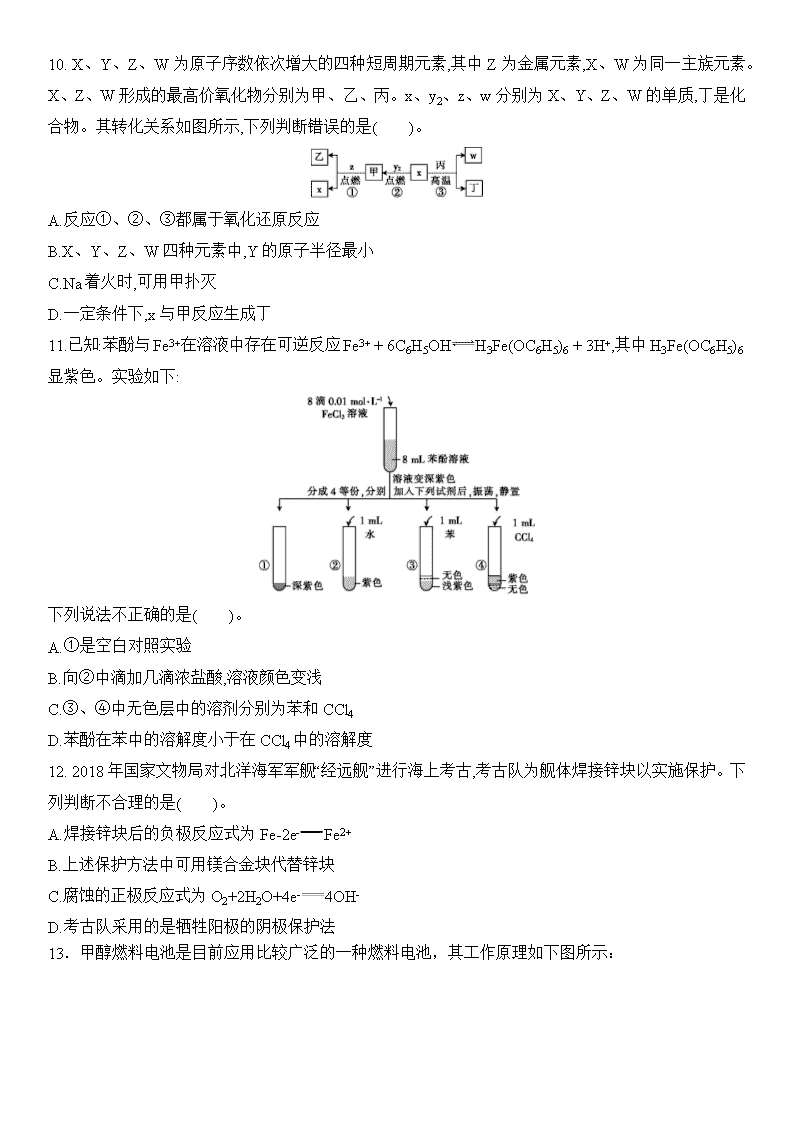
10. X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。其转化关系如图所示,下列判断错误的是( )。
A.反应①、②、③都属于氧化还原反应
B.X、Y、Z、W四种元素中,Y的原子半径最小
C.Na着火时,可用甲扑灭
D.一定条件下,x与甲反应生成丁
11.已知:苯酚与Fe3+在溶液中存在可逆反应Fe3+ + 6C6H5OHH3Fe(OC6H5)6 + 3H+,其中H3Fe(OC6H5)6显紫色。实验如下:
下列说法不正确的是( )。
A.①是空白对照实验
B.向②中滴加几滴浓盐酸,溶液颜色变浅
C.③、④中无色层中的溶剂分别为苯和CCl4
D.苯酚在苯中的溶解度小于在CCl4中的溶解度
12. 2018年国家文物局对北洋海军军舰“经远舰”进行海上考古,考古队为舰体焊接锌块以实施保护。下列判断不合理的是( )。
A.焊接锌块后的负极反应式为Fe-2e-Fe2+
B.上述保护方法中可用镁合金块代替锌块
C.腐蚀的正极反应式为O2+2H2O+4e-4OH-
D.考古队采用的是牺牲阳极的阴极保护法
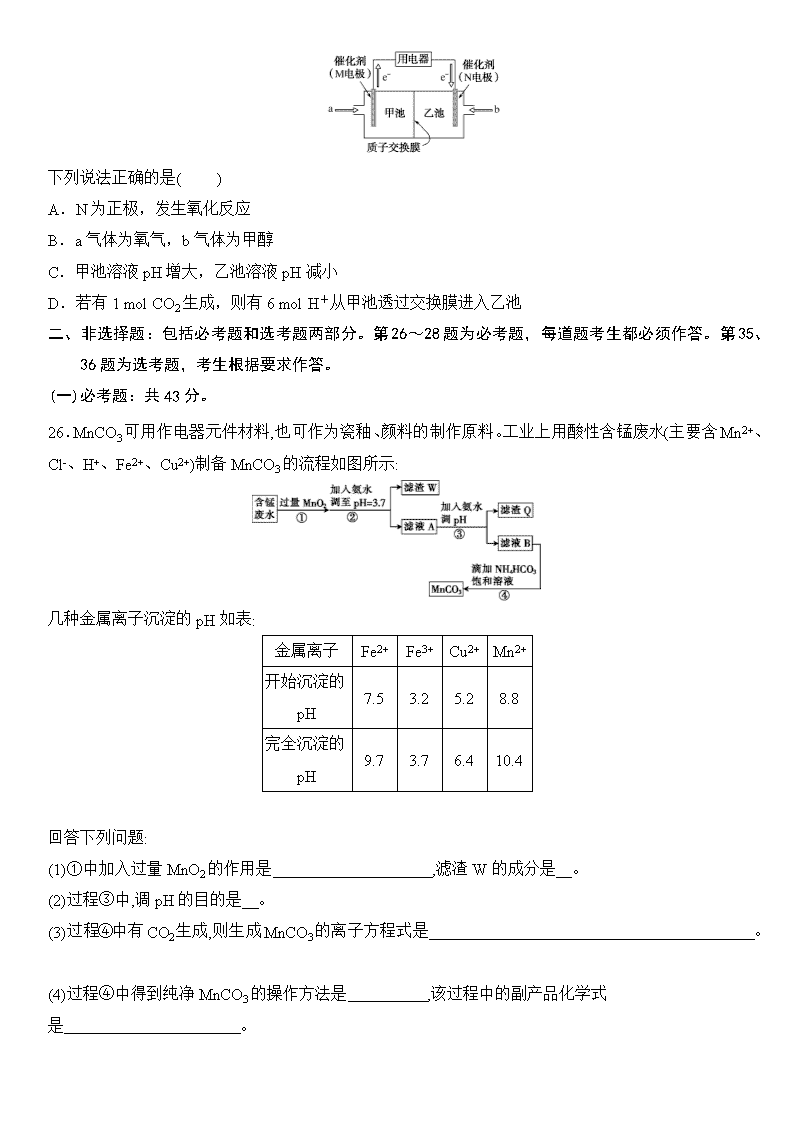
13.甲醇燃料电池是目前应用比较广泛的一种燃料电池,其工作原理如下图所示:
下列说法正确的是( )
A.N为正极,发生氧化反应
B.a气体为氧气,b气体为甲醇
C.甲池溶液pH增大,乙池溶液pH减小
D.若有1 mol CO2生成,则有6 mol H+从甲池透过交换膜进入乙池
二、非选择题:包括必考题和选考题两部分。第26~28题为必考题,每道题考生都必须作答。第35、36题为选考题,考生根据要求作答。
(一)必考题:共43分。
26.MnCO3可用作电器元件材料,也可作为瓷釉、颜料的制作原料。工业上用酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)制备MnCO3的流程如图所示:
几种金属离子沉淀的pH如表:
金属离子
Fe2+
Fe3+
Cu2+
Mn2+
开始沉淀的pH
7.5
3.2
5.2
8.8
完全沉淀的pH
9.7
3.7
6.4
10.4
回答下列问题:
(1)①中加入过量MnO2的作用是 ,滤渣W的成分是 。
(2)过程③中,调pH的目的是 。
(3)过程④中有CO2生成,则生成MnCO3的离子方程式是 。
(4)过程④中得到纯净MnCO3的操作方法是 ,该过程中的副产品化学式是 。
(5)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300 ℃时,剩余固体中n(Mn)∶n(O)为 ;图中点D对应固体的成分为 (填化学式)。
27.某研究小组为探究SO2和Fe(NO3)3溶液反应的实质,设计了如图所示装置进行实验。已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1。
请回答下列问题:
(1)装置A中用于滴加浓硫酸的仪器名称为________。
(2)实验前鼓入N2的目的是
________________________________________________________________________
________________________________________________________________________。
(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO反应。
①若观点1正确,除产生沉淀外,还应观察到的现象是
________________________________________________________________________
________________________________________________________________________。
②按观点2,装置B中反应的离子方程式是
________________________________________________________________________
________________________________________________________________________。
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是________(填字母)。
A.1 mol·L-1稀硝酸
B.1.5 mol·L-1 Fe(NO3)2溶液
C.6.0 mol·L-1 NaNO3溶液和0.2 mol·L-1盐酸等体积混合的溶液
D.3.0 mol·L-1 NaNO3溶液和0.1 mol·L-1硫酸等体积混合的溶液
28.苯乙烯是重要的化工原料。以乙苯(C6H5—CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5—CH===CH2),反应的化学方程式为:C6H5—CH2CH3(g)C6H5—CH===CH2(g)+H2(g) ΔH=+117.6 kJ·mol-1。
回答下列问题:
(1)已知:H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1;
C6H5—CH2CH3(g)+O2(g)===8CO2(g)+5H2O(l) ΔH=-4 607.1 kJ·mol-1。
则C6H5—CH===CH2(g)+10O2(g)===8CO2(g)+4H2O(l) ΔH=________。
(2)工业上,在恒压设备中进行上述反应制取苯乙烯,常在乙苯蒸气中通入大量水蒸气。请用化学平衡理论解释通入大量水蒸气的原因
________________________________________________________________________
________________________________________________________________________。
(3)已知T ℃下,将a mol乙苯蒸气通入到体积为V L的密闭容器中进行上述反应,反应时间与容器内的总压强数据如表:
时间t/min
0
10
20
30
40
总压强p/1 000 kPa
1.0
1.3
1.45
1.5
1.5
①由表中数据计算0~10 min内v(C6H5—CH2CH3)=________________。(用含a、V的式子表示)
②该反应平衡时乙苯的转化率为________。
(4)苯乙烯与溴化氢发生的加成反应产物有两种,其反应的化学方程式如下:
ⅰ.C6H5—CH===CH2(g)+HBr(g)C6H5—CH2CH2Br(g)
ⅱ.C6H5—CH===CH2(g)+HBr(g)C6H5—CHBrCH3(g)
600 ℃时,向3 L恒容密闭容器中充入1.2 mol C6H5—CH===CH2(g)和1.2 mol HBr(g)发生反应,达到平衡时C6H5—CH2CH2Br(g)和C6H5—CHBrCH3(g)的物质的量(n)随时间(t)变化的曲线如图所示。
①600 ℃,反应ⅱ的化学平衡常数Kⅱ=________。
②反应平衡后,若保持其他条件不变,向该容器中再充入1 mol C6H5—CH2CH2Br(g),则反应ⅱ将________(填“正向”、“逆向”或“不”)移动。
③在恒温恒容的密闭容器中,苯乙烯与溴化氢发生ⅰ、ⅱ两个加成反应,可以判断反应已达到平
衡状态的是________。
A.容器内混合气体的密度不再改变
B.C6H5—CH2CH2Br(g)的生成速率与C6H5—CHBrCH3(g)的分解速率相等
C.反应器中压强不再随时间变化而变化
D.混合气体的平均相对分子质量保持不变
(二)选考题:共15分。请考生从给出的2道化学题中任选一题作答。如果多做,则按第一题计分。
35.[化学——选修3:物质结构与性质](15分)
在元素周期表中,除稀有气体元素外几乎所有元素都能与氢形成氢化物。
(1)氨气是共价型氢化物。工业上常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根简写为Ac-)。反应方程式为[Cu(NH3)2]Ac+CO+NH3[Cu(NH3)3CO]Ac。
①请写出基态Cu原子的电子排布式:________________________。
②氨水溶液中各元素原子的第一电离能从大到小的排列顺序为________,理由是
________________________________________________________________________
________________________________________________________________________。
其中NH3应为________分子(填“极性”或“非极性”)。
③醋酸分子中的两个碳原子的杂化方式分别是________。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有________(填序号)。
a.离子键 b.金属键
c.共价键 d.配位键
(2)某离子型氢化物化学式为XY2,晶胞结构如图所示,其中6个Y原子()用阿拉伯数字1~6标注。
①已知1、2、3、4号Y原子在晶胞的上、下面上。则5、6号Y原子均在晶胞________(填“侧面”或“内部”)。
②根据以上信息可以推知,XY2晶体的熔、沸点________(填“>”“=”或“<”)固态氨的沸点。
③若该晶胞的边长为a nm,密度为ρ g·cm-3,XY2的摩尔质量为M g·mol-1,则阿伏加德罗常数可表示为________________________________(用含a、ρ、M的代数式表示)。
36.[化学——选修5:有机化学基础](15分)
化合物F具有独特的生理药理作用,实验室由芳香化合物A制备的一种合成路线如下:
回答下列问题:
(1)A的名称为______,B生成C的反应类型为________。
(2)咖啡酸的结构简式为____________。
(3)F中含氧官能团名称为____________。
(4)写出F与足量NaOH溶液反应的化学方程式
________________________________________________________________________
________________________________________________________________________。
(5)G为香兰素的同分异构体,能使FeCl3溶液变紫色,苯环上只有两个取代基团,能发生水解反应,符合要求的同分异构体有________种,请写出其中核磁共振氢谱图显示有4种不同环境的氢,峰面积比为3:2:2:1的G的结构简式
________________________________________________________________________。
(6)写出以为原料(其他试剂任选)制备肉桂酸()的合成路线。
参考答案
7
8
9
10
11
12
13
D
B
D
C
D
A
D
26 (1)将Fe2+氧化为Fe3+ Fe(OH)3、MnO2
(2)使Cu2+完全转化为Cu(OH)2
(3)Mn2++2HCO3-MnCO3↓+CO2↑+H2O
(4)过滤、洗涤、干燥 NH4Cl
(5)1∶2 Mn3O4和MnO
27.(1)分液漏斗
(2)排净装置中的空气
(3) BaSO4 还原
(4)①静置一段时间后,溶液由棕黄色变为浅绿色
②3SO2+2NO+3Ba2++2H2O===3BaSO4↓+2NO+4H+
③C
28. (1)-4 438.9 kJ·mol-1
(2)该反应是气体分子数增大的可逆反应,恒压条件下通入水蒸气,总压不变,容器体积增大,反应体系分压减小,平衡正移,苯乙烯产量提高
(3)①(0.03 a/V)mol·L-1·min-1 ②50%
(4)①20(或20 L·mol-1) ②正向 ③CD
35.(1)①[Ar]3d104s1或1s22s22p63s23p63d104s1
②N>O>H 同周期元素,从左至右第一电离能呈增大趋势,但第ⅤA族元素的2p能级处于半充满状态,结构稳定,第一电离能反常,大于第ⅥA族元素 极性 ③sp3和sp2 ④acd
(2)①内部 ②> ③
36.(1)4甲基苯酚或对甲基苯酚 取代反应
(2)
(3)酯基、(酚)羟基
(4)
(5)9
(6)