- 107.00 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
四川省成都市第七中学2016-2017学年高二11月考试化学
一、单选题:共7题
1.已知:①2CO(g)+O2(g)2CO2(g) ΔH=-566 kJ/mol;
②Na2O2(s)+CO2(g)Na2CO3(s)+O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.反应①正反应活化能与逆反应活化能之差为+566 kJ/mol
C.反应 2Na2O2(s)+2CO2(s)2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ 热量时,转移电子数为6.02×1023
【答案】C
【解析】本题主要考查反应热的计算。A.燃烧热单位为kJ/mol,所以CO的燃烧热为283 kJ/mol,故A错误。B.反应①正反应活化能与逆反应活化能之差为-566 kJ/mol,故B错误。C. CO2(s)比CO2(g)能量低,所以反应 2Na2O2(s)+2CO2(s)2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol,故C正确。D. CO(g)+ Na2O2(s)Na2CO3(s) ΔH=-509kJ/mol,CO(g)与Na2O2(s)反应放出509 kJ 热量时,转移电子数为2×6.02×1023,故D错误。
2.某温度下,在2 L的密闭容器中,加入1 mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g)3Z(g)平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1mol Z(g),再次达到平衡后,X、Y、 Z的体积分数不变。下列叙述不正确的是
A.m=2 B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1 D.第二次平衡时,Z的浓度为 0.4 mol·L-1
【答案】D
【解析】本题主要考查有关化学平衡移动的计算。A. 在此平衡体系中加入1mol Z(g),相当于加压,再次达到平衡后,X、Y、 Z的体积分数不变,说明平衡不移动,1+m=3,m=2,故A正确。B.温度一定,两次平衡的平衡常数相同,故B正确。C.当反应物的配比等于系
数比时,反应物的转化率相等。故C正确。D.第二次平衡时,气体物质的量为4mol,Z的物质的量为0.4mol,Z的浓度为 0.2mol·L-1,故D不正确。
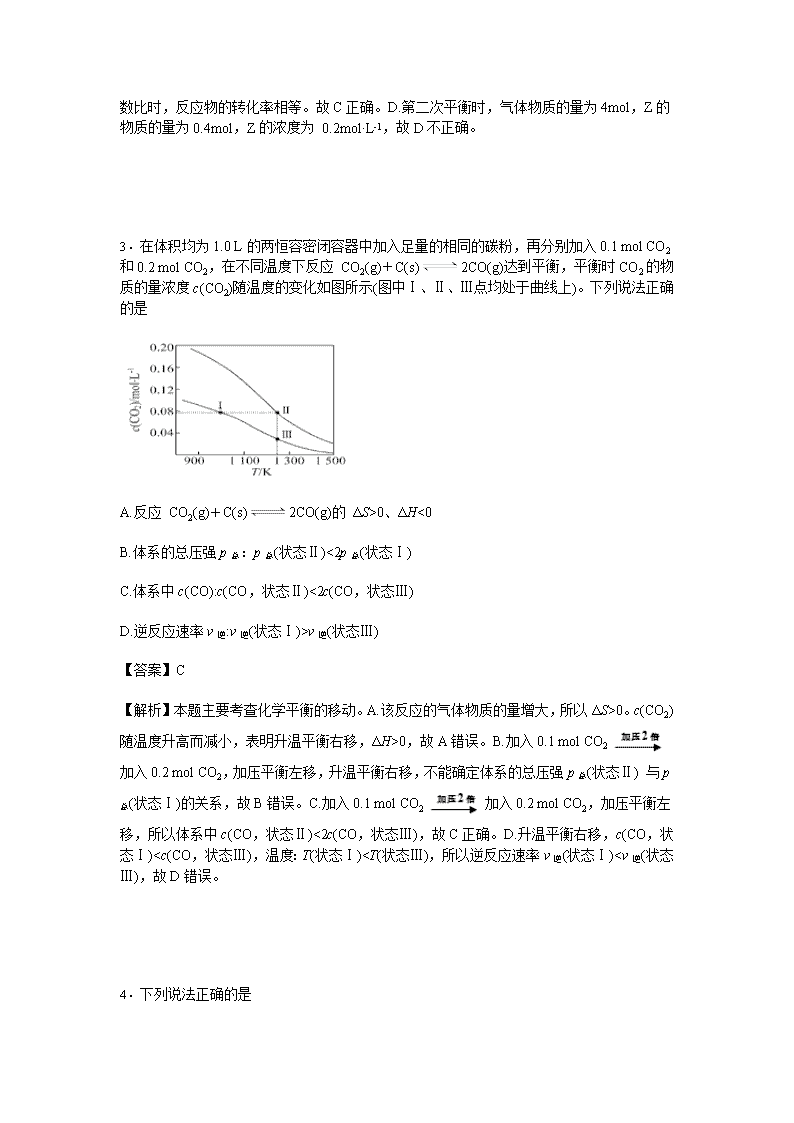
3.在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应 CO2(g)+C(s)2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
A.反应 CO2(g)+C(s)2CO(g)的 ΔS>0、ΔH<0
B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ)
【答案】C
【解析】本题主要考查化学平衡的移动。A.该反应的气体物质的量增大,所以ΔS>0。c(CO2)随温度升高而减小,表明升温平衡右移,ΔH>0,故A错误。B.加入0.1 mol CO2加入0.2 mol CO2,加压平衡左移,升温平衡右移,不能确定体系的总压强p总(状态Ⅱ) 与p总(状态Ⅰ)的关系,故B错误。C.加入0.1 mol CO2加入0.2 mol CO2,加压平衡左移,所以体系中c(CO,状态Ⅱ)<2c(CO,状态Ⅲ),故C正确。D.升温平衡右移,c(CO,状态Ⅰ)VNaOH,故A错误。B.饱和小苏打溶液中,少量水解,所以c(Na+)>c(),故B错误。C.Na2CO3溶液中加入少量Ca(OH)2固体,Na2CO3+Ca(OH)2CaCO3↓+2NaOH,c(OH-)增大,溶液的pH增大,故C错误。D.生成物硝酸铵水解使溶液显酸性,故D正确。
5.室温下,将一元酸HA的溶液和
KOH溶液等体积混合(忽略体积变化),实验数据如表:
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=mol·L—1
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
【答案】B
【解析】本题考查溶液中离子浓度大小的比较。A.实验①反应后的溶液中:c(OH-)>c(H+),根据电荷守恒,c(K+)>c(A-)>c(OH-)>c(H+),正确; B.实验①反应后的溶液是KA,根据电荷守恒:c(OH-)=c(K+)-c(A-)+c(H+),错误;C.实验②反应后的溶液呈中性,HA
溶液的体积大于KOH溶液的体积,c(A-)+c(HA)>0.1mol·L-1,正确; D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+),正确。故选B。
6.已知NaHSO3溶液显酸性,溶液中存在以下平衡:
+H2OH2SO3+OH-①
H++②
向 0.1 mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
A.加入少量金属 Na,平衡①左移,平衡②右移,溶液中c()增大
B.加入少量NaOH溶液,、的值均增大
C.加入少量Na2SO3固体,则c(H+)+c(Na+)=c()+c(OH-)+c()
D.加入氨水至中性,则 2c(Na+)=c()>c(H+)=c(OH-)
【答案】B
【解析】本题主要考查盐类水解和弱电解质电离。A.加入少量金属 Na,2Na+2H+2Na++H2↑,c(H+)减小,同时c(OH-)增大,所以平衡①左移,平衡②右移,其中平衡②右移是主要的,溶液中c()减小,故A错误。B.加入少量NaOH溶液,c(OH-)增大,同时c(H+)减小,对上述平衡的影响主要是使平衡②右移,c()减小,c()增大,所以、的值均增大,故B正确。C.电荷守恒:c(H+)+c(Na+)=c()+c(OH-)+2c(),故C错误。D.加入氨水至中性即c(H+)=c(OH-),电荷守恒:c(Na+)+c(H+)+c()=c(OH-)+2c(),可得c(Na+)+c()=2c(),故D错误。
7.在常温下,下列有关溶液中微粒的物质的量浓度关系不正确的是
A.0.1 mol·L-1pH=7.82 的 NH4HCO3溶液中:c()>c()>c(OH-)>c(H+)
B.0.1 mol·L-1Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
C.浓度均为 0.1 mol·L-1的NH3·H2O 溶液和 NH4Cl 溶液等体积混合:c()+c(H+)>c(NH3·H2O)+c(OH-)
D.0.1 mol·L-1Na2S 溶液与 0.1 mol·L-1NaHS 溶液等体积混合:2c(Na+)-3c(S2-)=3c(HS-)+3c(H2S)
【答案】A
【解析】本题主要考查盐类水解及离子浓度大小比较。A.0.1 mol·L-1pH=7.82 的 NH4HCO3溶液中:的水解程度大于,而且它们的水解程度都很小,所以c()>c()>c(OH-)>c(H+),故A不正确。B.0.1 mol·L-1Na2S溶液中存在平衡:H2OH++ OH-,S2-+ H2OHS-+ OH-,HS-+ H2OH2S+ OH-,所以c(OH-)=c(H+)+c(HS-)+2c(H2S),故B正确。C. 电荷守恒:c()+c(H+)=c(Cl-)+c(OH-)。一水合氨的电离程度大于铵根离子的水解程度,所以c()>c(Cl-)>c(NH3·H2O),因此c()+c(H+)>c(NH3·H2O)+c(OH-),故C正确。D.0.1 mol·L-1Na2S 溶液与 0.1 mol·L-1NaHS 溶液等体积混合:2c(Na+)=3c(HS-)+3c(H2S)+ 3c(S2-),故D正确。
二、综合题:共2题
8.(1)已知反应 2HI(g)H2(g)+I2(g)的 ΔH=+11kJ/mol,1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
(2)Bodensteins 研究了下列反应:2HI(g)H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
①根据上述实验结果,该反应的平衡常数K的计算式为__________。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为__________(以K和k正表示)。若k正=0.0027 min-1,在t=40min 时,v正=_________ min-1。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系如图所示。当升高到某一温度时,反应重新达到平衡,相应的点依次为_____(填字母)和_____(填字母)。
【答案】(1)299 ( 2)①K=(0.108)2/(0.784)2②k正/K 1.95×10-3 ③A E
【解析】本题主要考查有关化学平衡的计算。
(1) 设所求为x,ΔH=反应物键能之和-生成物键能之和=+11kJ/mol,2x-436-151=11,x=299,所以1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ。
(2)①K=c(H2)c(I2) /c2(HI) =(0.108)2/(0.784)2。
②K=k正/k逆,则k逆=k正/K。
v正=k正x2(HI)=0.0027 min-1×0.852=1.95×10-3min-1。
③当升高到某一温度时,平衡右移,反应重新达到平衡,v正增大,x(HI)减小,v逆增大,x(H2)增大,相应的点依次为A和E。
9.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是_________________________ (用离子方程式说明)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2溶液中c()________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4溶液中c()。
(3)均为 0.1 mol·L-1的几种电解质溶液的pH 随温度变化的曲线如图所示。
①其中符合0.1 mol·L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是________(填罗马数字),导致 NH4Al(SO4)2溶液的pH 随温度变化的原因是_______________________________;
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2溶液中 2c()-c()-3c(Al3+)=_______ mol·L-1。
(4)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加 0.1 mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示。
试分析图中 a、b、c、d四点,水的电离程度最大的是______点,在b点,溶液中各离子浓度由大到小的排列顺序是________________________________。
【答案】(1)Al3++3H2OAl(OH)3+3H+
(2)小于
(3)①Ⅰ NH4Al(SO4)2水解使溶液呈酸性,升高温度使其水解程度增大, pH减小
②10-3
(4)a c(Na+)>c()>c()>c(OH-)=c(H+)
【解析】本题主要考查盐类水解。
(1)NH4Al(SO4)2可作净水剂,其原理是Al3++3H2OAl(OH)3+3H+。
(2) 相同条件下,0.1 mol·L-1NH4Al(SO4)2溶液中,+H2ONH3·H2O+H+,Al3++3H2OAl(OH)3+3H+,Al3+水解产生的少量H+抑制的水解。0.1 mol·L-1NH4HSO4溶液中,NH4HSO4+H++,强酸性溶液中的大量H+抑制的水解,所以0.1 mol·L-1NH4Al(SO4)2溶液中c()小于0.1 mol·L-1NH4HSO4溶液中c()。
(3)①其中符合0.1 mol·L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是Ⅰ,导致 NH4Al(SO4)2溶液的pH 随温度变化的原因是NH4Al(SO4)2水解使溶液呈酸性,升高温度使其水解程度增大,pH减小。
②20℃时,0.1 mol·L-1NH4Al(SO4)2溶液中,电荷守恒:2c()+3c(Al3+) +c(H+)=2c()+c(OH-),c(H+)=10-3mol·L-1,c(OH-)=10-11mol·L-1,2c()-c()-3c(Al3+)=c(H+)-c(OH-)=10-3mol·L-1。
(4)水解促进水的电离,NH3·H2O电离的-抑制水的电离。a点H+与OH-恰好完全反应,d点与-恰好完全反应,a、b、c、d四点c()逐渐减小,c(NH3·H2O)逐渐增大,所以水的电离程度最大的是a点。在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c()>c()>c(OH-)=c(H+)。
三、实验题:共1题
10.测定平衡常数对定量认识化学反应具有重要意义。已知:I2能与 I-反应生成,并在溶液中建立如下平衡: I2+I-。通过测平衡体系中c(I2)、c(I-)和c(),就可求得该反应的平衡常数。
Ⅰ.某同学为测定上述平衡体系中c(I2),采用如下方法:取V1mL 平衡混合溶液,用cmol·L-1的Na2S2O3溶液进行滴定(反应为 I2+2Na2S2O32NaI+Na2S4O6),消耗V2mL 的Na2S2O3溶液。根据V1、V2和c可求得c(I2)。
(1)上述滴定时,可采用________做指示剂,滴定终点的现象是_____________________。
(2)下列对该同学设计方案的分析,正确的是________(填字母)。
A.方案可行。能准确测定溶液中的c(I2)
B.不可行。因为 I-能与 Na2S2O3发生反应
C.不可行。只能测得溶液中c(I2)与c()之和
Ⅱ.化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):
已知:①I-和不溶于 CCl4;②一定温度下,碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
(3)操作Ⅰ使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是________(填名称)。试指出该操作中应注意的事项为________。 (任写一条)
(4)上述测定过程均正常操作,下层液体中碘单质的物质的量浓度是________;若终点读数时俯视滴定管,则会造成所测浓度________ (填“等于”、 “大于”或“小于”)该值。
(5)实验测得上层溶液中c()=0.0049 mol·L-1,结合上述有关数据,计算室温条件下反应 I2+I-
【答案】(1)淀粉;溶液由蓝色变为无色,且半分钟后颜色不再改变
(2)C
(3)分液漏斗分液时上层液体应从上口倒出,下层液体应从下口放出(或分液漏斗末端应紧靠烧杯内壁或打开上口活塞,使分液漏斗内外压强相等便于液体流下等)
(4)0.085 mol/L 小于
(5)49000/51(或 961) L· mol-1
【解析】本题主要考查平衡常数的测定方法。
Ⅰ(1)上述滴定时,可采用淀粉做指示剂,滴定终点的现象是溶液由蓝色变为无色,且半分钟后颜色不再改变。
(2) I2与Na2S2O3反应造成c(I2)减小,反应 I2+I-的平衡不断左移,故选C。
Ⅱ. (3)操作Ⅰ是分液,使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是分液漏斗。该操作中应注意的事项为分液时上层液体应从上口倒出,下层液体应从下口放出(或分液漏斗末端应紧靠烧杯内壁或打开上口活塞,使分液漏斗内外压强相等便于液体流下等)。
(4) I2 + 2Na2S2O32NaI+Na2S4O6, 2 1
c(I2CCl4)×10mL 0.1 mol/L×17mL
c(I2CCl4) =0.085mol/L。
若终点读数时俯视滴定管,终读数变小,V[Na2S4O6(aq)]变小,则会造成所测浓度小于该值。
(5)Kd===85 ,=0.001mol/L,
c(I-) =c(KI) -c() =(0.01-0.049)mol/=0.051 mol/L。
==49000/51(或 961) L· mol-1。