- 223.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
新型化学电源的原理分析
专题训练
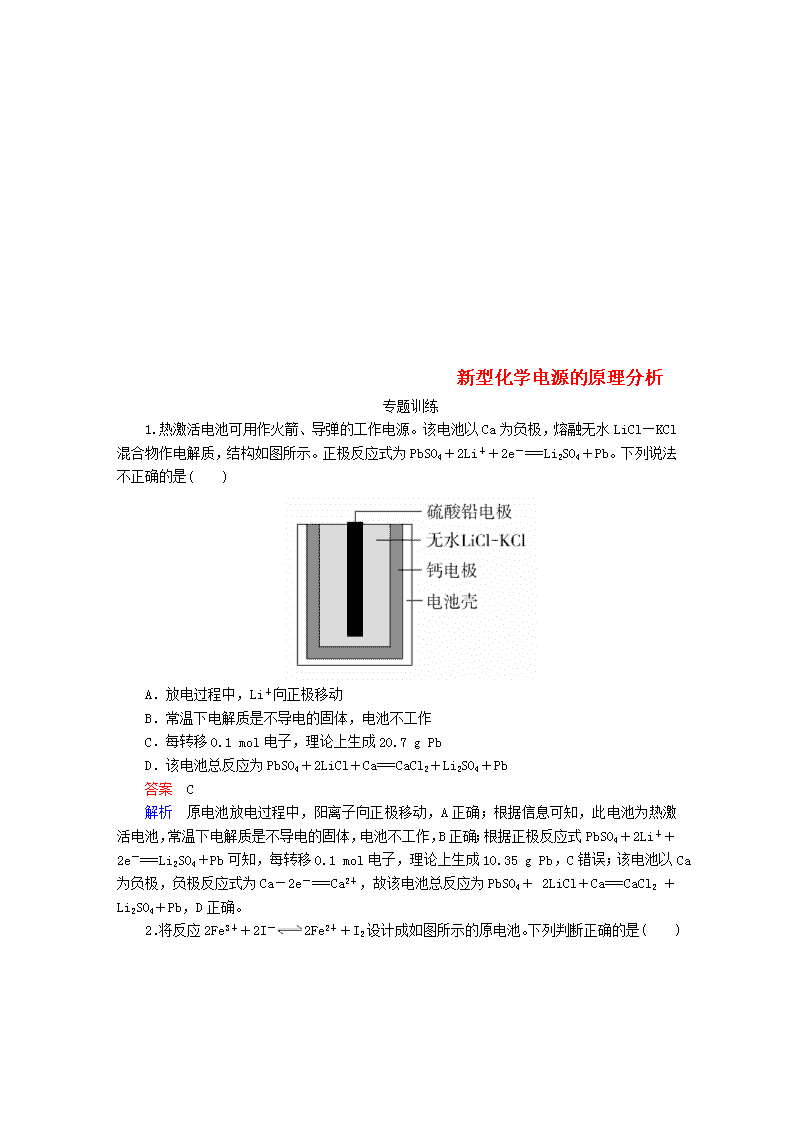
1.热激活电池可用作火箭、导弹的工作电源。该电池以Ca为负极,熔融无水LiCl—KCl混合物作电解质,结构如图所示。正极反应式为PbSO4+2Li++2e-===Li2SO4+Pb。下列说法不正确的是( )
A.放电过程中,Li+向正极移动
B.常温下电解质是不导电的固体,电池不工作
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb
答案 C
解析 原电池放电过程中,阳离子向正极移动,A正确;根据信息可知,此电池为热激活电池,常温下电解质是不导电的固体,电池不工作,B正确;根据正极反应式PbSO4+2Li++2e-===Li2SO4+Pb可知,每转移0.1 mol电子,理论上生成10.35 g Pb,C错误;该电池以Ca为负极,负极反应式为Ca-2e-===Ca2+,故该电池总反应为PbSO4+ 2LiCl+Ca===CaCl2 +Li2SO4+Pb,D正确。
2.将反应2Fe3++2I-2Fe2++I2设计成如图所示的原电池。下列判断正确的是( )
A.反应开始时,乙中电极反应式为2I-+2e-===I2
B.反应开始时,甲中石墨电极上发生氧化反应
C.电流表指针为零时,两池溶液颜色不再改变
D.平衡时甲中溶入FeCl2固体后,乙中的石墨电极为负极
答案 C
解析 由电池总反应式可知,反应开始时,乙中I-发生氧化反应生成I2,则电极反应式为2I--2e-===I2,A错误;反应开始时,甲中Fe3+在石墨电极上发生还原反应生成Fe2+,B错误;电流表指针为零时,反应达到平衡,乙中含有I2,溶液呈黄色;甲中含有Fe3+,溶液呈黄色,它们的浓度不再改变,C正确;甲中溶入FeCl2固体后,题述平衡逆向移动,则Fe2+失电子生成Fe3+,此时甲中石墨电极为负极,乙中石墨电极为正极,D错误。
3.(双选)某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。下列说法正确的是( )
A.Zn为电池的负极
B.正极反应式为2FeO+10H++6e-===Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
D.电池工作时OH-向负极迁移
答案 AD
解析 依据化合价升降判断,Zn只能失电子,为电池的负极材料,K2FeO4为正极材料,A正确;电解质溶液为KOH溶液,则正极反应式为2FeO+6e-+8H2O===2Fe(OH)3 +10OH-,B错误;由题意可知放电时总反应方程式为2K2FeO4+3Zn+8H2O===2Fe(OH)3+3Zn(OH)2+4KOH,电解质溶液浓度增大,C错误;原电池工作时OH-向负极迁移,D正确。
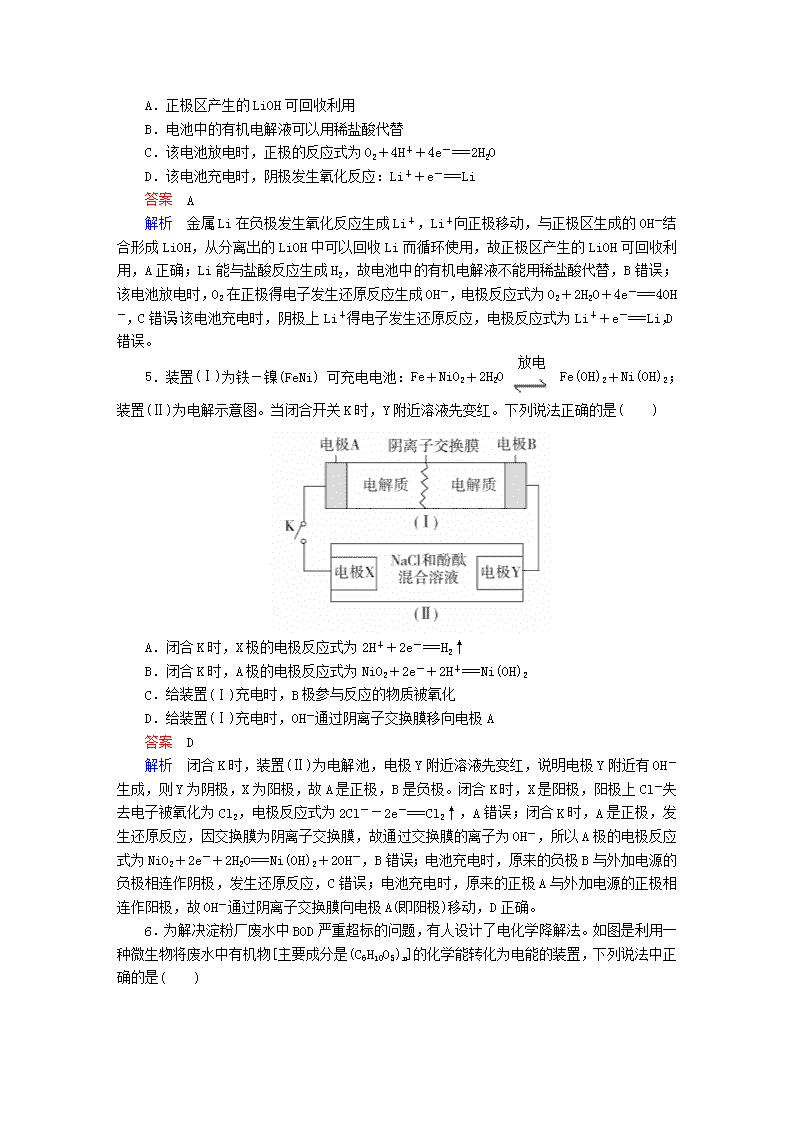
4.锂-空气电池是一种新型的二次电池,其放电时的工作原理如图所示,下列说法正确的是( )
A.正极区产生的LiOH可回收利用
B.电池中的有机电解液可以用稀盐酸代替
C.该电池放电时,正极的反应式为O2+4H++4e-===2H2O
D.该电池充电时,阴极发生氧化反应:Li++e-===Li
答案 A
解析 金属Li在负极发生氧化反应生成Li+,Li+向正极移动,与正极区生成的OH-结合形成LiOH,从分离出的LiOH中可以回收Li而循环使用,故正极区产生的LiOH可回收利用,A正确;Li能与盐酸反应生成H2,故电池中的有机电解液不能用稀盐酸代替,B错误;该电池放电时,O2在正极得电子发生还原反应生成OH-,电极反应式为O2+2H2O+4e-===4OH-,C错误;该电池充电时,阴极上Li+得电子发生还原反应,电极反应式为Li++e-===Li,D错误。
5.装置(Ⅰ)为铁-镍(FeNi)可充电电池:Fe+NiO2+2H2OFe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是( )
A.闭合K时,X极的电极反应式为2H++2e-===H2↑
B.闭合K时,A极的电极反应式为NiO2+2e-+2H+===Ni(OH)2
C.给装置(Ⅰ)充电时,B极参与反应的物质被氧化
D.给装置(Ⅰ)充电时,OH-通过阴离子交换膜移向电极A
答案 D
解析 闭合K时,装置(Ⅱ)为电解池,电极Y附近溶液先变红,说明电极Y附近有OH-生成,则Y为阴极,X为阳极,故A是正极,B是负极。闭合K时,X是阳极,阳极上Cl-失去电子被氧化为Cl2,电极反应式为2Cl--2e-===Cl2↑,A错误;闭合K时,A是正极,发生还原反应,因交换膜为阴离子交换膜,故通过交换膜的离子为OH-,所以A极的电极反应式为NiO2+2e-+2H2O===Ni(OH)2+2OH-,B错误;电池充电时,原来的负极B与外加电源的负极相连作阴极,发生还原反应,C错误;电池充电时,原来的正极A与外加电源的正极相连作阳极,故OH-通过阴离子交换膜向电极A(即阳极)移动,D正确。
6.为解决淀粉厂废水中BOD严重超标的问题,有人设计了电化学降解法。如图是利用一种微生物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )
A.N极是负极
B.该装置工作时,H+从右侧经阳离子交换膜移向左侧
C.负极的电极反应为(C6H10O5)n+7nH2O-24ne-===6nCO2↑+24nH+
D.物质X是OH-
答案 C
解析 由图可知,O2在N极发生还原反应生成X,则N极是正极,A错误;放电时,电解质溶液中阳离子向正极移动,阴离子向负极移动,故H+从左侧经阳离子交换膜移向右侧,B错误;由图可知,M电极上有机物[主要成分是(C6H10O5)n]在微生物作用下生成H+,则电极反应式为(C6H10O5)n+7nH2O-24ne-===6nCO2↑+24nH+,C正确;O2在正极得电子被还原,与迁移来的H+结合生成H2O,电极反应式为O2+4H++4e-===2H2O,故物质X是H2O,D错误。
7.硼化钒(VB2)空气电池是目前储电能力最强的电池,电池结构示意图如下,该电池工作时总反应为4VB2+11O2===4B2O3+2V2O5,下列说法正确的是( )
A.电极a为电池负极,发生还原反应
B.每消耗1 mol VB2转移6 mol电子
C.电池工作时,OH-向电极a移动
D.VB2极发生的电极反应式为2VB2+22OH--22e-===V2O5+2B2O3+11H2O
答案 D
解析 由题图可知,空气通入电极a,显然电极a为正极,发生还原反应,A错误;4 mol VB2发生反应时消耗11 mol O2,同时转移44 mol电子,故消耗1 mol VB2时转移11 mol电子,B错误;电池工作时,阴离子(OH-)向负极(VB2极)移动,C错误;正极反应式为O2+2H2O+4e-===4OH-,用总反应式减去正极反应式的11倍即得负极反应式,故VB2在负极上发生氧化反应,电极反应式为2VB2+22OH--22e-===V2O5+2B2O3+11H2O,D正确。
8.高铁电池是一种可充电电池,负极材料是Zn,氧化产物是Zn(OH)2,正极材料是K2FeO4(易溶盐),还原产物是Fe(OH)3
,电解质溶液是KOH水溶液。下列有关说法正确的是( )
A.高铁电池放电时,正极反应式为Zn+2OH--2e-===Zn(OH)2
B.高铁电池充电时,阴极反应式为Fe(OH)3+5OH--3e-===FeO+4H2O
C.高铁电池放电时的总反应为2FeO+8H2O+3Zn===2Fe(OH)3+3Zn(OH)2+4OH-
D.高能碱性电池的工作电压比高铁电池更稳定
答案 C
解析 放电时,正极发生还原反应,应是FeO得电子,故A错误;充电时,阴极发生还原反应,应是Zn(OH)2得电子,故B错误;高铁电池放电时的总反应为2FeO+8H2O+3Zn===2Fe(OH)3+3Zn(OH)2+4OH-,故C正确;根据题图可知,高铁电池的工作电压比高能碱性电池更稳定,故D错误。
9.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( )
A.电池总反应式为H2+2NiO(OH)2Ni(OH)2
B.放电时,甲电极为负极,OH-移向乙电极
C.放电时,乙电极反应为NiO(OH)+H2O+e-===Ni(OH)2+OH-
D.充电时,甲电极与直流电源的正极相连
答案 C
解析 放电时,H2在甲电极放电,负极的电极反应式为H2+2OH--2e-===2H2O,正极的电极反应式为2NiO(OH)+2H2O+2e-===2Ni(OH)2+2OH-,则两式相加得总反应式:H2+2NiO(OH)2Ni(OH)2
,故A错误;放电时,该电池为原电池,甲电极为负极,电解质溶液中阴离子向负极移动,所以OH-向负极甲电极移动,故B错误;放电时,乙电极为正极,得电子发生还原反应,电极反应式为NiO(OH)+H2O+e-===Ni(OH)2+OH-,故C正确;放电时,氢气在甲电极发生氧化反应,甲电极作负极,充电时,甲电极发生还原反应,作阴极,应与电源的负极相连,故D错误。
10.如图装置甲是某可充电电池的示意图,该电池放电的化学方程式为2K2S2+KI3===K2S4+3KI,图中的离子交换膜只允许K+通过,C、D、F均为石墨电极,E为铜电极。工作一段时间后,断开K,此时C、D两电极产生的气体体积相同,E电极质量减少1.28 g。
(1)装置甲的A电极为电池的________极,电解质的K+从离子交换膜的________(填“左侧”或“右侧”,下同)向离子交换膜的________迁移;B电极的电极反应式为________________________。
(2)装置乙中D电极析出的气体是________,体积为________ mL(标准状况)。
答案 (1)负 左侧 右侧 I+2e-===3I-
(2)H2(或氢气) 224
解析 (1)由E电极(铜)的质量减少可知E为阳极,则F为阴极,A为负极,B为正极,C为阳极,D为阴极。原电池中阳离子从负极移向正极,即K+由左侧透过离子交换膜移向右侧。根据电池放电的化学方程式知,I在正极得电子发生还原反应,生成I-。
(2)D电极上首先发生反应Cu2++2e-===Cu,当Cu2+消耗尽时,发生反应2H++2e-===H2↑,根据得失电子守恒,该电极析出的H2的体积为:
×22400 mL·mol-1=224 mL。