- 382.63 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第六章测评
(时间:90分钟 分值:100分)
一、选择题(本题包括16小题,每小题3分,共48分)
1.一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中和代表不同元素的原子。
关于此反应说法错误的是( )
A.一定属于吸热反应
B.一定属于可逆反应
C.一定属于氧化还原反应
D.一定属于分解反应
答案A
解析观察示意图知,该反应的反应物是一种,生成物是两种,该反应为分解反应,一般的分解反应是吸热反应,但也有的分解反应(如2H2O22H2O+O2↑)是放热反应,A项错误、D项正确;根据图示可知,充分反应后,反应物与生成物共存,所以该反应是可逆反应,B项正确;该反应中反应物为化合物,生成物中有单质,有元素化合价的变化,属于氧化还原反应,C项正确。
2.“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O2Mg(OH)2。下列关于该电池的说法错误的是( )
A.镁片作为正极
B.食盐水作为电解质溶液
C.电池工作时镁片逐渐被消耗
D.电池工作时实现了化学能向电能的转化
答案A
解析根据原电池原理可知,镁为负极,发生氧化反应;氧气在正极发生还原反应。
3.一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质混合并发生反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )
A.浓硫酸与水 B.生石灰与水
C.熟石灰与水 D.氯化钠与水
10
答案B
解析浓硫酸溶于水虽然放热,但浓硫酸是液体,又具有强烈的腐蚀性,不适宜给食品加热;而相同质量的生石灰和熟石灰分别溶于水,前者放出的热量比后者多;氯化钠溶于水能量变化不明显。
4.下列说法不正确的是( )
A.原电池负极被氧化
B.任何化学反应都能设计成原电池
C.化学反应的速率和限度均可通过改变化学反应条件而改变
D.化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变
答案B
解析原电池反应的本质是氧化还原反应,因此非氧化还原反应是不能设计成原电池的。
5.下列有关化学反应速率和限度的说法中,不正确的是( )
A.实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快
B.在金属钠与足量的水的反应中,增加水的量能增大反应速率
C.2SO2+O22SO3反应中,SO2不能全部转化为SO3
D.实验室用碳酸钙和盐酸反应制取CO2,用碳酸钙粉末比用块状碳酸钙反应要快
答案B
解析A项,添加催化剂,可增大反应速率;B项,水的量的多少不影响钠与水的反应速率;C项,可逆反应不能进行到底;D项,增大固体物质的表面积能增大化学反应速率。
6.下列措施对增大反应速率明显有效的是( )
A.在用H2和N2工业合成NH3时,降低温度
B.Fe与稀硫酸反应制取氢气时,改用浓硫酸
C.K2SO4与BaCl2在溶液中反应时,增大压强
D.将铝片改为铝粉,做铝与氧气反应的实验
答案D
解析降低温度,合成NH3的反应速率减小;铁遇浓硫酸会产生钝化现象,不再产生氢气;压强的改变只能适用于有气体参加的反应;增大固体的表面积可以加快反应速率。
7.某学生将电流表用导线与两个电极连接在一起,再将两个电极同时插入某种电解质溶液中,能观察到有电流产生的是( )
A.用铜片、铅笔芯作电极插入稀硫酸中
B.用两个铜片作电极插入硝酸银溶液中
C.用锌片、铜片作电极插入番茄中
D.用铜片、铁片作电极插入酒精中
答案C
解析要构成原电池,除要形成闭合回路外,还需要有两个活动性不同的电极,其中一个电极要能与电解质溶液发生自发的氧化还原反应。A项,铜、石墨与稀硫酸均不反应;B项,电极材料相同;D项,酒精是非电解质;C项,一些水果中含有有机酸,其汁液可作电解质溶液。
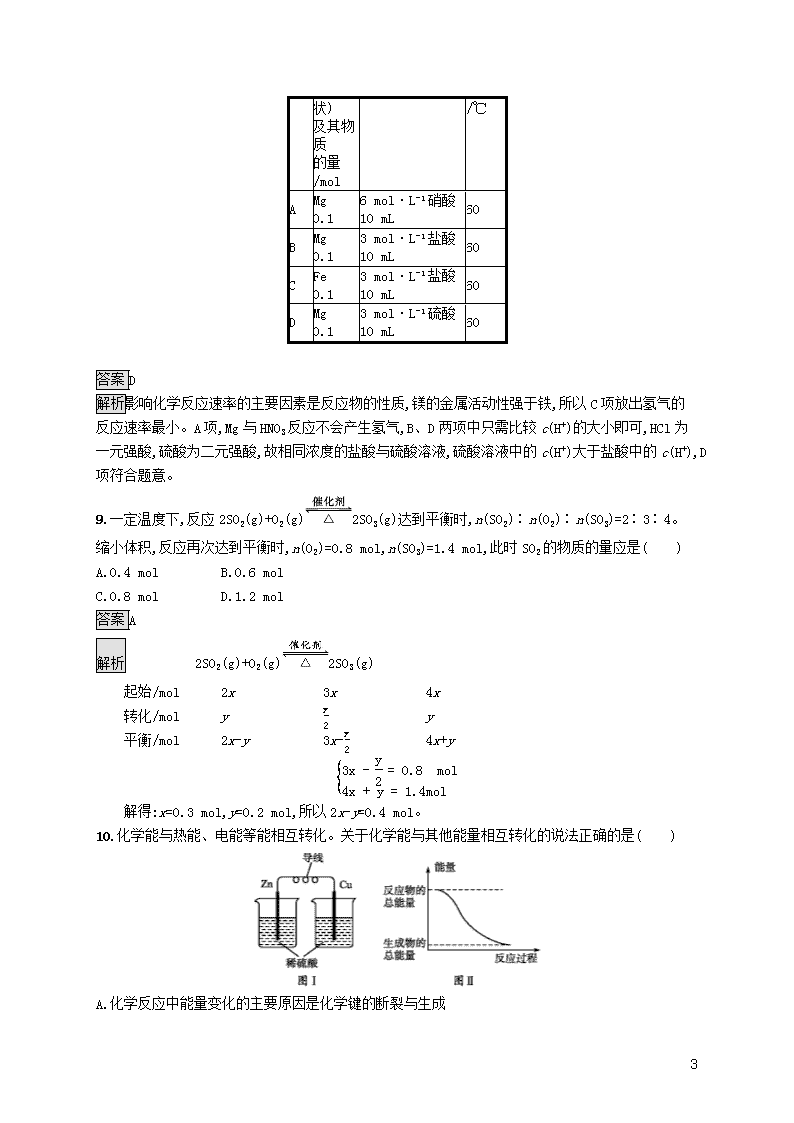
8.下列各组反应(表中物质均为反应物)在反应刚开始时,放出H2的反应速率最大的是( )
选项
金属
(粉末
酸的浓度及体积
反应
温度
10
状)
及其物质
的量/mol
/℃
A
Mg 0.1
6 mol·L-1硝酸 10 mL
60
B
Mg 0.1
3 mol·L-1盐酸 10 mL
60
C
Fe 0.1
3 mol·L-1盐酸 10 mL
60
D
Mg 0.1
3 mol·L-1硫酸 10 mL
60
答案D
解析影响化学反应速率的主要因素是反应物的性质,镁的金属活动性强于铁,所以C项放出氢气的反应速率最小。A项,Mg与HNO3反应不会产生氢气,B、D两项中只需比较c(H+)的大小即可,HCl为一元强酸,硫酸为二元强酸,故相同浓度的盐酸与硫酸溶液,硫酸溶液中的c(H+)大于盐酸中的c(H+),D项符合题意。
9.一定温度下,反应2SO2(g)+O2(g)2SO3(g)达到平衡时,n(SO2)∶n(O2)∶n(SO3)=2∶3∶4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物质的量应是( )
A.0.4 mol B.0.6 mol
C.0.8 mol D.1.2 mol
答案A
解析 2SO2(g)+O2(g)2SO3(g)
起始/mol 2x 3x 4x
转化/mol y y2 y
平衡/mol 2x-y 3x-y2 4x+y
3x-y2=0.8 mol4x+y=1.4mol
解得:x=0.3 mol,y=0.2 mol,所以2x-y=0.4 mol。
10.化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是( )
10
A.化学反应中能量变化的主要原因是化学键的断裂与生成
B.铝热反应中,反应物的总能量比生成物的总能量低
C.图Ⅰ所示的装置能将化学能转变为电能
D.图Ⅱ所示的反应为吸热反应
答案A
解析旧化学键断裂吸收能量,新化学键形成释放能量,所以化学反应中能量变化的主要原因是化学键的断裂与生成,A项正确;铝热反应是放热反应,所以反应物的总能量比生成物的总能量高,B项错误;图Ⅰ所示的装置中没有形成闭合回路,不能构成原电池,因此不能将化学能转变为电能,C项错误;图Ⅱ所示的反应中反应物的总能量高于生成物的总能量,为放热反应,D项错误。
11.可再生能源是我国重要的能源资源,在满足能源需求、改善能源结构、减少环境污染、促进经济发展等方面具有重要作用。应用太阳能光伏发电技术是实现节能减排的一项重要措施。下列有关分析不正确的是( )
A.上图是太阳能光伏发电原理图,图中A极为正极
B.风能、太阳能、生物质能等属于可再生能源
C.推广可再生能源有利于经济可持续发展
D.光伏发电能量转化方式是太阳能直接转变为电能
答案A
解析在原电池的外电路中,电流由正极流向负极,由图中的电流方向可判断A极为负极,A符合题意;风能、太阳能、生物质能在短时间内能形成,属于可再生能源,B不符合题意;推广可再生能源有利于经济可持续发展,C不符合题意;光伏电池发电是将光能直接转化为电能,D不符合题意。
12.某反应由两步反应ABC构成,它的反应能量曲线如图,下列叙述正确的是( )
A.两步反应均为吸热反应
10
B.三种化合物中C最稳定
C.A与C的能量差为E4
D.AB的反应,反应条件一定要加热
答案B
解析根据反应能量曲线图可知,能量大小为B>A>C,故AB、BC两步反应分别为吸热反应、放热反应,其中A、C的能量差为ΔH,C的能量最低,C最稳定,A项、C项错误,B项正确;吸热反应不一定需要加热,D项错误。
13.下列描述的化学反应状态,不一定是平衡状态的是( )
A.H2(g)+Br2(g)2HBr(g)
恒温、恒容下,反应体系中气体的颜色保持不变
B.2NO2(g)N2O4(g)
恒温、恒容下,反应体系中气体的压强保持不变
C.CaCO3(s)CO2(g)+CaO(s)
恒温、恒容下,反应体系中气体的密度保持不变
D.3H2(g)+N2(g)2NH3(g)
反应体系中H2与N2的物质的量之比保持3∶1
答案D
解析A项,该反应体系在恒温、恒容下气体的颜色保持不变,即Br2的百分含量保持不变,说明反应处于平衡状态;B项,该反应在恒温、恒容下气体的压强保持不变,说明NO2和N2O4的物质的量保持不变,反应处于平衡状态;C项,该反应在恒温、恒容下气体的密度保持不变,说明CO2的质量保持不变,反应处于平衡状态;D项,对于化学反应3H2(g)+N2(g)2NH3(g),如果开始时加入的反应物的物质的量之比n(H2)∶n(N2)=3∶1,或加入的是纯NH3,则反应从开始到达到化学平衡状态,始终满足n(H2)∶n(N2)=3∶1,因此,n(H2)∶n(N2)=3∶1的状态不一定是平衡状态。
14.已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量;②1 mol I2蒸气中化学键断裂时需要吸收151 kJ的能量;③由H原子和I原子形成1 mol HI分子时释放299 kJ的能量。下列判断不正确的是( )
A.I2分子比H2分子稳定
B.2 mol HI(g)发生分解反应吸收11 kJ热量
C.HI与NaOH的反应属于放热反应
D.0.5 mol H2(g)与0.5 mol I2(g)完全反应释放出5.5 kJ 热量
答案A
解析选项A,H2分子共价键断裂时吸收的热量比I2分子共价键断裂时吸收的热量多,H2分子比I2分子稳定,A选项错误。选项B,2 mol HI(g)发生反应2HI(g)H2(g)+I2(g),吸收的热量=2E(H—I)-E(H—H)-E(I—I)=2 mol×299 kJ·mol-1-1 mol×436 kJ·mol-1-1 mol×151 kJ·mol-1=11 kJ。选项C,中和反应是放热反应。选项D,根据选项B计算可知正确。
15.化学电源在日常生活和高科技领域中都有广泛应用。
10
下列说法不正确的是( )
A.甲:Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B.乙:正极的电极反应式为Ag2O+2e-+H2O2Ag+2OH-
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
答案A
解析A项,Cu作正极,H+在正极得电子生成氢气,因此Cu电极附近溶液中H+浓度减小,所以错误,符合题意;B项,Ag2O得电子作正极,生成Ag和OH-,所以正确,不符合题意;C项,锌筒作负极,失电子发生氧化反应生成Zn2+,因此锌被消耗而使锌筒变薄,所以正确,不符合题意;D项,铅酸蓄电池总的电池反应为Pb+PbO2+2H2SO42PbSO4+2H2O ,由此可知反应过程中消耗了硫酸,因此电解质溶液酸性减弱,溶液中的离子浓度减小,因此导电能力下降,所以正确,不符合题意。
16.一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)2NH3(g),反应过程如图:
下列说法正确的是( )
A.t1 min时正、逆反应速率相等
B.X曲线表示NH3的物质的量随时间变化的关系
C.0~8 min,H2的平均反应速率v(H2)=0.75 mol·L-1·min-1
D.10~12 min,N2的平均反应速率v(N2)=0.25 mol·L-1·min-1
答案B
解析t1 min时,只是X和Y的物质的量相等,反应没有达到平衡状态,说明正、逆反应速率不相等;根据图像,Y表示H2的物质的量随时间的变化关系,X表示NH3的物质的量随时间的变化关系;0~8
10
min,H2的平均反应速率v(H2)=(1.2-0.3)mol8min×10 L=0.011 25 mol·L-1·min-1,根据H2的变化量可计算出10~12 min内N2的平均反应速率v(N2)=13×(0.3-0.15)mol10 L×2min=0.002 5 mol·L-1·min-1。
二、非选择题(本题包括4小题,共52分)
17.(13分)反应Fe+H2SO4FeSO4+H2↑的能量变化趋势如图所示:
(1)该反应为 (填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率增大,下列措施可行的是 (填字母)。
A.改铁片为铁粉
B.改稀硫酸为98%的浓硫酸
C.升高温度
D.减小压强
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为 (填“正”或“负”)极。铜片上产生的现象为 ,该极上发生的电极反应为 ,外电路中电子由 (填“正”或“负”,下同)极向 极移动。
答案(1)放热 (2)AC (3)正 产生无色气泡 2H++2e-H2↑ 负 正
解析(1)据能量变化图像可知该反应是放热反应。
(2)增大固体的表面积或升高温度,反应速率增大;适当增大反应物浓度,反应速率也增大,但98%的浓硫酸能使铁钝化。
(3)该反应中铁是还原剂,作负极,比铁活动性差的铜应作正极。铜片上,氢离子得到电子,电极反应为2H++2e-H2↑,外电路电子由负极流向正极。
18.(13分)(1)在2 L的密闭容器中放入4 mol N2O5,发生如下反应:2N2O5(g)4NO2(g)+O2(g)。反应至5 min时,测得N2O5转化了20%,则v(NO2)为 ;5 min时,N2O5在混合气体中的体积分数是 。
(2)某温度时,在一个2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:
①该反应的化学方程式为 。
10
②若X、Y、Z均为气体,2 min时反应达到平衡,此时体系内压强与开始时的压强之比为 。
③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时 (填“增大”“减小”或“相等”)。
答案(1)0.16 mol·L-1·min-1 61.5%
(2)①3X+Y2Z ②9∶10 ③增大
解析(1)由三段式可知转化的N2O5(g)、NO2(g)、O2(g)的浓度分别为0.4 mol·L-1、0.8 mol·L-1、0.2 mol·L-1,5 min时N2O5(g)、NO2(g)、O2(g)的浓度分别为1.6 mol·L-1、0.8 mol·L-1、0.2 mol·L-1,故v(NO2)=0.8mol·L-15min=0.16 mol·L-1·min-1,5 min时,N2O5在混合气体中的体积分数为1.61.6+0.8+0.2×100%≈61.5%。(2)①反应中各物质的物质的量的变化量之比等于化学计量数之比,则(1-0.7)∶(1-0.9)∶(0.2-0)=3∶1∶2,2 min后各物质的物质的量不再变化,此反应为可逆反应,故反应的化学方程式为3X+Y2Z。②压强之比等于气体物质的量之比,则(0.9+0.7+0.2)∶(1.0+1.0)=9∶10。③达平衡时,容器内气体的物质的量减小,但气体总质量不变,故混合气体的平均相对分子质量比起始投料时增大。
19.(13分)Ⅰ.已知断裂或形成1 mol化学键所吸收或放出的能量叫做该化学键的键能,单位为kJ·mol-1。白磷在氧气中燃烧的化学方程式可用结构式表示如图:
试根据下表中的化学键键能计算:0.1 mol P4(白磷)在氧气中充分燃烧放出的能量为 kJ。
化学键
P—P
P—O
OO
PO
键能/(kJ·mol-1)
198
360
498
585
Ⅱ.将V1 mL 2.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。请按要求填空:
10
(1)该实验表明此反应 (填“吸收”或“释放”)能量,通过图示分析可以得出:做该实验时,环境温度 (填“高于”“低于”或“等于”)22 ℃。
(2)根据图示计算该NaOH溶液的浓度约是 mol·L-1。
Ⅲ.如图所示在锥形瓶放置有装有水的小试管,往小试管中分别加入下列物质时:①烧碱固体、②浓硫酸、③硝酸铵固体、④NaCl固体,其中能使a端液面高于b端液面的是 (填序号)。
答案Ⅰ.298.2
Ⅱ.(1)释放 低于
(2)3.0
Ⅲ.③
解析Ⅰ.反应热=反应物总键能-生成物总键能,所以反应P4(s)+5O2(g)P4O10(s)的ΔH=6×198 kJ·mol-1+5×498 kJ·mol-1-(4×585 kJ·mol-1+12×360 kJ·mol-1)=-2 982 kJ·mol-1。故0.1 mol白磷在氧气中充分燃烧放出的能量为298.2 kJ。Ⅱ.(1)根据实验结果图所示,5 mL HCl溶液和45 mL NaOH溶液反应后的温度是22 ℃,又盐酸和氢氧化钠溶液反应是放热反应,释放能量,可以知道该实验开始时温度一定低于22 ℃。(2)HCl和NaOH恰好完全反应时,参加反应的盐酸的体积是30 mL,由V1+V2=50 mL可知,消耗的氢氧化钠溶液的体积为20 mL;设恰好完全反应时氢氧化钠溶液中溶质的物质的量为n,则n=2.0 mol·L-1×0.03 L=0.06 mol,所以NaOH溶液的浓度为0.06mol0.02 L=3 mol·L-1。Ⅲ.a端液面高于b端,说明加入药品后锥形瓶内温度降低,气体压强减小,硝酸铵溶于水为吸热过程,所以③正确。
20.(13分)(1)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
①当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为 ,当电路中有0.2 mol电子通过时,负极的质量减少 g。
②当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置 (填“能”或“不能”)形成原电池,若不能,请说明理由,若能,请指出正、负极: 。
(2)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流表。
①锌片上发生的电极反应为 ;
②银片上发生的电极反应为 。
③若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
10
a.产生氢气的体积(标准状况);
b.通过导线的电量。(已知NA=6.02×1023 mol-1,电子电荷为1.60×10-19 C)
答案(1)①2H++2e-H2↑ 1.8
②能 正极为镁,负极为铝
(2)①Zn-2e-Zn2+ ②2H++2e-H2↑
③a.4.48 L b.3.9×104 C
解析(1)①a为Al,b为Cu,电解质溶液为稀硫酸时,电池总反应的离子方程式为2Al+6H+2Al3++3H2↑,当转移0.2 mol电子时,负极反应的Al的质量为m(Al)=0.2 mol×13×27 g·mol-1=1.8 g;②当a为Al,b为Mg,电解质溶液为NaOH溶液时,电池总反应的离子方程式为2Al+2OH-+2H2O2AlO2-+3H2↑,负极为Al,正极为Mg。(2)①在锌片、银片、稀硫酸组成的原电池中,锌片作负极,其电极反应为Zn-2e-Zn2+;②银片作正极,其电极反应为2H++2e-H2↑。电池总反应式为Zn+2H+Zn2++H2↑。③根据电极反应式找出已知量与电量之间的定量关系进行计算。a.锌片与银片减少的质量等于生成氢气所消耗的锌的质量,设产生的氢气在标准状况下的体积为x。
Zn+2H+Zn2++H2↑
65 g 22.4 L
60 g-47 g x
65 g60 g-47 g=22.4 Lx
x=4.48 L
b.反应消耗的锌的物质的量为13 g÷65 g· mol-1=0.20 mol,1 mol Zn变为Zn2+时,转移2 mol e-,则导线中通过的电量为0.20 mol×2×6.02×1023 mol-1×1.6×10-19 C≈3.9×104 C。
10
相关文档
- 2节化学反应与能量转化第2课时化学2021-07-067页
- 2020_2021学年新教材高中化学第1章2021-07-0656页
- 第二章化学键化学反应规律第二节化2021-07-065页
- 2019届一轮复习人教版第17讲化学反2021-07-0621页
- 2018届二轮复习化学反应与能量变化2021-07-0632页
- 2018届二轮复习化学反应与能量变化2021-07-0620页
- 高中化学第六章化学反应与能量第二2021-07-067页
- 2019届高考化学二轮复习 化学反应2021-07-0620页
- 2020届二轮复习化学反应与能量课件2021-07-06134页
- 2019届二轮复习化学反应与能量学案2021-07-0610页