- 450.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
广东省梅州市兴宁市第一中学2019-2020学年高一上学期
第2次月考化学试题
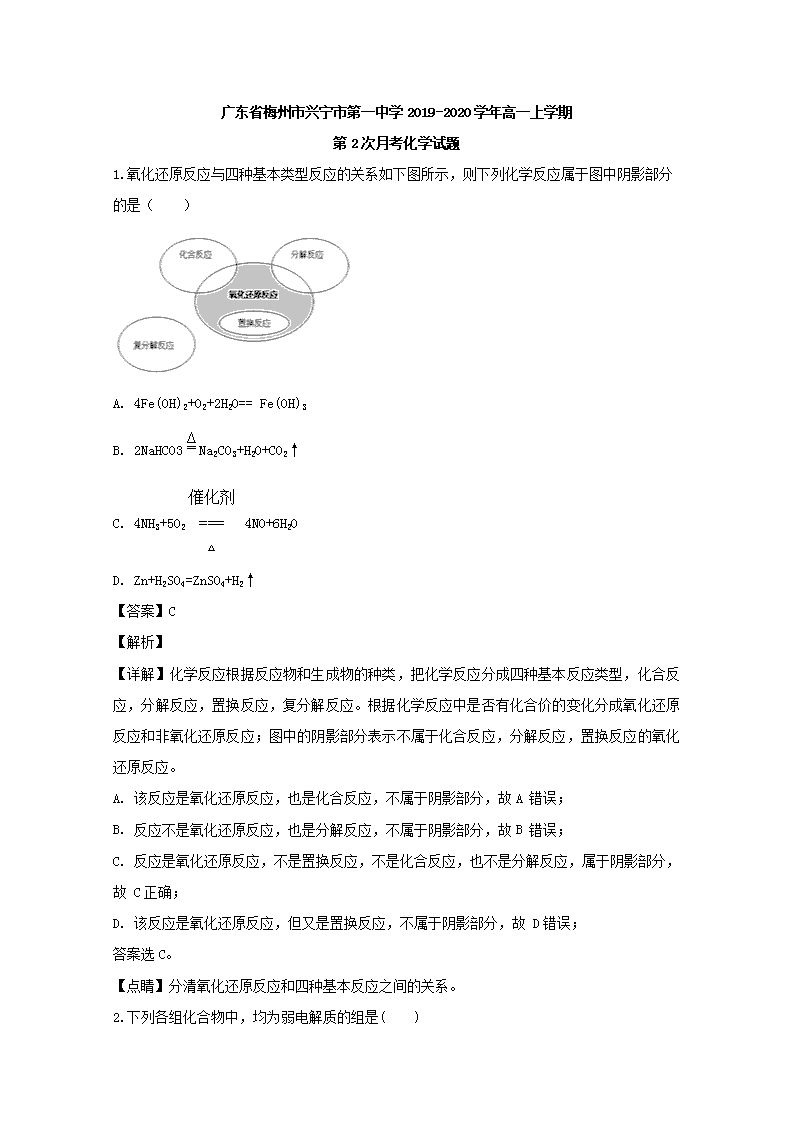
1.氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于图中阴影部分的是( )
A. 4Fe(OH)2+O2+2H2O== Fe(OH)3
B. 2NaHCO3Na2CO3+H2O+CO2↑
C. 4NH3+5O2 4NO+6H2O
D. Zn+H2SO4=ZnSO4+H2↑
【答案】C
【解析】
【详解】化学反应根据反应物和生成物的种类,把化学反应分成四种基本反应类型,化合反应,分解反应,置换反应,复分解反应。根据化学反应中是否有化合价的变化分成氧化还原反应和非氧化还原反应;图中的阴影部分表示不属于化合反应,分解反应,置换反应的氧化还原反应。
A. 该反应是氧化还原反应,也是化合反应,不属于阴影部分,故A 错误;
B. 反应不是氧化还原反应,也是分解反应,不属于阴影部分,故B 错误;
C. 反应是氧化还原反应,不是置换反应,不是化合反应,也不是分解反应,属于阴影部分,故 C正确;
D. 该反应是氧化还原反应,但又是置换反应,不属于阴影部分,故 D错误;
答案选C。
【点睛】分清氧化还原反应和四种基本反应之间的关系。
2.下列各组化合物中,均为弱电解质的组是( )
A. H2CO3、Ba(OH)2、K2S、H3PO4 B. FeCl3、HF、CH3CH2OH、NH4Cl
C. CH3COOH、H2S、NH3×H2O、H2O D. HClO、H2SO3、HCl、NaHCO3
【答案】C
【解析】
【详解】A. H2CO3和H3PO4为弱电解质,而Ba(OH)2和K2S在水溶液中能够完全电离,属于强电解质,故A错误;
B. HF是弱电解质,而FeCl3和NH4Cl属于强电解质,CH3CH2OH属于非电解质,故B错误;
C. CH3COOH和H2S为弱酸,NH3×H2O为弱碱,H2O也为弱电解质,符合题意,故C正确;
D. HClO和H2SO3为弱电解质,HCl和NaHCO3为强电解质,故D错误;
答案选C。
【点睛】电解质的强弱是根据电解质在水溶液中的电离程度划分的,若完全电离,则属于强电解质,强酸、强碱和大多数的盐均属于强电解质;若部分电离,则属于弱电解质。
3.下列说法错误的是( )
A. “血液透析”利用了胶体的性质
B. 溶液是电中性的,胶体是带电的
C. 明矾能水解生成Al(OH)3胶体,可用作净水剂
D. 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
【答案】B
【解析】
【详解】A. 血液属于胶体,胶体不能透过半透膜,因此“血液透析”利用的是胶体的性质,故A正确;
B. 溶液是电中性的,胶体本身不带电,胶体粒子可能会因为吸附带电粒子而带电,故B错误;
C. 明矾在水溶液中能水解生成具有吸附性的Al(OH)3胶体,而达到净水目的,故C正确;
D. 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体,故D正确;
答案选B。
【点睛】B项是易错点,胶体和胶粒不是一个概念,胶体表面积较大,吸附带电粒子而形成胶粒,且并不是所有胶粒都带电,如淀粉胶粒不带电。
4.设NA为阿伏加德罗常数,下列说法不正确是
A. 标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
B. 同温同压下,体积相同的氢气和氩气所含的分子数相等
C. 78gNa2O2与足量的CO2反应转移电子数为NA
D. 1L 2mol/L的氯化镁溶液中含氯离子为2NA
【答案】D
【解析】
【详解】A.依据阿伏伽德罗定律:同温同压下,相同体积的气体具有相同分子数,可知11.2L以任意比例混合的氮气和氧气物质的量为11.2L/22.4L/mol=0.5mol,氮气与氧气都是双原子分子,所以混合气体含有原子物质的量为1mol,个数为NA,故A正确;
B.依据阿伏伽德罗定律:同温同压下,体积相同的氢气和氩气具有相同的分子数,故B正确;
C.78g过氧化钠的物质的量为1mol,1mol过氧化钠与足量的二氧化碳反应生成0.5mol氧气,转移了1mol电子,转移的电子数为NA,故C正确;
D.氯化镁的物质的量为1L×2mol/L=2mol,则含氯离子为2mol×2×NA=4NA,故D错误;
故答案为D。
5.下列实验装置不能达到实验目的的是( )
A. 验证Na和水反应是否为放热反应:
B. 检验Na2O2与H2O反应有O2生成:
C. 观察纯碱的焰色反应:
D. 比较Na2CO3、NaHCO3的稳定性:
【答案】D
【解析】
【详解】A.钠与水反应放热,气体压强增大,红墨水出现液面差,可以验证,故A不符合题意;
B.Na2O2与H2O反应有O2生成,氧气可以使带火星的木条复燃,可以检验,故B不符合题意;
C.铁丝的焰色反应为无色,可用来做纯碱的焰色反应,故C不符合题意;
D.套装小试管加热温度较低,应将碳酸氢钠应放在套装小试管中,通过澄清水是否变浑浊可证明稳定性,故D符合题意;
故选D。
6.中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果,我国晋代《抱朴子》中描述了大量的化学反应,其中有①“丹砂烧之成水银,积变又成丹砂”;②“以曾青涂铁,铁赤色如铜”,下列有关叙述正确的是( )(已知丹砂化学式为HgS)
A. ①中水银“积变又成丹砂”说明水银发生了还原反应
B. ②中反应的离子方程式为2Fe+3Cu2+=2Fe3++3Cu
C. 根据①可知温度计打破后可以用硫粉覆盖水银,防止中毒
D. 水银能跟曾青发生置换反应生成单质铜
【答案】C
【解析】
【详解】A. ①中水银“积变又成丹砂”说明水银化合价升高,发生了氧化反应,故错误;
B. ②中反应的离子方程式为Fe+Cu2+=Fe2++Cu,故错误;
C. 水银为汞,蒸气有毒,所以根据①可知温度计打破后,可以用硫粉覆盖水银后两者可以化合为硫化汞,防止中毒,故正确;
D. 水银不如铜活泼,故其不能与硫酸铜发生置换生成单质铜,D错误。
故选C。
7.在溶液中,0.2 mol 恰好能使0.4 mol 被完全氧化成,则被还原后X元素的化合价为( )
A. +1 B. +2 C. +3 D. +4
【答案】D
【解析】
【详解】0.2mol X2O72-能使0.4mol SO32-完全氧化成SO42-,S元素的化合价由+4价升高为+6价,则X元素的化合价降低,
设X2O72-被还原后X的化合价为x,
由电子守恒可得:0.2mol×2×(6-x)=0.4
mol×(6-4),
解得x=+4,D项正确,
答案选D。
8.下列对于过氧化钠的叙述中,正确的是
A. 将少量Na2O2投入紫色石蕊溶液中,溶液最终呈蓝色
B. 1 mol Na2O2与H2O完全反应,转移2 mol电子
C. Na2O2和Na2O均属碱性氧化物
D. Na2O2与CO2反应时,Na2O2既作氧化剂,又作还原剂
【答案】D
【解析】
【详解】A.过氧化钠具有强氧化性,可与水反应生成氢氧化钠,则将足量Na2O2投入紫色石蕊试液中,溶液先变蓝后褪色,同时有气泡产生,故A错误;
B.若有2 mol Na2O2参加反应,则转移电子的物质的量为2mol×(1-0)=2 mol,则每1molNa2O2完全反应时转移电子1mol,故B错误;
C. Na2O2为过氧化物,故C错误;
D.Na2O2与CO2或H2O反应过程中,Na2O2中氧元素化合价既升高又降低,Na2O2既是氧化剂又是还原剂,故D正确,
故选:D。
9.超临界状态下的CO2流体溶解性与有机溶剂相似,可提取中药材的有效成分,工艺流程如下。
下列说法中错误的是( )
A. 浸泡时加入乙醇有利于中草药有效成分的浸出
B. 高温条件下更有利于超临界CO2流体萃取
C. 升温、减压的目的是实现CO2与产品分离
D. 超临界CO2流体萃取中药材具有无溶剂残留、绿色环保等优点
【答案】B
【解析】
【详解】A. 中草药中的有效成分是有机物,易溶于乙醇,浸泡时加入乙醇有利于中草药有效成分的浸出,A正确;
B. 温度越低,气体溶解度越大,所以高温条件不利于超临界CO2流体萃取,B错误;
C. 升温、减压的目的是让CO2气化,从而实现CO2与产品分离,C正确;
D. 升温、减压后,CO2全部气化,从而脱离萃取产品,因此,超临界CO2流体萃取中药材具有无溶剂残留、绿色环保等优点,D正确。
故选B。
10.能正确表示下列化学反应的离子方程式的是( )
A. 硫酸铜溶液与氢氧化钡溶液反应:Ba2++=BaSO4↓
B. 将NaHSO4溶液滴入Ba(OH)2溶液中至溶液呈中性:2H+++2OH-+Ba2+=BaSO4↓+2H2O
C. 足量CO2通入澄清石灰水中:2OH-+CO2=H2O+
D. 碳酸氢钙溶液与足量氢氧化钠溶液反应:Ca2+++OH-=CaCO3↓+H2O
【答案】B
【解析】
【详解】A. 硫酸铜溶液与氢氧化钡溶液反应会生成两种沉淀,其正确的离子方程式为:Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓,故A错误;
B. 将NaHSO4溶液滴入Ba(OH)2溶液中至溶液呈中性,溶液中的溶质为硫酸钠,反应的离子方程式为:2H++ SO42-+2OH-+Ba2+=BaSO4↓+2H2O,故B正确;
C. 足量CO2通入澄清石灰水中,生成碳酸氢钙,反应的离子方程式为:CO2+OH-=HCO3-,故C错误;
D. 碳酸氢钙溶液与足量氢氧化钠溶液反应会生成碳酸钠,其离子方程式:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O,故D错误;
答案选B。
【点睛】离子方程式的书写及其正误判断是高考高频考点,贯穿整个高中化学,是学生必须掌握的基本技能。本题重点考查有关“量”的离子方程式的书写正误判断,D项是易错点,可采取“以少定多”原则进行解答,即假设量少的反应物对应的物质的量为1 mol参与化学反应,根据离子反应的实质书写出正确的方程式,一步到位,不需要写化学方程式,可以更加精准地分析出结论。
11.无色透明的某强酸性溶液中能大量共存的离子组是
A. Na+、Mg2+、Cl-、OH- B. Ca2+、K+、Cl-、NO3-
C. Cu2+、K+、SO42-、NO3- D. Na+、HCO3-、OH-、Al3+
【答案】B
【解析】
详解】A. Mg2+和OH-会反应生成氢氧化镁沉淀,故A错误;
B.四种离子相互不反应,且无色,故B正确;
C.含有铜离子的溶液显蓝色,故C错误;
D. HCO3-与OH-反应生成碳酸根和水,OH-和Al3+反应生成沉淀,故D错误;
故答案为B。
12.关于电解质,下列说法正确的是( )
A. 强电解质的水溶液中不存在分子
B. 氨气溶于水能导电,所以氨气是电解质
C. H2SO4是强电解质,但在熔融状态下不能导电
D. 盐酸能导电的原因是溶液在通电作用下产生了自由移动的离子
【答案】C
【解析】
【详解】A. 强电解质在水溶液中完全电离,但溶液中存在大量的水分子,故A错误;
B. 氨气溶于水能导电,是因为氨气与水反应生成一水合氨,一水合氨为弱电解质,不是氨气本身导电,因此氨气是非电解质,故B错误;
C. H2SO4为共价化合物,在水溶液中能够完全电离,但在熔融状态下不能电离出自由移动的离子,故熔融状态下不能导电,但属于强电解质,故C正确;
D. HCl是强电解质,在水溶液中电离出自由移动的离子,其水溶液形成盐酸,该溶液能导电是因为HCl电离出的阴阳离子导电,而电离不需要通电,故D错误;
答案选C。
13.在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得相同物质的量的氧气时,三个反应中转移的电子数之化为( )
A. 1:1:1 B. 2:2:1 C. 2:3:1 D. 4:3:2
【答案】B
【解析】
【分析】
用高锰酸钾、氯酸钾制氧气,反应过程中O由-2价转化为0价,而用过氧化氢制氧气,O则由-1价转化为0价,现要制得相同的O2,所以用过氧化氢制氧气的反应中转移的电子数只有用高锰酸钾、氯酸钾制取的反应中转移的电子数的一半,据此分析作答。
【详解】用高锰酸钾、氯酸钾制氧气,反应过程中O由-2价转化为0价,如生成1mol O2,需转移4mol电子,用过氧化氢制氧气,O则由-1价转化为0价,如生成1mol O2,需转移2mol电子,当制得同温同压下相同体积的氧气时,三个反应中转移的电子数之比为2:2:1,B项符合题意,
答案选B。
14.已知I-、Fe2+、SO2、Cl-、H2O2都有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-