- 564.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
河南省郑州市2017—2018学年高二下学期期末考试
化学试题
相对原子质量:H-1 C-12 N--14 O-16 Na-23 Mg-24 Cl-35.5 Br-80 Ag-108
选择题 共48分
选择题(本题共16小题,每题只有一个选项符合题意,每小题3分,共48分)
1.下列有关生活中常见有机物的叙述正确的是
①多次咀嚼馒头有甜味,此过程中淀粉发生了水解反应
②肥皂的主要成分属于高级脂肪酸盐
③糖类物质均不能使溴水和酸性KMnO4溶液褪色
④天然蛋白质水解的最终产物均为a-氨基酸
A.①②③ B.①②④ C.②③④ D.①③④
2.下列化学用语使用不正确的是
A.羟基的电子式: B.聚丙烯的结构简式:
C.乙酸的实验式:CH2O D.乙烯的结构简式:CH2=CH2
3.下列各组物质中,全部属于纯净物的是
A.福尔马林、酒、醋 B.苯、汽油、无水酒精
C.甘油、乙醇钠、氯仿 D.豆油、丙烯酸、四氯化碳
4.唐·段成式《西阳杂俎·物异》中记载:“石漆,高奴县石脂水,其浮水上,如漆。采以膏车,极迅;燃灯,极明。”这里的“石漆”是指
A.石油 B.油漆 C.煤焦油 D.油脂
5.二甘醇可用作溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命。二甘醇的结构简式是HO--CH2CH2--O--CH2CH2--OH。下列有关二甘醇的叙述正确的是
A.二甘醇的沸点比乙醇低
B.能溶于水,不溶于乙醇
C.1 mol二甘醇和足量Na反应生成1 mol H2
D.二甘醇在NaOH的乙醇溶液中加热能发生消去反应
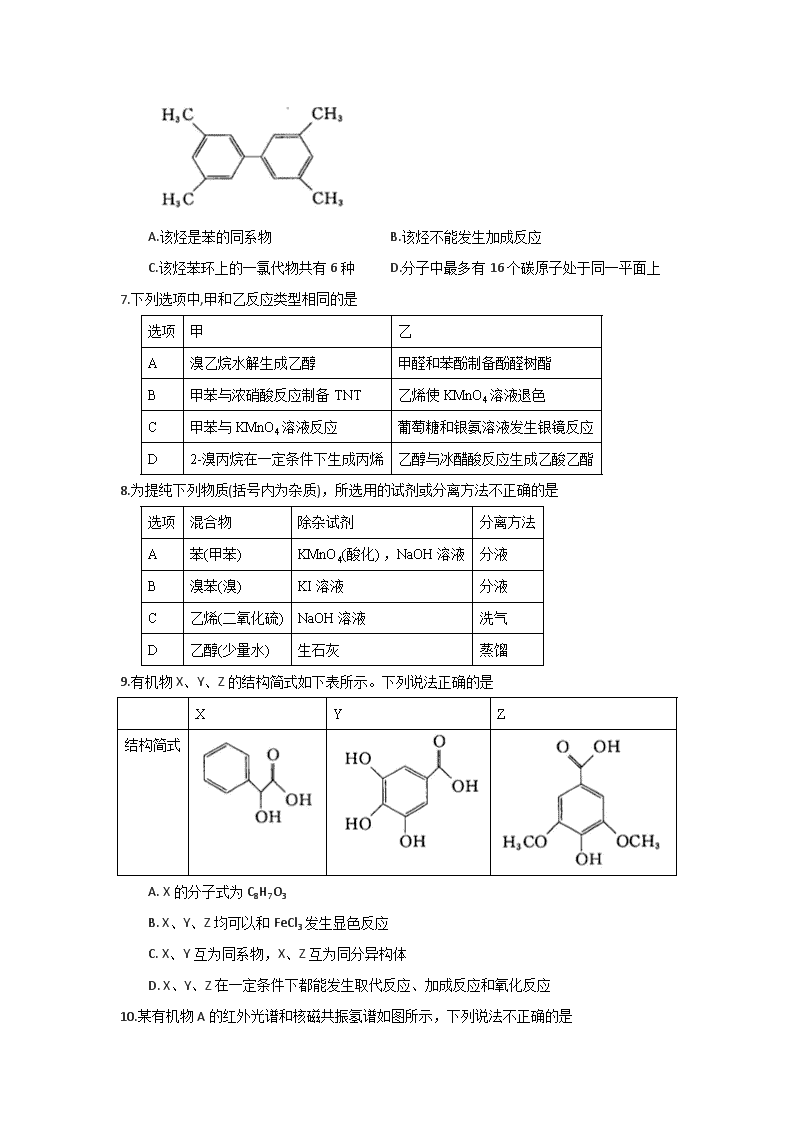
6.某烃的结构简式如右图,下列说法中正确的是
A.该烃是苯的同系物 B.该烃不能发生加成反应
C.该烃苯环上的一氯代物共有6种 D.分子中最多有16个碳原子处于同一平面上
7.下列选项中,甲和乙反应类型相同的是
选项
甲
乙
A
溴乙烷水解生成乙醇
甲醛和苯酚制备酚醛树酯
B
甲苯与浓硝酸反应制备TNT
乙烯使KMnO4溶液退色
C
甲苯与KMnO4溶液反应
葡萄糖和银氨溶液发生银镜反应
D
2-溴丙烷在一定条件下生成丙烯
乙醇与冰醋酸反应生成乙酸乙酯
8.为提纯下列物质(括号内为杂质),所选用的试剂或分离方法不正确的是
选项
混合物
除杂试剂
分离方法
A
苯(甲苯)
KMnO4(酸化) ,NaOH溶液
分液
B
溴苯(溴)
KI溶液
分液
C
乙烯(二氧化硫)
NaOH溶液
洗气
D
乙醇(少量水)
生石灰
蒸馏
9.有机物X、Y、Z的结构简式如下表所示。下列说法正确的是
X
Y
Z
结构简式
A. X的分子式为C8H7O3
B. X、Y、Z均可以和FeCl3发生显色反应
C. X、Y互为同系物,X、Z互为同分异构体
D. X、Y、Z在一定条件下都能发生取代反应、加成反应和氧化反应
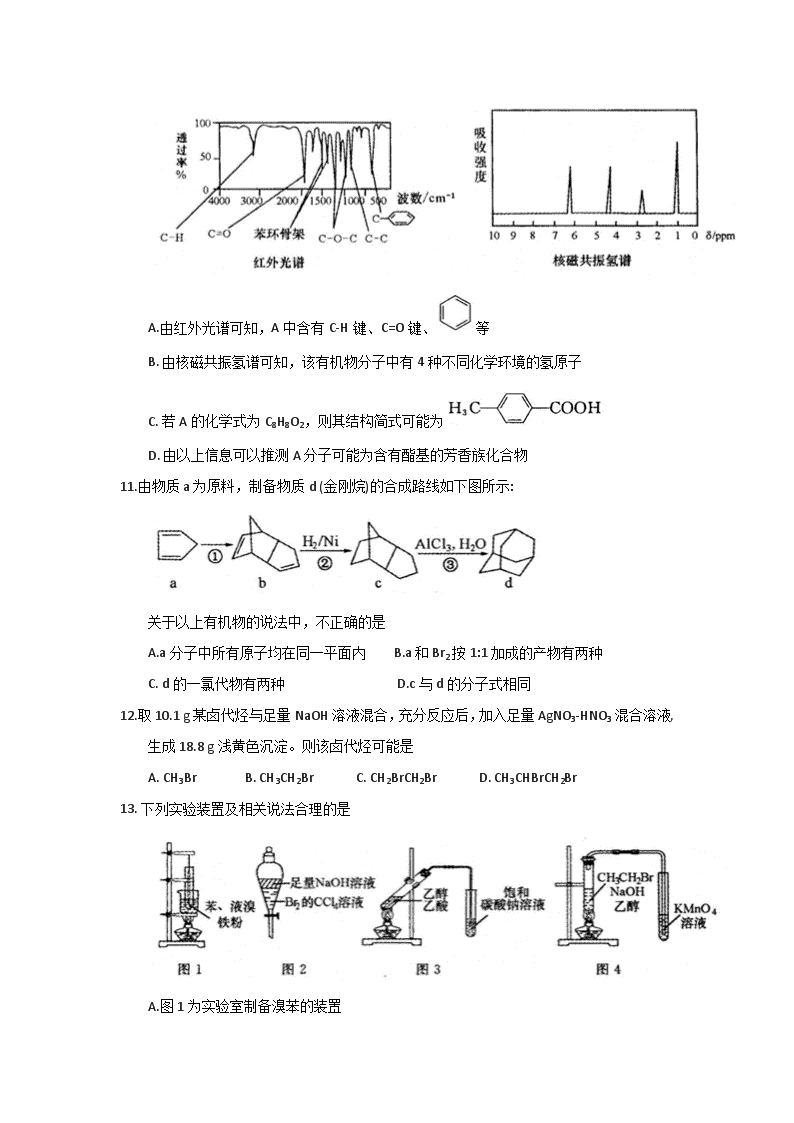
10.某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法不正确的是
A.由红外光谱可知,A中含有C-H键、C=O键、等
B. 由核磁共振氢谱可知,该有机物分子中有4种不同化学环境的氢原子
C. 若A的化学式为C8H8O2,则其结构简式可能为
D. 由以上信息可以推测A分子可能为含有酯基的芳香族化合物
11.由物质a为原料,制备物质d (金刚烷)的合成路线如下图所示:
关于以上有机物的说法中,不正确的是
A.a分子中所有原子均在同一平面内 B.a和Br2按1:1加成的产物有两种
C. d的一氯代物有两种 D.c与d的分子式相同
12.取10.1 g某卤代烃与足量NaOH溶液混合,充分反应后,加入足量AgNO3-HNO3混合溶液,生成18.8 g浅黄色沉淀。则该卤代烃可能是
A. CH3Br B. CH3CH2Br C. CH2BrCH2Br D. CH3CHBrCH2Br
13. 下列实验装置及相关说法合理的是
A.图1为实验室制备溴苯的装置
B.图2中充分振荡后下层为无色
C.用图3所示的实验装置制备乙酸乙酯
D.图4装置中KMnO4溶液退色可证明CH3CH2Br发生了消去反应
14.分子式为C5H12O、且含有2个甲基的醇与分子式为C5H10O2的酸发生酯化反应,得到酯的结构可能有(不包括立体异构)
A.8种 B.16种 C.24种 D.32种
15.下列基团中: -CH3、-OH、-COOH、,任意取两种不同基团结合,组成的有机物最多有
A.3种 B.4种 C.5种 D.6种
16. K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+ H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
结合实验,下列说法正确的是
A.①中溶液变黄,③中溶液橙色加深
B. ②中Cr2O72-被C2H5OH氧化
C. K2Cr2O7在碱性条件下的氧化性比酸性条件更强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为绿色
非选择题 共52分
必做题(本题包括2小题,共20分)
17. (10分)请按要求填空(化学方程式需注明反应条件):
(1) 的系统名法名称是___________。
(2)反-2-丁烯的结构简式___________ 。
(3)分子式为C8H11N的有机物,含有苯环和—NH2结构的同分异构体有_________种。
(4)乙酸乙酯在酸性条件下水解的化学方程式____________ 。
(5)苯乙烯和1,3-丁二烯在一定条件下共聚合成丁苯橡胶的化学方程式___________。
18.(10分)苯乙酸铜是合成纳米氧化铜的重要前驱体之一,可采用苯乙腈()为原料在实验室进行合成。制备苯乙酸的装置如右图(加热和夹持仪器略去)。已知苯乙酸的熔点为76.5℃,微溶于冷水,易溶于乙醇。
在250 mL三口瓶A中加入70 mL质量分数为70%的硫酸和几片碎瓷片,加热至100℃,再缓缓滴入46.8 g苯乙腈,然后升温至130℃,发生反应:
+2H2O+ H2SO4 + NH4HSO4
请回答:
(1)甲同学提出为使反应物受热均匀,可以采取水浴加热。老师否定了这个建议,原因是_______。
(2)乙同学提出装置中缺少温度计,温度计水银球的合理位置是_______。
(3)本实验采用了滴液漏斗。与普通分液漏斗相比,滴液漏斗的优点是_______。
(4)反应结束后需先加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是_______,分离出苯乙酸的操作是_______。
(5)提纯粗苯乙酸最终得到19 g纯品,则苯乙酸的产率是_____%(结果保留整数)。
(6)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后加入Cu(OH)2,搅拌30 min,过滤。滤液静置一段时间可以析出苯乙酸铜晶体。此步骤中用到乙醇的作用是______ ;写出此步发生反应的化学方程式_______。
选做题(以下选做题分为A、B两组,每组试题均包括3个小题,共32分。每位考生只能选做其中的一组,如果多选,按第一组计分。)
A组——[选修3:物质结构与性质](32分)
A-19. (10分)
A、B、C、D、E、G六种元素均为前四周期元素,原子序数依次增大。A原子核外的L层电子数是K层的两倍;C原子核外的最外层中只有两对成对电子,D在元素周期表的各元素中电负性最大,E和C同主族,G是前四周期元素中基态原子未成对电子数最多的元素。
请回答下列问题:
(1)A、B、C的第一电离能从小到大的顺序为_______。(用元素符号表示)
(2)AC2与EC2分子的空间构型分别是_______和_______。相同条件下EC2在水中的溶解度比AC2更大,理由是_______。
(3)用氢键表示式写出D的氢化物在水溶液中存在的任意一种氢键_______。
(4)G的价电子排布式为_______;G 与CO形成的配合物G(CO)6中,1 mol G(CO)6中含有的σ键数目为_________。
(5)和G同周期的铁元素,其单质及其化合物应用广泛。
①某有机铁肥[Fe(H2NCONH2)6] (NO3)3的名称叫三硝酸六尿素合铁,是一种配合物。该配合物中所含的阴离子的空间构型为_____ ,写出一个与该阴离子互为等电子体的分子________。
②氯化亚铁的熔点为674℃,而氯化铁的熔点仅为282℃,二者熔点存在差异的主要原因是________。
A--20. (10分)
在元素周期表中,非金属元素集中于右上角的位置,它们虽然种类少,但其用途却不容小觑。
(1)元素周期表的非金属元素中,属于主族元素的共有________种。
(2)红磷是巨型共价分子、无定型结构。能证明红磷是非晶体的最可靠方法是________。
A.质谱 B.原子发射光谱 C.核磁共振谱 D.X 射线衍射
(3)成语“信口雕黄”中的雌黄分子式为As2S3,分子结构如右图。
其分子中S原子的杂化方式为________。雌黄和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4并放出H2S气体,写出该反应的化学方程式______。
(4)已知pKa=-lgKa。
①有机酸的酸性强弱受邻近碳上取代原子的影响,如酸性: BrCH2COOH >CH3COOH。据此推测,pKa:ClCH2COOH______FCH2COOH(填“>”、“<”、“=”)。
②硼酸(H3BO3)是一元酸,它在水中表现出来的弱酸性,并不是自身电离出H+所致,而是H3BO3与水电离出的OH-结合生成一个酸根离子,请写出该酸根离子的结构简式: ________(若存在配位键,请用箭头标出)。
(5)磷化硼的晶胞模型如右图所示,晶胞参数为a pm,已知B、P的原子半径分别表示为rBpm、rP pm。该晶胞中磷原子的配位数为________,晶体中原子的空间利用率为______ 。
A-21. (12分)
离子晶体是常见的晶体类型。请回答以下问题:
(1)离子晶体中阴阳离子半径之比是决定晶体构型的重要因素之一,配位数与离子半径之比存在如下关系:
已知在某AB型离子化合物中,A+离子的半径为84 pm,B-离子的半径为140 pm。分析以上信息,与A+离子配位的所有B-离子,在空间构成的立体形状为_______。
(2)硫化亚铜和氧化亚铜均为离子晶体,其中熔点较高的为________ (填化学式),原因是________。
(3)向疏酸铜溶液中加入乙二胺(H2N-CH2-CH2-NH2)溶液后,每个Cu2+可与两个乙二胺分子形成四配位离子,导致溶液由蓝色变为紫色。该四配位离子的结构式为_______。
(4)K3C60是由足球烯(C60)与金属钾反应生成的盐。在K3C60晶胞中,C603-堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,K+填充在空隙中。晶胞中被K+占据的空隙百分比为__________。
(5)H和Mg能形成一种离子型储氢材料,晶体结构如右图所示:
则该晶体中Mg的配位数是______,其化学式为________。已知该晶体的密度为ρg·cm-3,晶胞的体积为__________(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
B组- [选修5:有机化学基础](32分)
B- 19.(10分)
小明同学为研究有机物A和B的结构和性质,分别取7.4gA和6.0gB置于密闭容器中完全燃烧,测得有关数据如下:
由以上信息可求出:
(1)A物质的分子式为______。 已知A和金属Na不反应,则其可能的结构有______种。
(2)B物质的最简式为_______。 所有符合该最简式的物质中,相对分子质量最小的物质与酸性高锰酸钾反应的离子方程式为______ 。
(3)相同条件下,相同质量B物质的蒸气所占体积为H2体积的1/30,且B可以发生银镜反应,但不能发生水解反应。写出其结构简式______ 。
(4)若B分子中有3个碳原子,能与NaHCO3反应产生CO2气体,且等效氢的个数比为3:1:1:1,则该物质的系统命名法名称为______ 。
(5)若符合B物质最简式的某物质是生命体中重要的能量物质,在一定条件下可以转化为乙醇,写出该转化反应的化学方程式______。
B- 20. (10分)
已知某有机物A有如下的转化关系:
请结合上述转化关系回答问题:
(1)A的结构简式为_____;M是比A少一个 CH2原子团的芳香族化合物,能发生银镜反应,且M在所有的同分异构体中核磁共振氢谱信号种类最少,则M的结构简式为_______。
(2)A→B的反应类型为_______。
(3)B→C的化学方程式为_______。
(4)C→E的化学方程式为_______ 。
(5)D、F的结构简式分别为_______、_______。
B- -21.(12分)
化合物H是一种有机光电材料中间体。实验室由芳香族化合物A制备H的一种合成路线如下:
已知:
①RCHO+CH3CHORCH=CHCHO+H2O
②
回答下列问题:
(1) 1 mol A完全加成时最多可消耗H2______mol;E的结构简式是_______ 。
(2)F分子中包含的官能团名称是______;D→E的反应类型是______ 。
(3)写出由F生成H的化学方程式_______ 。
(4)芳香族化合物X是F的同分异构体,X能与饱和碳酸氢钠容液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1,则符合要求的X的结构简式有______种。
(5)结合本题信息,仿照上述合成路线,设计由和丙醛合成的流程图:______ (无机试剂任选)。
1.B 2.B 3.C 4.A 5.C 6.D 7.C 8.B 9.D 10.C 11.A 12.D 13.B 14.B 15.C 16.D
17.(10分)
(1)2,3-二甲基-1-戊烯 (2分)(2) (2分)(3)14(2分)
(4) CH3COOCH2CH3+H2OCH3COOH+CH3CH2OH(2分)
(5)(2分)
18.(10分)(1)水浴加热的温度达不到130℃(1分)
(2)放在反应混合液中,但不能接触烧瓶内壁(1分)
(3)三口瓶和滴液漏斗中气压相通,液体能顺利滴下。(1分)
(4)降低温度,减小苯乙酸的溶解度,便于苯乙酸析出(1分)过滤(1分)
(5)35(2分)
(6)促进苯乙酸的溶解,以利于苯乙酸充分反应(1分)
(2分)
A-19.(10分)
(1)C(1分)②(1分)
(5)4 (1分) (2分)
A-21.(12分)(1)正八面体(1分)
(2)Cu2O(1分) 氧离子半径小于硫离子半径,Cu2O的晶格能大于Cu2S(2分)
(3)(2分)
(4)100%(2分)
(5)6(1分) MgH2(1分) (2分)
B-19.(10分)(1)C4H10O(1分) 3(1分)
(2)CH2O (1分) 5HCHO+4MnO4-+12H+=5CO2↑+4Mn2++11H2O(2分)
(3)HOCH2CHO(1分)
(4)2-羟基丙酸(2分)
(5)C6H12O6(葡萄糖) 2CH3CH2OH+2CO2↑(2分)
B-20.(10分)(1)(2分)(1分)
(2)氧化反应(1分)
(3)(2分)
(4)(2分)
(5)或(1分)(1分)
B-21. (12分)(1)4(1分) (1分)
(2)酯基 碳碳三键(2分) 消去反应(1分)
(3)(2分)
(4)4(2分)
(5)(3分)