- 265.59 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第1课时 焓变 反应热
课后篇巩固提升
基础巩固
1.右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混合,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是( )
A.硝酸铵 B.生石灰 C.氯化镁 D.食盐
解析 生石灰与水反应放出大量的热。
答案 B
2.下列过程中,需要吸收能量的是( )
A.钠与水的反应 B.H+ClHCl
C.I2I+I D.S+O2SO2
解析 A中钠与水的反应是放热反应;B中氢原子与氯原子结合生成 HCl分子时,有化学键形成,要放出热量;C项中有化学键的断裂,需要吸收能量;D中S与O2 的反应是放热反应。
答案 C
3.下列说法正确的是( )
A.反应热是1 mol物质参加反应时的能量变化
B.当反应放热时,ΔH>0;反应吸热时,ΔH<0
C.任何条件下,化学反应的焓变都等于化学反应的反应热
D.在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓的差值来决定
解析 一定量的物质在恒压条件下反应所释放或吸收的热量称为反应热,A项错误。当反应放热时,ΔH<0;反应吸热时,ΔH>0,B项错误。只有在恒压条件下,化学反应的焓变才等于化学反应的反应热,C项错误。一个化学反应是吸热反应还是放热反应,取决于生成物和反应物的焓的差值,D项正确。
答案 D
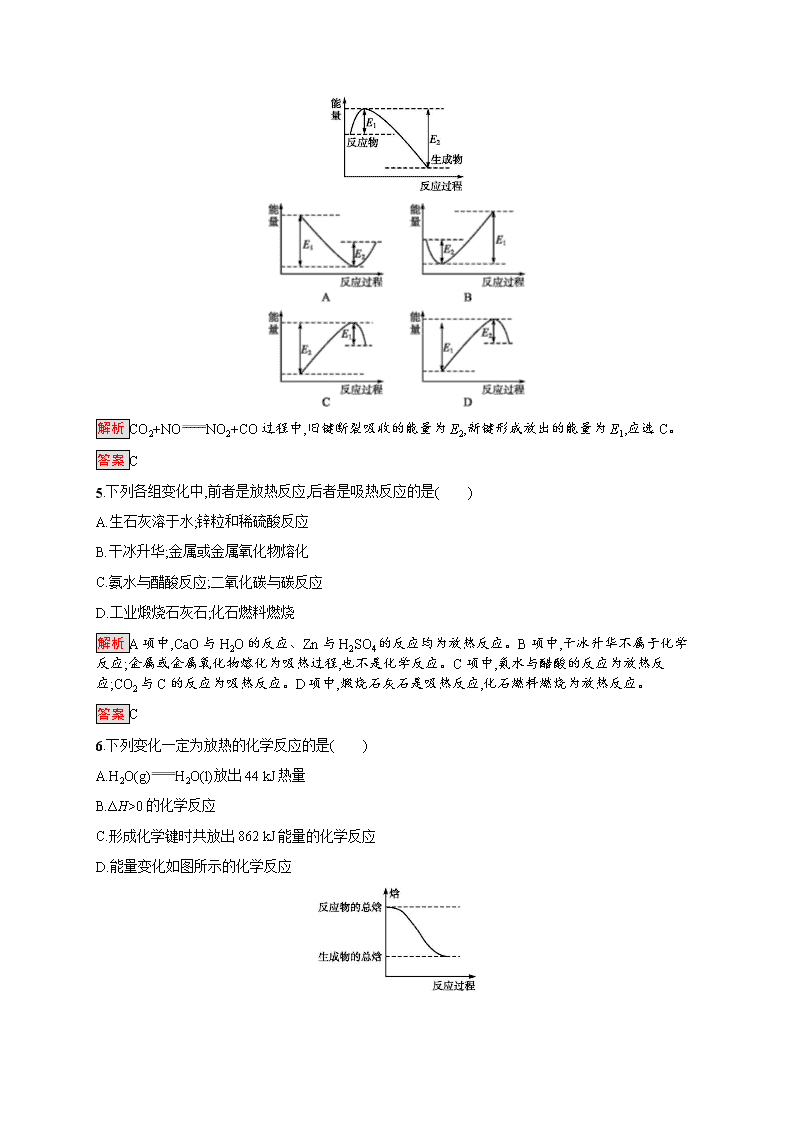
4.下图所示的是1 mol NO2与足量的CO完全反应生成CO2和NO过程中的能量变化。A、B、C、D四个图像中能够表示出CO2+NONO2+CO的能量变化示意图的是( )
解析 CO2+NONO2+CO过程中,旧键断裂吸收的能量为E2,新键形成放出的能量为E1,应选C。
答案 C
5.下列各组变化中,前者是放热反应,后者是吸热反应的是( )
A.生石灰溶于水;锌粒和稀硫酸反应
B.干冰升华;金属或金属氧化物熔化
C.氨水与醋酸反应;二氧化碳与碳反应
D.工业煅烧石灰石;化石燃料燃烧
解析 A项中,CaO与H2O的反应、Zn与H2SO4的反应均为放热反应。B项中,干冰升华不属于化学反应;金属或金属氧化物熔化为吸热过程,也不是化学反应。C项中,氨水与醋酸的反应为放热反应;CO2与C的反应为吸热反应。D项中,煅烧石灰石是吸热反应,化石燃料燃烧为放热反应。
答案 C
6.下列变化一定为放热的化学反应的是( )
A.H2O(g)H2O(l)放出44 kJ热量
B.ΔH>0的化学反应
C.形成化学键时共放出862 kJ能量的化学反应
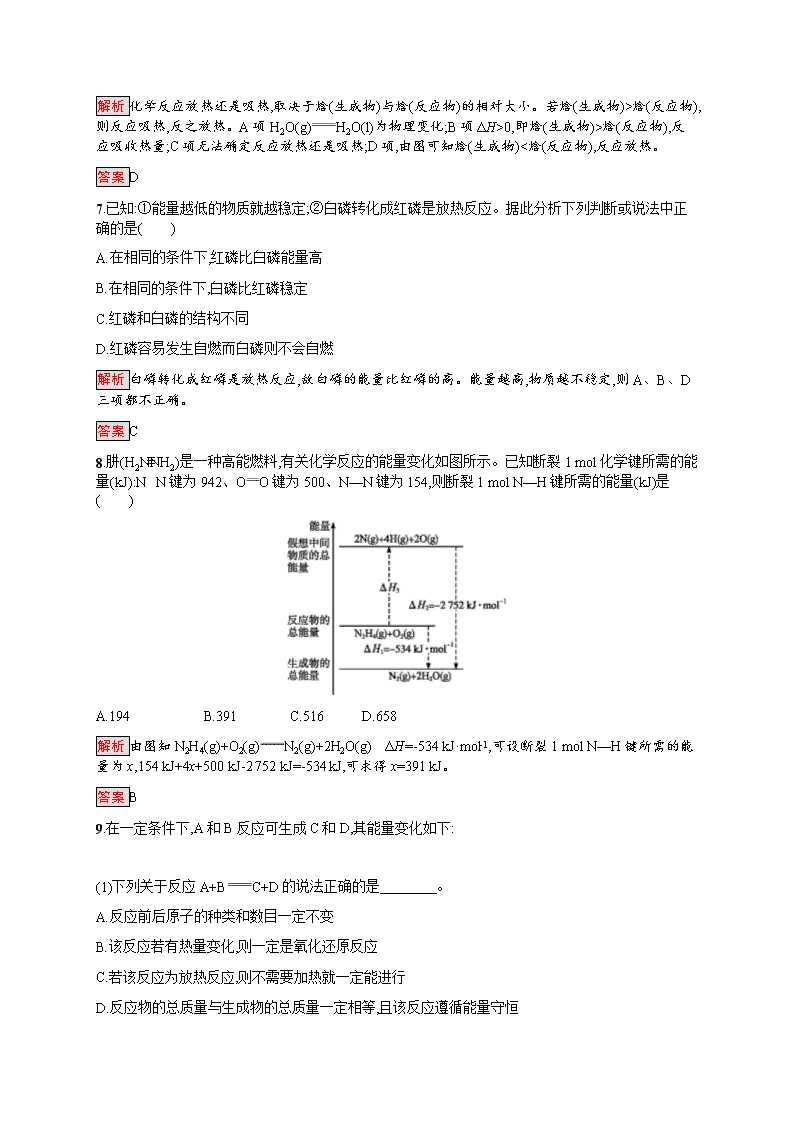
D.能量变化如图所示的化学反应
解析 化学反应放热还是吸热,取决于焓(生成物)与焓(反应物)的相对大小。若焓(生成物)>焓(反应物),则反应吸热,反之放热。A项H2O(g)H2O(l)为物理变化;B项ΔH>0,即焓(生成物)>焓(反应物),反应吸收热量;C项无法确定反应放热还是吸热;D项,由图可知焓(生成物)<焓(反应物),反应放热。
答案 D
7.已知:①能量越低的物质就越稳定;②白磷转化成红磷是放热反应。据此分析下列判断或说法中正确的是( )
A.在相同的条件下,红磷比白磷能量高
B.在相同的条件下,白磷比红磷稳定
C.红磷和白磷的结构不同
D.红磷容易发生自燃而白磷则不会自燃
解析 白磷转化成红磷是放热反应,故白磷的能量比红磷的高。能量越高,物质越不稳定,则A、B、D三项都不正确。
答案 C
8.肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N键为942、OO键为500、N—N键为154,则断裂1 mol N—H键所需的能量(kJ)是( )
A.194 B.391 C.516 D.658
解析 由图知N2H4(g)+O2(g)N2(g)+2H2O(g) ΔH=-534 kJ·mol-1,可设断裂1 mol N—H键所需的能量为x,154 kJ+4x+500 kJ-2 752 kJ=-534 kJ,可求得x=391 kJ。
答案 B
9.在一定条件下,A和B反应可生成C和D,其能量变化如下:
(1)下列关于反应A+BC+D的说法正确的是 。
A.反应前后原子的种类和数目一定不变
B.该反应若有热量变化,则一定是氧化还原反应
C.若该反应为放热反应,则不需要加热就一定能进行
D.反应物的总质量与生成物的总质量一定相等,且该反应遵循能量守恒
(2)若E1”“<”或“=”)1 mol气体 C和1 mol气体D具有的总能量。
解析 从图像中看出反应物的能量低,产物的能量高,题给反应一定为吸热反应。
答案 吸热 E1-E2 <
14.(1)已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态时,含有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如图所示:
若已知硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,S(s)+O2(g)SO2(g) ΔH=-a kJ·mol-1,则S8分子中硫硫键的键能为 。
(2)下表是部分化学键的键能数据:
化学键
P—P
P—O
OO
PO
键能/(kJ·mol-1)
198
360
498
x
①已知白磷的燃烧热为2 982 kJ·mol-1,白磷(P4)、P4O6、P4O10结构如图所示,则上表中x= 。
②0.5 mol白磷(P4)与O2完全反应生成固态P4O6,放出的热量为 kJ。
解析 (1)设硫硫键的键能为x kJ·mol-1,则:
-a kJ·mol-1=×8×x kJ·mol-1+e kJ·mol-1-2d kJ·mol-1,x=2d-a-e。
(2)①由题意可知P4(s)+5O2(g)P4O10(s) ΔH=-2 982 kJ·mol-1。根据图示知,1 mol P4含有6 mol P—P键,1 mol P4O10含12 mol P—O键和4 mol PO键,根据反应热等于反应物总键能与生成物总键能之差,断裂1 mol共价键吸收的能量与生成1 mol该共价键放出的能量数值相等,则198 kJ·mol-1×6+498 kJ·mol-1×5-360 kJ·mol-1×12-4x kJ·mol-1=-2 982 kJ·mol-1,x=585。②P4+3O2P4O6,
1 mol P4O6含有12 mol P—O键,反应热为ΔH=198 kJ·mol-1×6+498 kJ·mol-1×3-360 kJ·mol-1×12=-1 638 kJ·mol-1,则0.5 mol白磷(P4)与O2完全反应生成固态P4O6放出的热量为1 638 kJ·mol-1×0.5 mol=819 kJ。
答案 (1)2d-a-e (2)①585 ②819
相关文档
- 试题君之课时同步君2016-2017学年2021-07-0610页
- 试题君之课时同步君2016-2017学年2021-07-0613页
- 2020学年高二化学人教版选修4练习 2021-07-057页
- 试题君之课时同步君2016-2017学年2021-07-0511页
- 2019-2020学年高二化学人教版选修42021-07-055页
- 试题君之课时同步君2016-2017学年2021-07-0513页
- 2019-2020学年高二化学人教版选修42021-07-038页
- 2019-2020学年高二化学人教版选修42021-07-038页
- 2019-2020学年高二化学人教版选修42021-07-035页
- 2020学年高二化学人教版选修4练习 2021-07-035页