- 68.00 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
物质结构 元素周期律
1.2016年命名第七周期ⅦA元素Ts为钿(tián)。下列利用元素周期律的相关推测错误的是( )
A.Ts为金属元素
B.原子半径:Ts>Br>O
C.Ts的主要化合价:-1、+7
D.酸性:HClO4>HTsO4
答案 C
解析 根据题目中Ts的汉字名称,第七周期ⅦA元素Ts应为金属,A正确;电子层数越多,原子半径越大,故原子半径:Ts>Br>O,B正确;Ts为金属元素,没有负价,C错误;元素非金属性越强,其最高价氧化物的水化物的酸性越强,故酸性:HClO4>HTsO4,D正确。
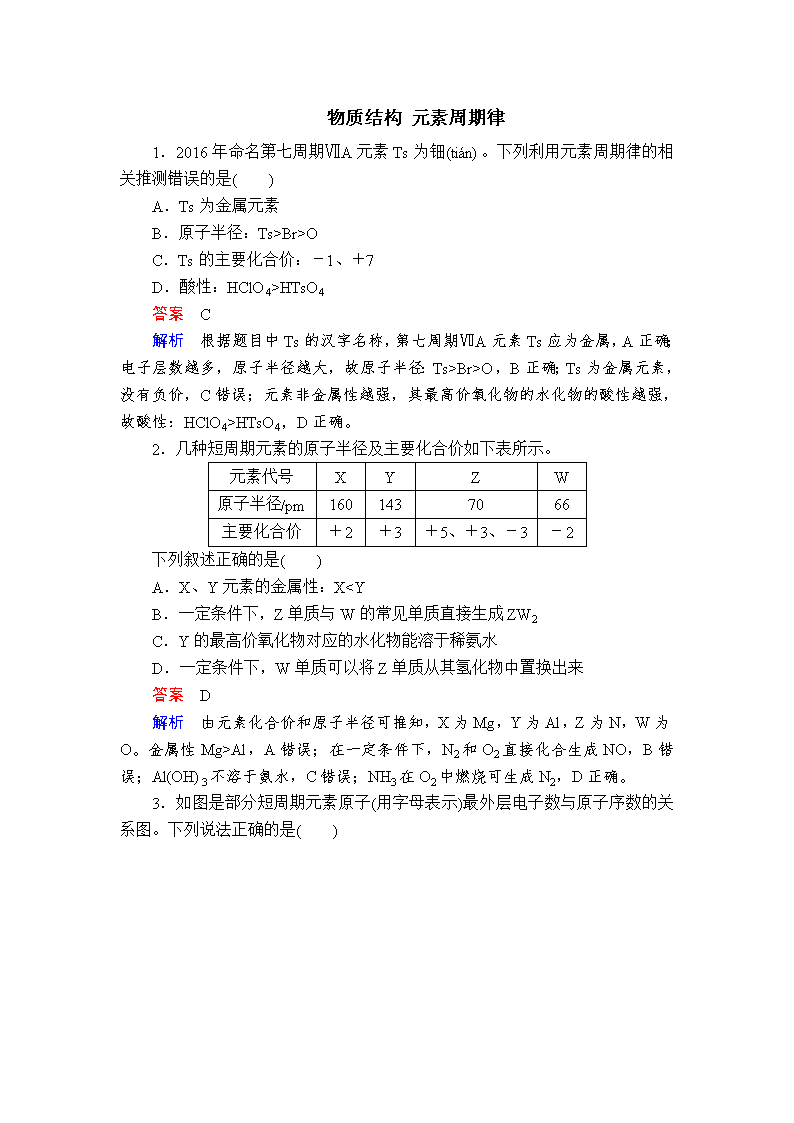
2.几种短周期元素的原子半径及主要化合价如下表所示。
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
下列叙述正确的是( )
A.X、Y元素的金属性:XAl,A错误;在一定条件下,N2和O2直接化合生成NO,B错误;Al(OH)3不溶于氨水,C错误;NH3在O2中燃烧可生成N2,D正确。
3.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是( )
A.X和R在同一周期
B.原子半径:W>R>X
C.气态氢化物的稳定性:X>Y
D.X、Z形成的化合物中可能含有共价键
答案 D
解析 由题给关系图,推出X为O,Y为F,Z为Na,R为S,W为Cl。O和S不在同一周期,A错误;同周期主族元素从左到右,原子半径依次减小,则原子半径S>Cl,B错误;非金属性越强,对应的气态氢化物越稳定,则稳定性HF>H2O,C错误;X、Z形成的Na2O2中含有共价键,D正确。
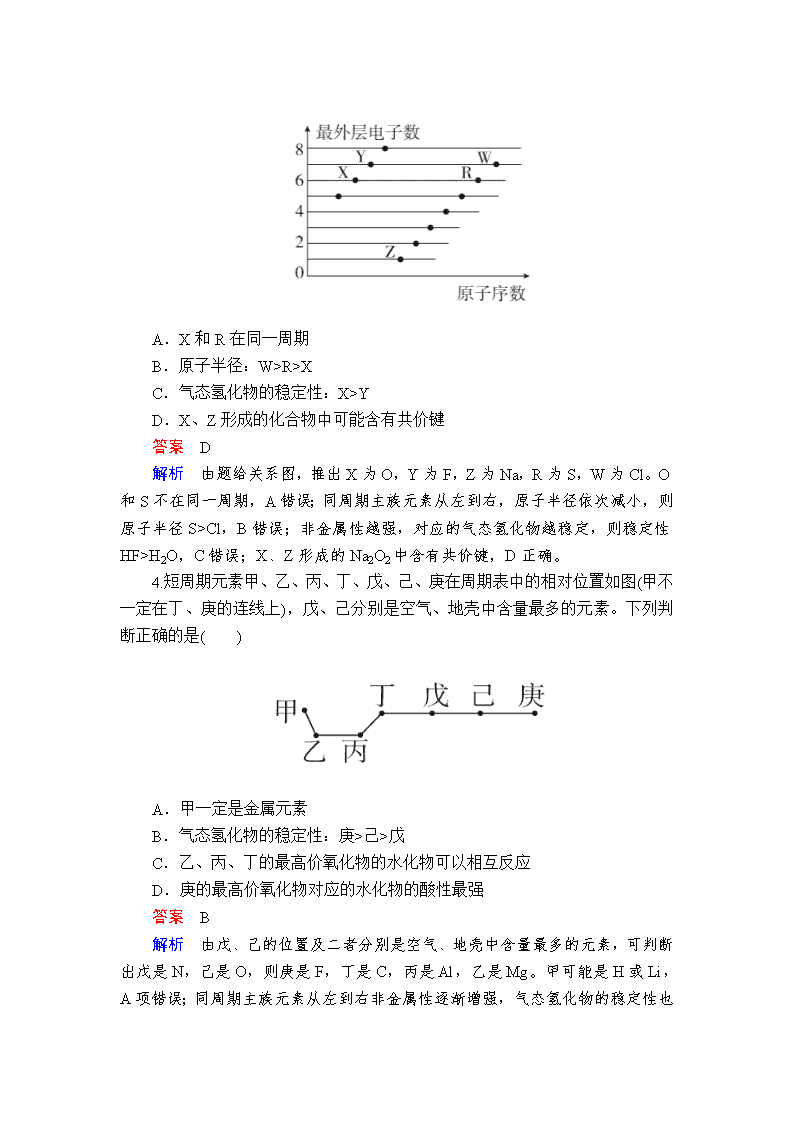
4.短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素。下列判断正确的是( )
A.甲一定是金属元素
B.气态氢化物的稳定性:庚>己>戊
C.乙、丙、丁的最高价氧化物的水化物可以相互反应
D.庚的最高价氧化物对应的水化物的酸性最强
答案 B
解析 由戊、己的位置及二者分别是空气、地壳中含量最多的元素,可判断出戊是N,己是O,则庚是F,丁是C,丙是Al,乙是Mg。甲可能是H或Li,A项错误;同周期主族元素从左到右非金属性逐渐增强,气态氢化物
的稳定性也增强,B项正确;Mg(OH)2、Al(OH)3与H2CO3之间两两不能发生反应,C项错误;F是最活泼的非金属元素,没有含氧酸,D项错误。
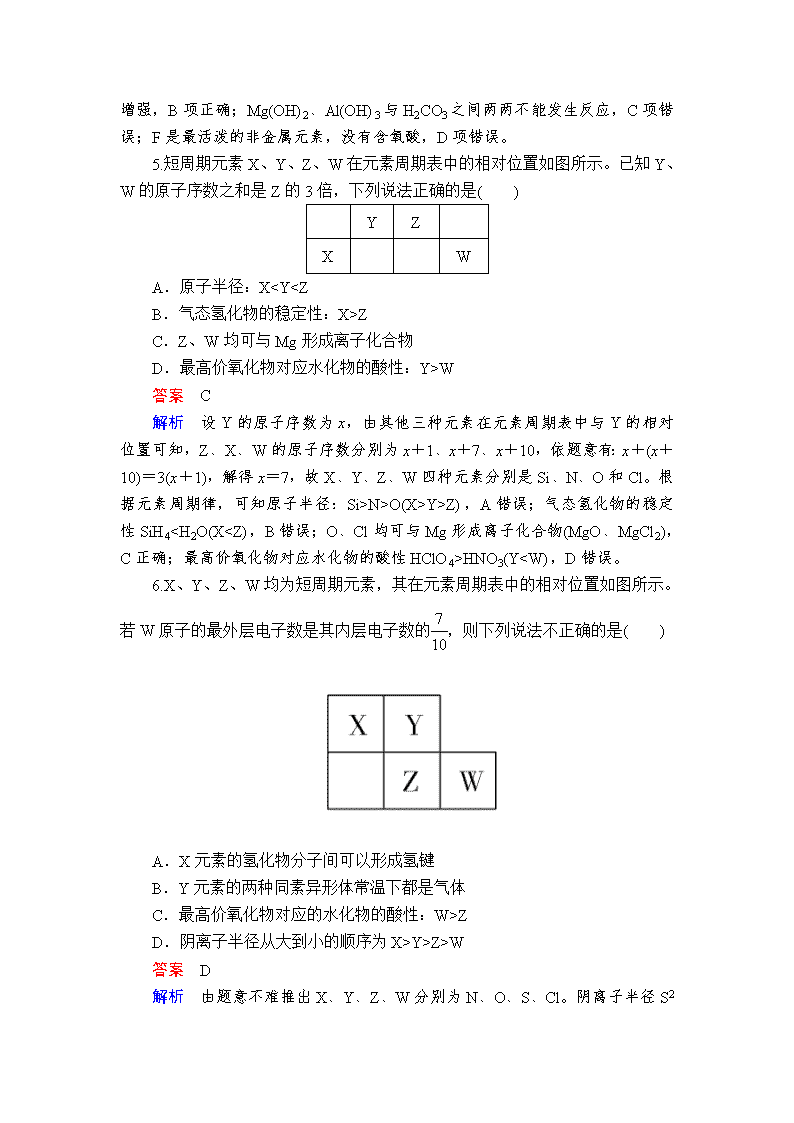
5.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
Y
Z
X
W
A.原子半径:XZ
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
答案 C
解析 设Y的原子序数为x,由其他三种元素在元素周期表中与Y的相对位置可知,Z、X、W的原子序数分别为x+1、x+7、x+10,依题意有:x+(x+10)=3(x+1),解得x=7,故X、Y、Z、W四种元素分别是Si、N、O和Cl。根据元素周期律,可知原子半径:Si>N>O(X>Y>Z),A错误;气态氢化物的稳定性SiH4HNO3(YZ
D.阴离子半径从大到小的顺序为X>Y>Z>W
答案 D
解析 由题意不难推出X、Y、Z、W分别为N、O、S、Cl。阴离子半径S2->Cl->N3->O2-,D错误。
7.短周期主族元素X、Y、Z的单质m、n、p在通常状况下均为气态,并有下列转化关系(反应条件略去):
其中双原子单质分子中,单质m含共用电子对数最多,甲含有10个电子,乙含有18个电子。下列说法正确的是( )
A.X是同周期中非金属性最强的元素
B.元素X、Y、Z的原子半径大小关系为XN>H,故B错误;应是最高价氧化物对应水化物的酸性,故C错误;丙为NH4Cl,NH和Cl-之间是离子键,NH中N和H之间是共价键,故D正确。
8.X、Y、Z、Q均为短周期元素,原子序数依次增大,X、Y是组成空气的主要元素,Y2-与Z+核外电子排布相同,Q的原子序数为Y的2倍。下列说法正确的是( )
A.X、Y形成的常见化合物是大气污染物
B.Y和Z可形成阴、阳离子个数比为1∶1和1∶2的两种离子化合物
C.Y、Q的气态氢化物的热稳定性:Q>Y
D.X、Y、Q最高价氧化物的水化物的酸性:X>Y>Q
答案 A
解析 由题给条件推出X、Y、Z、Q依次为:N、O、Na、S。N和O形成的常见氧化物是NO、NO2,A正确;O和Na可形成两种离子化合物Na2O、Na2O2,二者的阴、阳离子个数比都是1∶2,B错误;非金属性越强,简单气态氢化物的热稳定性越强,故O、S的气态氢化物的热稳定性:H2O>H2S,C错误;Y为O,没有最高价氧化物,D错误。
9.a、b、c、d、e为原子序数依次增大的短周期主族元素,a原子核外的电子总数与b原子次外层电子数相同;c所在周期数与族序数相同;d与a同族。下列叙述正确的是( )
A.含氧酸的酸性:e>d
B.原子半径:b>c>d>a
C.由a和b两种元素形成的化合物不可能含共价键
D.b、c元素对应的最高价氧化物的水化物之间不可能发生反应
答案 B
解析 五种元素均为短周期主族元素,根据“a原子核外的电子总数与b原子次外层电子数相同”,推知a为O,b位于第三周期;结合“d与a同族”,推知d为S,根据原子序数关系推知e为Cl;根据“c所在周期数与族序数相同”及c位于第三周期,推知c为Al,结合b的原子序数在a、c之间,推知b为Na或Mg。没有说最高价含氧酸,HClO的酸性比H2SO4的弱,A项错误;Na(或Mg)、S、Al为第三周期元素,O为第二周期元素,故原子半径:Na(或Mg)>Al>S>O,B项正确;b可以为Na或Mg,Na与O形成的化合物Na2O2中含共价键,C项错误;b可以为Na或Mg,b为Na时,Na、Al对应的最高价氧化物的水化物NaOH、Al(OH)3之间能发生反应,D项错误。