- 365.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1.(2013·苏州高二检测)某地在整顿音像市场的活动中,查获了一大批盗版光盘,并进行了“绿色销毁”。以下做法中,属于“绿色销毁”的是( )
A.泼上汽油焚烧
B.倾倒入江河中
C.深埋于土中
D.碾压粉碎后再回收利用
【解析】 A项中,泼上汽油焚烧,浪费能源,并产生污染大气的气体;B项中,倾倒入江河中,会造成水污染;C项中深埋于土中,会造成土壤污染;D项中,碾压粉碎后再回收利用可节约资源,实现循环利用,同时减少污染。
【答案】 D
2.在下列制备环氧乙烷的反应中,最符合“绿色化学”思想的是( )
【答案】 C
3.下图是SO2性质的微型实验,在注射器中加入少量Na2SO3晶体,并吸入少量的浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
A.蓝色石蕊试纸先变红后褪色
B.蘸有KMnO4溶液的滤纸褪色,证明了SO2的漂白性
C.品红试纸褪色,证明了SO2的漂白性
D.蘸有酚酞和NaOH溶液的滤纸褪色,证明了SO2的漂白性
【解析】 SO2能使湿润的蓝色石蕊试纸变红,但不能漂白,A错;SO2使KMnO4溶液因氧化还原反应褪色,B错;蘸有酚酞和NaOH溶液的滤纸褪色,证明了SO2为酸性氧化物,D错。
【答案】 C
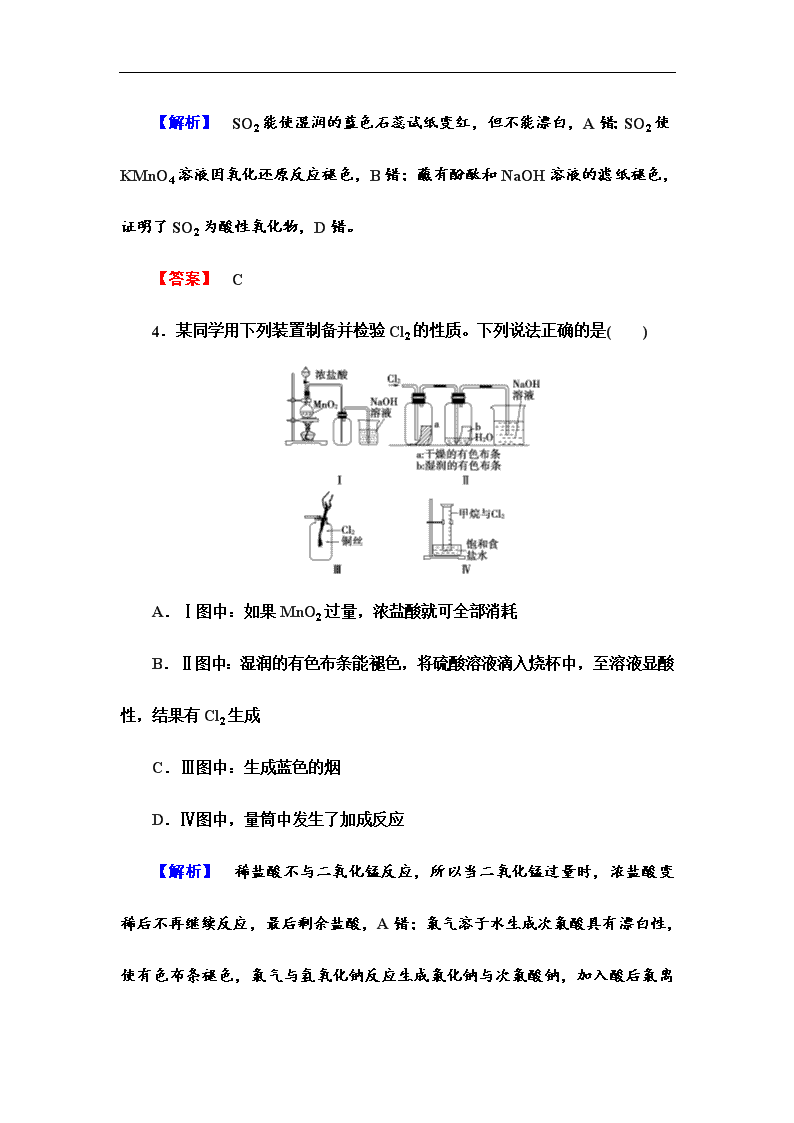
4.某同学用下列装置制备并检验Cl2的性质。下列说法正确的是( )
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
B.Ⅱ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中,量筒中发生了加成反应
【解析】 稀盐酸不与二氧化锰反应,所以当二氧化锰过量时,浓盐酸变稀后不再继续反应,最后剩余盐酸,A错;氯气溶于水生成次氯酸具有漂白性,使有色布条褪色,氯气与氢氧化钠反应生成氯化钠与次氯酸钠,
加入酸后氯离子与次氯酸根离子发生反应生成氯气,B对;铜在氯气中燃烧生成棕色的烟,C错;甲烷与氯气发生取代反应,D错。
【答案】 B
5.(2013·揭阳高二检测)湿润的蓝色石蕊试纸接触氯气后,其颜色变化为( )
A.变红 B.先变红后变白
C.变白 D.不变
【解析】 氯气溶于水生成HCl和HClO,其中HCl可使蓝色石蕊试纸变红,而HClO又具有漂白作用,故先变红后变白。
【答案】 B
6.(2011·北京高考)下列与处理方法对应的反应方程式不正确的是( )
A.用Na2S去除废水中的Hg2+:Hg2++S2-HgS↓
B.用催化法处理汽车尾气中的CO和NO:
CO+NOC+NO2
C.向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2OAl(OH)3(胶体)+3H+
D.用高温催化氧化法去除烃类废气(CxHy):
CxHy+(x+)O2xCO2+H2O
【解析】 A项S2-可与Hg2+结合生成沉淀,从而除去Hg2+,故A正确;B项反应应为2CO+2NO催化剂,F2CO2+N2,故B错误;C项是铝离子水解生成氢氧化铝胶体,水解反应的方程式为Al3++3H2OAl(OH)3(胶体)+ 3H+,故C正确;D项是烃燃烧的化学反应方程式的通式,故D正确。
【答案】 B
7.两位同学根据电解原理,利用塑料瓶、9 V电池、大头针进行电解污水的实验。实验装置如下图。
根据上图回答下列问题:
(1)根据电浮选凝聚法处理污水的净化原理写出阳极区和阴极区上各自的电极反应式:
阳极:_________________________________________________;
阴极:______________________________________________。
(2)试分析不能参加反应的污物是如何沉淀的:______________________________________________。
(3)最后悬浮物为什么会形成浮渣:_______________________________________________。
(4)甲同学模拟该原理进行污水处理实验,在电压符合要求的情况下,发现产生气泡速度缓慢,无法使悬浮物形成浮渣。其原因是______________________________________________。
乙同学为甲同学提出一种切实可行的解决措施是向污水中加入适量的__________溶液。
【解析】 其原理是与电源正极相连的大头针(Fe)失去电子生成Fe2+,进一步氧化,并生成Fe(OH)3胶体,Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化作用;与电源负极相连的阴极产生H2,气泡把污水中的悬浮物带到水面形成浮渣。溶液导电性强弱与气泡产生的速度即电解的快慢有关,电解质溶液导电性差,电解速度慢,则产生气泡速度慢。电解质溶液导电性与自由移动的阴、阳离子浓度有关,离子浓度低,导电性差,电解时产生的气泡慢。所以应增加电解质溶液中的离子浓度,如加Na2SO4。
【答案】 (1)阳极:Fe-2e-Fe2+、2H2O-4e-4H++O2↑、4Fe2++10H2O+O24Fe(OH)3↓+8H+ 阴极:2H++2e-H2↑
(2)与电源正极相连的大头针(Fe)作为阳极,电解时生成Fe2+,Fe2+再被氧化生成Fe3+,Fe3+水解生成Fe(OH)3胶体,Fe(OH)3具有吸附性,可将污染物吸附而沉淀下来
(3)阴极产生H2气泡,气泡把污水中的悬浮物带到水面形成浮渣层
(4)污水中离子浓度较小,导电能力较差 Na2SO4
8.斯坦福大学B.M.Trost教授提出了绿色化学的核心概念——原子经济性。我们常用原子利用率来衡量化学反应过程的原子经济性,其计算公式为:原子利用率=×100%
下面是新型自来水消毒剂ClO2的四种生产方法,请填空:
(1)氯酸钠和盐酸法:本方法的方程式为2NaClO3+4HCl2NaCl+2ClO2↑+Cl2↑+2H2O,此方法的原子利用率为________%(保留一位小数,下同)。
(2)电解亚氯酸钠法:本方法是用惰性电极电解亚氯酸钠溶液,原子利用率为62.2%,其阳极电极反应式为:ClO-e-ClO2,阴极电极反应式为_______________。
(3)亚氯酸钠和氯气法:本方法的原子利用率为53.6%,此反应的化学方程式为____________________。
(4)联合工艺法:本方法的反应原理由三步组成:
①电解氯化钠溶液NaCl+3H2ONaClO3+3H2↑
②氢气和氯气合成氯化氢
③生成二氧化氯2NaClO3+4HCl2NaCl+2ClO2↑+Cl2↑+2H2O此方法的原子利用率最大为________%。
【解析】 (1)根据题意,原子利用率为2×67.5÷(2×106.5+36.5×4)×100%=37.6%。
(3)根据氧化还原反应,可写出2NaClO2+Cl22NaCl+2ClO2,然后用原子利用率检验化学方程式。
(4)由该过程三个化学方程式可整理出总化学方程式:Cl2+4H2O2ClO2+4H2,原子利用率最大可为2×67.5÷(71+72)×100%=94.4%。
【答案】 (1)37.6 (2)2H++2e-H2↑(或2H2O+2e-H2↑+2OH-)
(3)2NaClO2+Cl22NaCl+2ClO2 (4)94.4