- 410.80 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
题型一 水的电离、Kw的计算及应用
1.水的电离平衡曲线如图所示,下列说法中正确的( )
A.图中a、b、d三点处Kw间的关系:b>a>d
B.100 ℃,向pH=2的稀硫酸中逐滴加入等体积pH=10的稀氨水,溶液中c(NH)/c(NH3·H2O)减小,充分反应后,溶液到达b点
C.温度不变,在水中加入适量NH4Cl固体,可从a点变化到c点
D.加热浓缩a点所示溶液,可从a点变化到b点
2.(2018·厦门模拟)常温下,向20 mL某浓度的硫酸溶液中滴入0.1 mol·L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是( )
A.V=40
B.c点所示溶液中:c(H+)-c(OH-)=2c(NH3·H2O)
C.NH3·H2O的电离常数K=10-4
D.d点所示溶液中:c(NH)=2c(SO)
3.(2019·合肥一中质检)一定温度下,某电解质水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )
A.升高温度,可引起c点向b点变化
B.该温度下,往溶液中加水,a点所有离子浓度都降低
C.该温度下,加入CH3COONa可能引起由b点向c点变化
D.该温度下,稀释该溶液可能引起由c点向d点变化
题型二 pH大小判断及计算
4.(2018·海口中学高三调研)下列实验现象或结果不能证明一元酸HR为弱酸的是( )
A.向HR溶液中滴加紫色石蕊溶液,溶液变红色
B.室温时,NaR溶液的pH大于7
C.向HR溶液中加入少量NaR固体,溶解后溶液的pH变大
D.室温时,0.01 mol·L-1HR溶液的pH=4
5.(2018·安徽示范高中联考)有①NaOH溶液 ②Na2CO3溶液 ③CH3COONa溶液各10 mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是( )
A.三种溶液pH的大小顺序是①>③>②
B.三种溶液中由水电离出的OH-浓度大小顺序是①>②>③
C.若将三种溶液稀释相同倍数,pH变化最大的是③
D.若分别加入10 mL 0.1 mol·L-1盐酸后,pH最大的是②
6.(2018·北京石景山质检)室温时,M(OH)2(s)M2+(aq)+2OH-(aq) Ksp=a。c(M2+)=b mol·L-1时,溶液的pH等于( )
A.lg B.lg
C.14+lg D.14+lg
7.(2018·上海市普陀区模拟)常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是( )
A.b不可能显碱性 B.b可能显酸性或碱性
C.a不可能显酸性 D.a一定显碱性
8.25 ℃,某浓度的盐酸、氯化铵溶液中由水电离出的氢离子浓度分别为1.0 ×10-a mol·L-1、1.0×10-b mol·L-1,这两种溶液的pH之和为( )
A.14-a+b B.14+a+b
C.14-a-b D.14+a-b
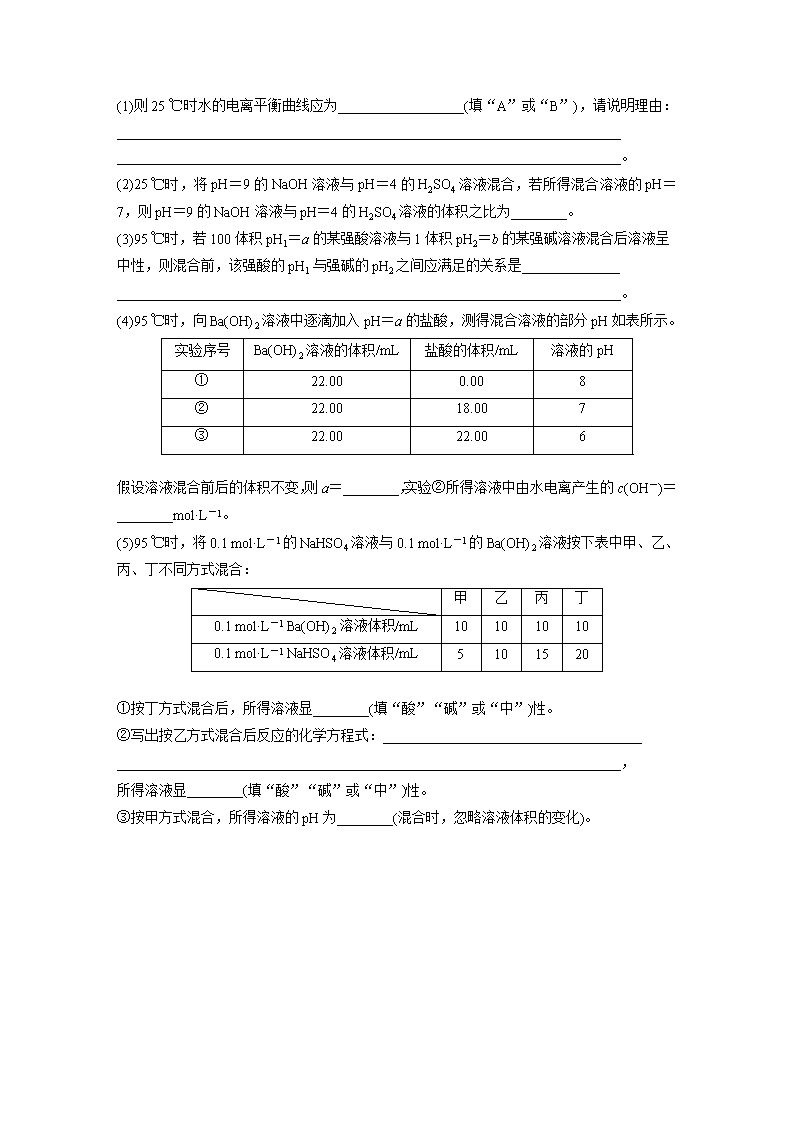
9.已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示:
(1)则25 ℃时水的电离平衡曲线应为__________________(填“A”或“B”),请说明理由:________________________________________________________________________
________________________________________________________________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是______________
________________________________________________________________________。
(4)95 ℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
实验序号
Ba(OH)2溶液的体积/mL
盐酸的体积/mL
溶液的pH
①
22.00
0.00
8
②
22.00
18.00
7
③
22.00
22.00
6
假设溶液混合前后的体积不变,则a=________,实验②所得溶液中由水电离产生的c(OH-)=________mol·L-1。
(5)95 ℃时,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲
乙
丙
丁
0.1 mol·L-1 Ba(OH)2溶液体积/mL
10
10
10
10
0.1 mol·L-1 NaHSO4溶液体积/mL
5
10
15
20
①按丁方式混合后,所得溶液显________(填“酸”“碱”或“中”)性。
②写出按乙方式混合后反应的化学方程式:_____________________________________
________________________________________________________________________,
所得溶液显________(填“酸”“碱”或“中”)性。
③按甲方式混合,所得溶液的pH为________(混合时,忽略溶液体积的变化)。
答案精析
1.D
2.D [c点水的电离程度最大,说明此时c(NH)最大,对水的电离促进程度最大,氨水与硫酸恰好完全反应生成(NH4)2SO4,氨水体积为0 mL时,水电离出c(H+)=1×10-13 mol·L-1,水电离出的c(OH-)=1×10-13 mol·L-1,溶液中的c(H+)=0.1 mol·L-1,c(H2SO4)=0.05 mol·L-1,消耗氨水的体积也是20 mL,即V=20,A项错误;c点所示溶液是(NH4)2SO4溶液,由质子守恒得:c(H+)-c(OH-)=c(NH3·H2O),B项错误;根据题意,无法判断NH3·H2O的电离常数的大小,C项错误;根据电荷守恒:c(H+)+c(NH)=2c(SO)+c(OH-),而溶液呈中性c(OH-)=c(H+),所以c(NH)=2c(SO),D项正确。]
3.C [升高温度,水的电离程度增大,水的离子积常数增大,而b点、c点水的离子积常数相等,A项错误;a点为酸性溶液,往溶液中加水,c(H+)减小,而水的离子积常数不变,则c(OH-)增大,B项错误;b点为中性溶液,加入CH3COONa,c(H+)减小,c(OH-)增大,溶液呈碱性,可使溶液由b点向c点变化,C项正确;c点和d点的温度不同,稀释不会引起由c点向d点的变化,D项错误。]
4.A
5.D [A项,等浓度时NaOH的pH最大,CO的水解程度大于CH3COO-的,所以三种溶液pH的大小顺序是①>②>③,错误;B项,碱会抑制水的电离,能水解的盐会促进水的电离,且水解程度越大,对水的电离的促进程度也越大,故三种溶液中由水电离出的OH-浓度大小顺序是②>③>①,错误;C项,若将三种溶液稀释相同倍数,pH变化最大的是①,因为加水稀释会促进CO、CH3COO-的水解,错误;D项,分别加入10 mL 0.1 mol·L-1盐酸后,①中溶质为NaCl,②中溶质为NaHCO3、NaCl,③中溶质为NaCl、CH3COOH,HCO水解显碱性,所以pH最大的是②,正确。]
6.C [根据溶度积常数的表达式可知,c(OH-)= mol·L-1= mol·L-1,结合水的离子积可得:c(H+)= mol·L-1=10-14 mol·L-1,
则pH=-lg c(H+)=14+lg ,C项正确。]
7.A [pH=3的酸未明确是强酸、还是弱酸。如为强酸:a为碱性,b为中性;如为弱酸:a则要看与氨水的相对强弱,酸强碱弱呈碱性,酸碱相当呈中性,酸弱碱强显酸性,b呈酸性。]
8.A [盐酸中水电离出的H+与溶液中的OH-浓度相同,故该浓度的盐酸中c(H+)=
mol·L-1=1.0×10-14+amol·L-1,故其pH=14-a;氯化铵溶液中H+完全来自水的电离,即c(H+)=1.0×10-bmol·L-1,故其pH=b,因此两种溶液的pH之和为14-a+b,即A项正确。]
9.(1)A 水的电离是吸热过程,温度较低时,电离程度较小,c(H+)、c(OH-)均较小
(2)10∶1
(3)a+b=14(或pH1+pH2=14)
(4)4 1.0×10-7
(5)①中 ②Ba(OH)2+NaHSO4===BaSO4↓+H2O+NaOH 碱 ③11