- 351.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019年10月月考高二化学试题
时间:90分钟 满分:100分
可能用到的相对原子质量 H 1 C 12 O 16 Na 23 Cu 64 Ag 108
第Ⅰ卷 选择题 共48分
一、单选题(本大题共16小题,共48分)
1. 下列说法或表示方法中正确的是( )
A. 等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多
B. 氢气的燃烧热为 ,则氢气燃烧的热化学方程式为:
C.
D. 已知中和热为 ,若将含 mol 的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于 kJ
2. 反应C(s)+CO2(g)=2CO(g)在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
①增加少量C(s) ②升高温度
③体积不变,再通入CO2 ④缩小体积增大压强
⑤体积不变,再通入He ⑥压强不变,再通入He
A. B. C. D.
3. 可逆反应:在密闭容器反应,达到平衡状态的标志是
单位时间内生成的同时生成
单位时间内生成的同时生成2nmolNO
用、NO、的物质的量浓度变化表示反应速率的比为的状态
混合气体的颜色不再改变的状态
混合气体的平均相对分子质量不再改变的状态
A. B. C. D.
4. 图中表示2NO(g)+O2(g)⇌2NO2(g)△H<0,能正确反映该可逆反应变化的图象是( )
A. B. C. D.
1. 某容积为1L的密闭容器中通入1mol CO2和3mol H2,发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H<0.下列有关说法正确的是( )
A. 该反应在高温下才能自发进行
B. 再加入一定量,则减小
C. 温度升高,反应的平衡常数K增大
D. 当和转化率相等时,该反应达到化学平衡
2. 铅蓄电池的两极分别为Pb、,电解液为硫酸,工作时的反应为,下面结论正确的是
A. Pb为正极,被氧化 B. 溶液的pH不断减小
C. 只向处移动 D. 电解液密度不断减小
3. 原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关.下列说法中正确的是( )
A. 由Fe、Cu、溶液组成原电池,负极反应式为:
B. 由Al、Cu、稀硫酸组成原电池,负极反应式为:
C. 由Al、Mg、NaOH溶液组成原电池,负极反应式为:
D. 由Al、Cu、浓硝酸组成的原电池中,负极反应式为:
4. 如图为某种乙醇燃料电池示意图,工作时电子流动方向如图所示,下列判断正确的是( )
A. X为氧气
B. 电极A反应式:
C. 电极材料活泼性:
D. B电极附近溶液pH增大
5. 三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是( )
A通电后中间隔室的离子向正极迁移,
正极区溶液pH增大
B. 该法在处理含废水时可以
得到NaOH和产品
C. 负极反应为,
负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,
会有的生成
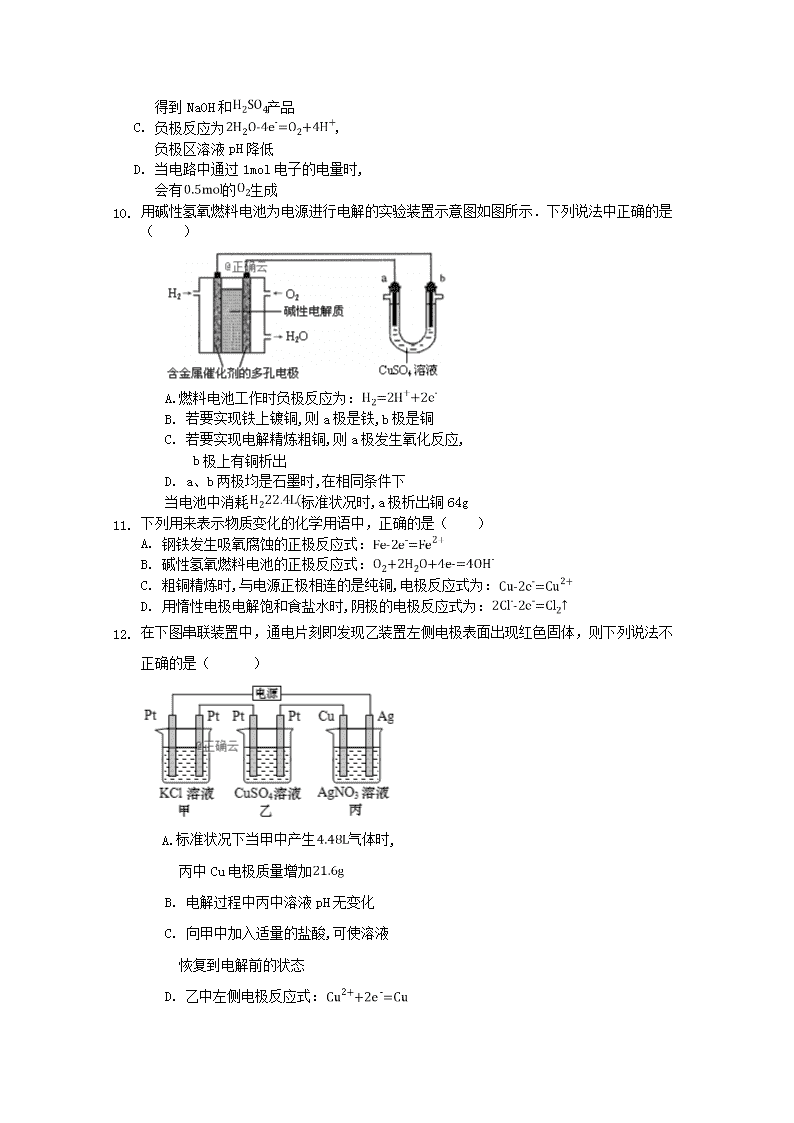
1. 用碱性氢氧燃料电池为电源进行电解的实验装置示意图如图所示.下列说法中正确的是( )
A.燃料电池工作时负极反应为:
B. 若要实现铁上镀铜,则a极是铁,b极是铜
C. 若要实现电解精炼粗铜,则a极发生氧化反应,
b极上有铜析出
D. a、b两极均是石墨时,在相同条件下
当电池中消耗标准状况时,a极析出铜64g
2. 下列用来表示物质变化的化学用语中,正确的是( )
A. 钢铁发生吸氧腐蚀的正极反应式:
B. 碱性氢氧燃料电池的正极反应式:
C. 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:
D. 用惰性电极电解饱和食盐水时,阴极的电极反应式为:
3. 在下图串联装置中,通电片刻即发现乙装置左侧电极表面出现红色固体,则下列说法不正确的是( )
A.标准状况下当甲中产生气体时,
丙中Cu电极质量增加
B. 电解过程中丙中溶液pH无变化
C. 向甲中加入适量的盐酸,可使溶液
恢复到电解前的状态
D. 乙中左侧电极反应式:
1. 下表是几种弱酸常温下的电离平衡常数:
CH3COOH
H2CO3
H2S
H3PO4
1.8×10-5
K1=4.3×10-7
K2=5.6×10-11
K1=9.1×10-8
K2=1.1×10-12
K1=7.5×10-3
K2=6.2×10-8
K3=2.2×10-13
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
2. 用标准浓度氢氧化钠的溶液来滴定未知浓度的盐酸,下列操作中会使盐酸测定的浓度偏大的是( )
①碱式滴定管用蒸馏水洗净后未用标准溶液润洗
②锥形瓶中盛有少量蒸馏水,再加待测液
③酸式滴定用蒸馏水洗净后,未用盐酸润洗
④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
⑤滴定后观察碱式滴定管读数时,视线高于刻度线.
A. B. C. D.
3. 常温下pH为2的盐酸,下列叙述正确的是( )
A. 将10mL该溶液稀释至100mL后,
B. 向该溶液中加入等体积pH为12的氨水恰好完全中和
C. 该溶液中盐酸电离出的与水电离出的之比为:1
D. 该溶液中由水电离出的
4. 已知下列反应的反应热:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3kJ•mol-1
(2)C(s)+O2(g)=CO2(g)△H2=-393.5kJ•mol-1
(3)H2(g)+O2(g)=H2O(l)△H3=-285.8kJ•mol-1
则下列反应的反应热为( )
2C(s)+2H2(g)+O2(g)=CH3COOH(l)
A. B.
C. D.
第Ⅱ卷 非选择题 共52分
5. (7分)工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1)NOx和SO2在空气中存在下列平衡:
2NO(g)+O2(g)⇌2NO2(g)△H=-113.0kJ•mol-1
2SO2(g)+O2(g)⇌2SO3(g)△H=-196.6kJ•mol-1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3.
①写出NO2和SO2反应的热化学方程式为______.
②随温度升高,该反应化学平衡常数变化趋势是______
.
(2)提高2SO2+O2⇌2SO3反应中SO2的转化率,是减少SO2排放的有效措施.
①T温度时,在1L的密闭容器中加入2.0mol SO2和1.0mol O2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是______.
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是______(填字母).
a.温度和容器体积不变,充入1.0mol He b.温度和容器体积不变,充入1.0mol O2
c.在其他条件不变时,减少容器的体积 d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
1. (8分)已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=+23.5kJ•mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题:
(1)该条件下反应平衡常数表达式K=______.在t1℃时,反应的平衡常数为______.用CH3OH表示的化学反应速率______.
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4mol•L-1、c(H2O)=0.6mol•L-1、c(CH3OCH3)=1.2mol•L-1,此时正、逆反应速率的大小:v(正)______ v (逆)(填“>”、“<”或“=”).
2. (11分)电解原理和原电池原理是电化学的两个重要内容,引起了人们的研究兴趣。
(1)现有以下三种乙醇燃料电池(DEFC)。
碱性乙醇燃料电池 酸性乙醇燃料电池 熔融盐乙醇燃料电池
①碱性乙醇燃料电池中,电极a上发生的电极反应式为___________________________。
②酸性乙醇燃料电池中,电极b上发生的电极反应式为_______。③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电极b上发生的电极反应式为________。
(2)0.4mol CuSO4和0.4mol NaCl溶于水,配成1L溶液,用惰性电极进行电解,当一个电极得到0.3mol Cu时,另一个电极上生成的气体在标准状况下的体积为_______L。
(3)新型绿色硝化剂N2O5可以N2O4为原料用电解法制备,实验装置如图所示,则电极B接直流电源的____极,电解池中生成N2O5的电极反应式为____.
20.(8分)依据电化学知识,解决下列问题:
(1) 图1为锌银电池,负极是Zn,正极是Ag2O,电解质是KOH。
写出该电池负极电极反应式:_______________,电池工作时,正极区周围溶液的pH____________(填“增大”、“减小”、“不变”)。
(2) 图2是一种新型燃料电池,以CO为燃料,一定比例的Li2CO3和Na2CO3的熔融混合物为电解质,图3是粗铜精炼的装置图,现用该燃料电池为电源进行粗铜的精炼实验。
①写出 A极的电极反应式: ______________________________________。
②要用燃料电池为电源进行粗铜的精炼实验,则 B极应该与_____极(填“C”或“D”)相连。
③当消耗标准状况下 2.24 LO2时,C电极的质量变化为____________________。
21. (9分)如图为相互串联的甲乙两个电解池,请回答:
(1)甲池若为用电解原理精炼铜的装置,A极是____极,材料是______, B极电极反应方程式为___,
(2)乙池中若滴入少量酚酞试液,开始一段时间后,____极(填“Fe”或“C”)附近变红色。
(3)若乙槽阳极放出气体在标准状况下的体积为2.24L,
①甲槽阴极增重 g 。
②若乙槽电解后得到碱液的物质的量浓度为2moL/L,则乙槽剩余液体体积为 mL。
22. (9分)在化学分析中,常常需要用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液。用Na2C2O4固体测定KMnO4溶液浓度的实验步骤如下:
(反应原理为: 5C2O42-+2MnO4-+16H+===10CO2↑+2Mn2++8H2O)
步骤一:先粗配浓度约为0.15mol/L的KMnO4溶液500mL。
步骤二:准确称取Na2C2O4固体mg放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,
加热至70~80℃,用步骤一所配KMnO4溶液进行滴定。记录相关数据。
步骤三:重复步骤二两到三次。计算得KMnO4溶液的物质的量浓度。
试回答下列问题:
(1)盛放KMnO4溶液的滴定管为________(填“酸式”或“碱式”)滴定管。
(2)该滴定实验滴定终点的现象是_______________________________________。
(3)步骤二中滴定操作如下图所示,正确的操作是______(填编号)。
(4)若m的数值为1.340g,滴定的KMnO4溶液平均用量为25.00mL,则KMnO4溶液的浓度为____________________________ mol/L。
(5)若滴定完毕后读数时俯视,则实验误差会________(填“偏高”、“偏低”或“无影响”)。
答案和解析
题号
1
2
3
4
5
6
7
8
答案
D
D
C
B
B
D
C
D
题号
9
10
11
12
13
14
15
16
答案
B
C
B
C
C
A
C
A
除标注外,其它每空2分
17.7分(1)①NO2(g)+SO2(g)=SO3(g)+NO(g)△H=-41.8kJ•mol-1
②减小(1分)
(2)①2 ②b c
18.(8分)(1);5;mol/(L•min);
(2) >
19.(11分) (1) ①C2H5OH+16OH--12e-=2CO32-+11H2O
②O2+4H++4e-=2H2O ③O2+2CO2+4e-=2CO32-
(2)5.6 (3)负(1分) N2O4+2HNO3-2e-=2N2O5+2H+
20.(8分)(1)Zn+2OH--2e-=Zn(OH)2;增大(1分)
(2)① CO-2e-+CO=2CO2
②D (1分) ③增加12.8g
21. (9分) (1)阴(1分);精铜或纯铜(1分);Cu-2e-=Cu2+;
(2)Fe (1分)
(3)①6.4 ②100
22. (9分)(1)酸式 (1分)
(2)溶液由无色变为浅紫红色,且半分钟内不褪去
(3)A (4)0.1600 (5)偏高