- 2.25 MB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019-2020学年上期期末考试
高二化学试题卷
注意事项:
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。考试时间90分钟,满分100分。考生应首先阅读答题卡上的文字信息,然后在答题卡上作答,在试题卷上作答无效。交卷时只交答题卡。
相对原子质量:H1 Li7 C12 N14 O16 S32 Fe56
第Ⅰ卷
选择题(共16小题,每小题3分,共48分。每小题只有-个选项符合题意。)
1.下列设备工作时都能实现能量转化,其中主要将太阳能转化为热能的是
2.下列说法中正确的是
A.使用催化剂能够降低化学反应的反应热
B.用广泛pH试纸测得0.01 mol·L-1 HCl溶液的pH=2.0
C.CH3COOH与NaOH的混合溶液中,c(Na+)=c(CH3COO-)+c(OH-)-c(H+)
D.80℃时,pH=2的HCl与pH=12的Ba(OH)2等体积混合后的溶液中:2c(Ba2+)=c(Cl-)
3.下列有关化学平衡的描述,不正确的是
A.向反应体系Cl2(aq)+H2O(l)HCl(aq)+HClO(aq)中加入NaOH溶液,颜色变浅
B.恒容条件下,升高反应体系2NO2(g)N2O4(g) △H<0的温度,颜色变深
C.一定温度下,向体积不变的反应体系2HI(g)H2(g)+I2(g)中加入HI,颜色变深
D.一定温度下,向体积不变的反应体系CaCO3(s)CaO(s)+CO2(g)中通入CO2,平衡后c(CO2)增大
4.下列依据热化学方程式得出的结论正确的是
A.已知C(s,金刚石)=C(s,石墨)△H<0,则金刚石比石墨稳定
B.已知2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1,则CO的燃烧热为566.0 kJ·mol-1
C.已知C(s,石墨)+O2(g)=CO2(g) △H=a kJ·mol-1,C(s,石墨)+O2(g)=CO(g) △H=b kJ·mol-1,则a>b
D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3 kJ·mol-1,则含l mol NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3kJ
5.已知NA为阿伏加德罗常数.常M下,下列说法正确的是
A.0.1 L pH=8的氨水中NH4+的个数为9.9×10-8NA
B.1 L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9NA
C.1 L 0.5 mol·L-1 NH4Cl溶液所含NH4+的数目为0.5NA
D.0.2 L 0.5 mol·L-1 NH4NO3溶液中含有的氮原子数小于0.2NA
6.弱电解质的电离平衡、盐类的水解平衡都是重要的化学平衡。已知H2A在水中存在以下电离:H2A=H++HA-,HA-H++A2-。下列说法正确的是
A.0.01 mol·L-1 H2A溶液的pH等于2
B.稀释NaHA溶液,溶液中所有离子浓度均减小
C.Na2A溶液呈中性
D.Na2A溶液中水的电离度大于等浓度NaHA溶液中水的电离度
7.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.加入铝粉能放出氢气的溶液:Na+、Mg2+、Cl-、NO3-;
B.由水电离出的c(OH-)=1.0×10-12 mol·L-1的溶液:Fe2+、NH4+、ClO-、SO42-
C.=1.0×10-12的溶液:K+、SO32-、S2-、Cl-
D.c(NH4+)=c(Cl-)的NH4Cl-NH3·H2O混合液:Al3+、Fe3+、SO42-、HCO3-
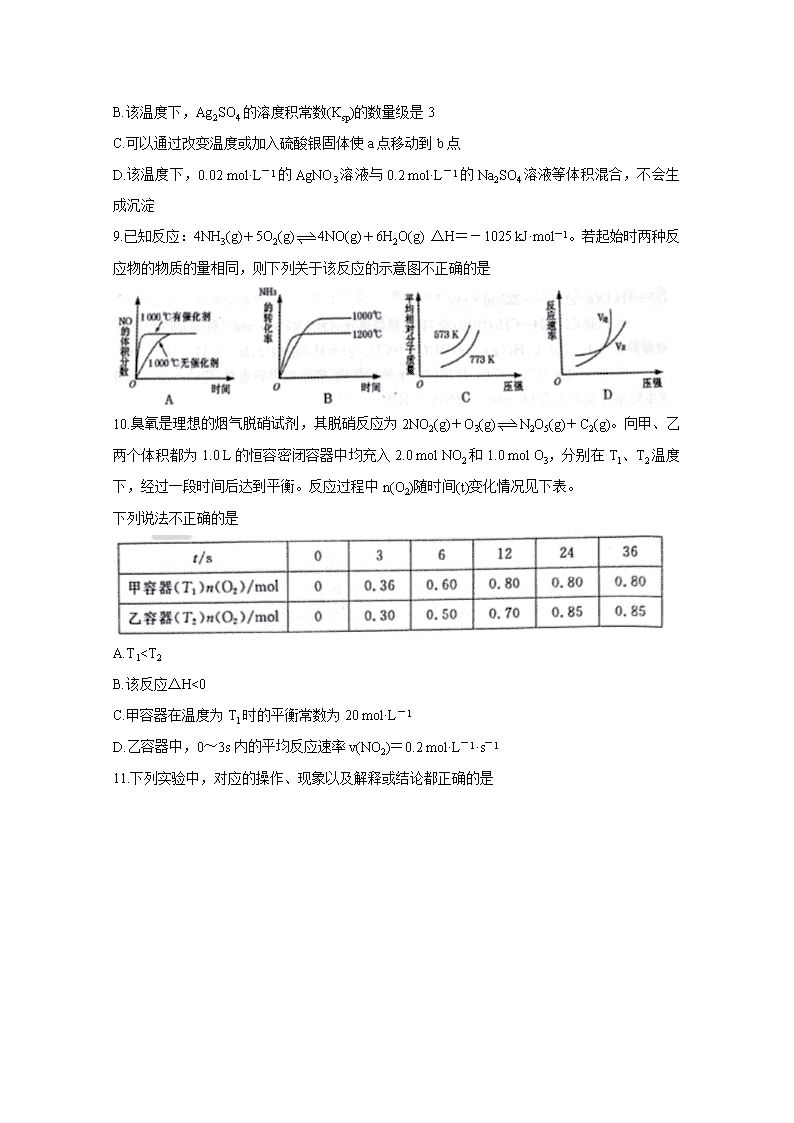
8.某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A.含有大量SO42-的溶液中肯定不存在Ag+
B.该温度下,Ag2SO4的溶度积常数(Ksp)的数量级是3
C.可以通过改变温度或加入硫酸银固体使a点移动到b点
D.该温度下,0.02 mol·L-1的AgNO3溶液与0.2 mol·L-1的Na2SO4溶液等体积混合,不会生成沉淀
9.已知反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H=-1025 kJ·mol-1。若起始时两种反应物的物质的量相同,则下列关于该反应的示意图不正确的是
10.臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)N2O5(g)+C2(g)。向甲、乙两个体积都为1.0 L的恒容密闭容器中均充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表。
下列说法不正确的是
A.T1c(HB-)>c(B2-)>c(H2B)
16.绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。某化学兴趣小组采用以下方法测定某绿矾样品的纯度。a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容配成待测液,b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。下列说法不正确的是
A.a步骤中定容时,仰视会使所测绿矾晶体的纯度偏低
B.滴定时盛放KMnO4溶液的仪器为酸式滴定管
C.滴加最后-滴KMnO4溶液时,溶液变成浅红色,即为滴定终点
D.上述样品中FeSO4·7H2O的质量分数约为97.5%
第II卷(非选择题,共52分)
17.(10分)根据所学化学反应原理,解决以下问题:
(1)请用离子方程式表示泡沫灭火器的工作原理。
(2)请用离子方程式解释漂白粉和洁厕灵不能混合使用的原因。
(3)难溶物ZnS可作为沉淀剂除去废水中的Cu2+,写出该过程的离子方程式。
(4)用CO(g)还原80g Fe2O3(s)生成Fe(s)和CO2(g),放热12.4kJ,请写出该反应的热化学方程式。
(5)已知2CO(g)CO2(g)+C(s),T=980K时,△H-T△S=0。在冶金工业中,以C为还原剂,温度高于980K时,C的氧化产物主要是 。
18.(10分)可用酸碱中和滴定法测定市售白醋的总酸量[总酸量用每100mL白醋溶液所含CH3COOH的质量来表示,单位:g/(100mL)]。
I实验步骤
(1)配制待测白醋溶液。用 (填仪器名称)量取10.00mL食用白醋,在烧杯中加水稀释、冷却至室温后转移到100mL (填仪器名称)中,洗涤、定容、摇匀即得待测白醋溶液。
(2)量取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2~3滴 溶液作指示剂(填“甲基橙”、“石蕊”或“酚酞”)。用碱式滴定管盛装0.1000 mol·L-1NaOH溶液,并记录初始读数。
(3)滴定。判断滴定终点的现象是 ,达到滴定终点,停止滴定,并记录NaOH溶液的最终读数,再重复滴定2次。
(4)某次滴定结束时滴定管中的液面如图所示,则其读数为 mL。
II实验记录
数据记录如下:
III数据处理与误差分析
(5)依据以上数据,市售白醋总酸量= g/(100mL)。
(6)下列实验操作,导致测量结果偏大的是 。
A.盛装NaOH的滴定管滴定前读数正确,滴定后读数时俯视;
B.滴定过程中,振荡锥形瓶时有部分液体溅出;
C.滴定结束后滴定管尖嘴处悬挂有一滴液体;
D.锥形瓶洗净后残留有蒸馏水;
E.盛装NaOH的滴定管未用待测溶液润洗;
F.盛装NaOH的滴定管,尖嘴部分滴定前无气泡,滴定后有气泡产生。
19.(12分)垃圾是放错了位置的资源。郑州市从2019年12月1日起开始实施垃圾分类。垃圾主要分为可回收垃圾、有害垃圾、厨余垃圾和其他垃圾四类。
(1)小明在整理房间时,清理出如下物品:废作业本、镍镉电池、汽水易拉罐、生锈铁钉、矿泉水瓶、烂苹果、涂改液瓶、过期药片。其中镍镉电池和汽水易拉罐分别投入 和
垃圾桶中(填“A”、“B”、“C”、“D”)。
(2)生锈铁钉属于可回收垃圾。铁生锈的实质是铁失去电子被氧化。为探究金属的腐蚀条件,小明同学做了以下五个对照实验。
由以上实验可知,金属腐蚀的条件是 。请用电极反应式表示实验5得电子的反应过程 。
(3)防止金属腐蚀的方法有电化学防护、添加保护层等多种方法。下图装置,可以模拟铁的电化学防护。
若模拟外加电流的阴极保护法,电极材料X可为碳棒,并将开关K置于N处;若模拟牺牲阳极的阴极保护法,电极材料X及相关操作为 。
(4)镀铜可防止铁制品腐蚀,请在下方方框内画出在铁制品上镀铜的实验装置示意图。
(5)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于一定浓度的H2SO4溶液中,一定条件下Fe钝化形成致密的Fe3O4氧化膜,请写出该阳极的电极反应式 。
20.(10分)氨是化肥工业和基础有机化工的主要原料。
(1)合成氨反应过程中有关物质的化学键键能数据如下表所示:
请写出该合成氨反应的热化学方程式 。
(2)一定温度下,合成氨反应在a、b两种条件下分别达到平衡,H2的浓度随时间的变化如图所示。
①a条件下,0~5min内的平均反应速率v(N2)= mol·L-1·min-1。
②相对a而言,b可能改变的条件是 。
(3)某化学兴趣小组向一恒温密闭容器中充入4 mol N2和12 mol H2模拟合成氨反应,平衡混合物中氨气的体积分数与总压强(p)的关系如下图所示。
若体系在60MPa下达到平衡。H2的平衡分压为 MPa。(分压=总压×物质的量分数);列式计算此时的平衡常数Kp= 。(用平衡分压代替平衡浓度计算,结果保留2位有效数字)
(4)下列图示中能表示合成氨反应在恒温、恒容密闭容器中在t1
时刻已经达到平衡状态的是 。
21.(10分)醋酸、氢硫酸、碳酸在常温下的电离常数如下表:
(1)能证明CH3COON是弱酸的事实是 。
A.CH3COOH易挥发
B.常温下,0.1 mol·L-1CH3COONa溶液的pH大于7
C.醋酸不易腐蚀衣服
D.pH=3的CH3COOH溶液稀释10倍,溶液pH<4
E.等体积等浓度的CH3COOH溶液和盐酸,分别与足量镁粉反应,产生氢气-样多
F.将一定量的CH3COOH溶液加入Na2CO3溶液中,有气泡产生
(2)煤的气化过程中产生的H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为 。
(3)t℃时,0.0l mol·L-1NaOH溶液的pH=11,则该温度下,水的离子积KW=
mol2·L-2;该温度下,将pH之和为13的NaOH溶液和CH3COON溶液等体积混合,所得溶液呈 (填“酸”、“碱”或“中”)性。
(4)在室温下,用蒸馏水稀释0.0l mol·L-1CH3COOH溶液,下列各项呈减小趋势的是 。
A. B.
C.溶液中c(H+)和c(OH-)的乘积 D.溶液导电性 E.水的电离程度
(5)25℃时,向1m3 0.l mol·L-1H2S溶液(pH=4)中加入FeSO4·7H2O晶体,当开始生成沉淀时,加入FeSO4·7H2O晶体的质量为 g。
(已知:Ksp(FeS)=6.3×10-18 mol-1·L-2,忽略混合过程中的体积变化)
2019—2020学年上期期末考试
高二化学 参考答案
选择题:
选项
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答案
B
C
D
D
A
D
C
D
C
A
B
B
C
B
C
C
非选择题:
17.(10分)
(1)Al3++3HCO3-=Al(OH)3↓+3CO2↑(2分)
(2)ClO-+Cl-+2H+=Cl2↑+H2O(2分)
(3)ZnS(s)+ Cu2+(aq)=CuS(s)+Zn2+(aq) (2分)
(4)3CO(g)+Fe2O3(g) =3CO2(g) +6 H2O(g) H= -24.8kJ·mol-1(2分)
(5)CO(2分)
18.(10分)
(1)酸式滴定管或移液管(1分) 容量瓶(1分)
(2)酚酞(1分)
(3)滴加最后一滴NaOH溶液,溶液由无色变成浅红色,且半分钟内不褪色(1分)
(4)22.60(2分)
(5)4.2 (2分)
(6) CE(2分)
19.(12分)
(1)B(1分) A (1分)
(2)有氧气和电解质溶液(或其他合理答案)(2分) (2分)
(3)电极材料X可为锌棒,并将开关K置于M处(或其他合理答案)(2分)
(4)(2分)
(5)3Fe - 8e-+4H2O =Fe3O4+8H+(2分)
20.(10分)
(1)N2(g)+3H2(g)2NH3(g);△H=-93 kJ·mol-1(2分)
(2)① 0.1 mol·L-1·min-1(2分)②增大N2浓度 (1分)
(3)18(2分) (2分)
(4)b (1分)
21.(10分)
(1)BD(2分)
(2)H2S+CO32-=HS-+HCO3-(2分)
(3)1.0×10-13 mol2·L-2 (1分)酸(1分)
(4)BD(2分)
(5)250.2 (2分)