- 757.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
北京市丰台区2020届高三二模试题(2020年6月)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Fe 56
第一部分
本部分共14小题,每小题3分,共42分。在每小题列出的四个选项中,选出最符合题目要求的一项。
1.(2020年北京丰台 二模)垃圾分类并回收利用,可以节约自然资源,符合可持续发展的要求。与食用油桶对应的垃圾分类标志是( )
A B C D
2.(2020年北京丰台 二模)关于淀粉和纤维素关系的叙述中不正确的是( )
A.都是非还原糖 B.都符合分子式(C6H10O5)n
C.互为同分异构体 D.都是天然高分子化合物
3.(2020年北京丰台 二模)化学与生活密切相关。下列说法不正确的是( )
A.CO2、NO2或SO2都会导致酸雨的形成
B.疫苗一般应冷藏存放,以避免蛋白质变性
C.泡沫灭火器可用于一般的起火,但不适用于电器起火
D.水中的钢闸门连接电源的负极,可防止钢闸门被腐蚀
4.(2020年北京丰台 二模)利用元素周期表的知识,判断下列对于铍及其化合物的性质预测不正确的是( )
A.原子半径: Be>B
B.Be能与冷水剧烈反应
C.相同条件下,与酸反应,Li比Be容易
D.最高价氧化物对应水化物的碱性: Ca(OH) 2>Be(OH)2
5.(2020年北京丰台 二模)下列解释事实的化学用语正确的是( )
A.用食醋清洗水垢:CO32- + 2CH3COOH 2CH3COO-+ H2O +CO2↑
B.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-CaCO3↓+H2O
C.向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO+2H2OH2CO3+2OH-
D.Na2O2吸收CO2作供氧剂:2Na2O2+2CO22Na2CO3+O2
6.(2020年北京丰台 二模)黄铁矿(FeS2)催化氧化的化学方程式为:2FeS2+7O2+2H2O 2FeSO4+2H2SO4。已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.FeSO4和H2SO4都是离子化合物,均属于强电解质
B.0.1 mol·L-1 FeSO4 溶液中Fe2+离子的浓度为0.1 mol·L-1
C.FeSO4既是被氧化得到的产物,又是被还原得到的产物
D.当转移2 mol电子时,消耗氧气的体积(标准状况)约为22.4 L
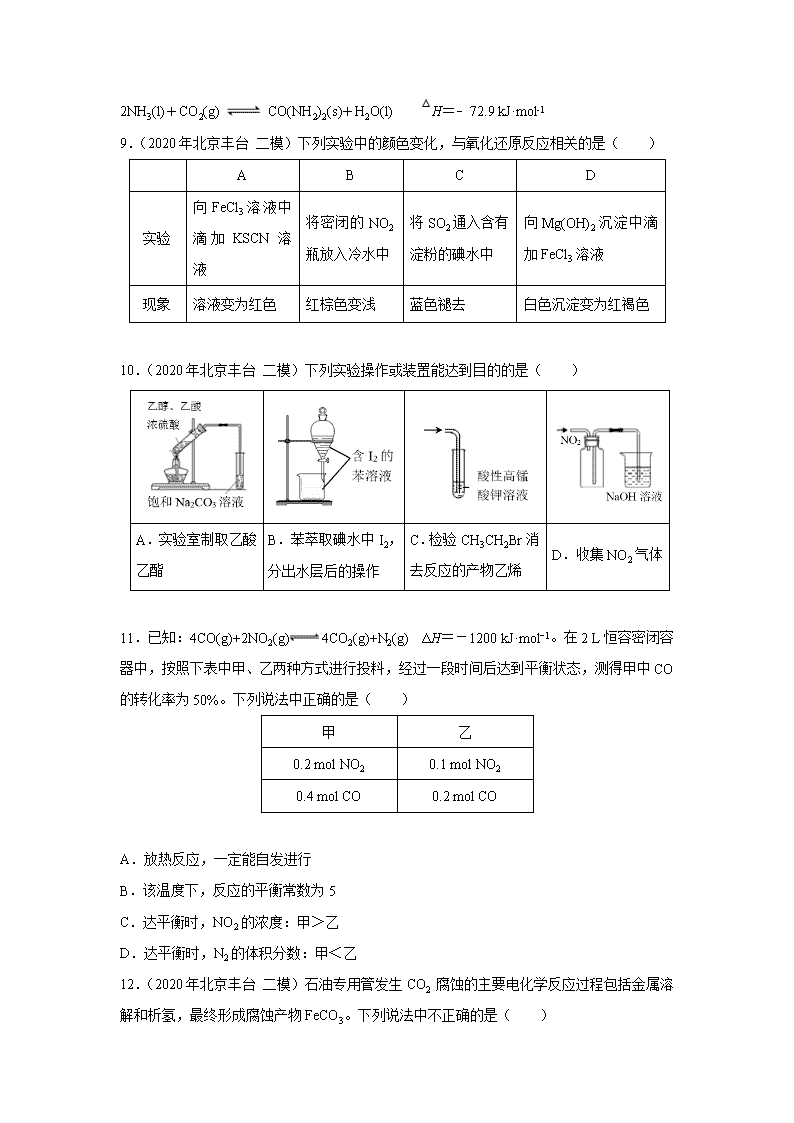
1过渡态H
H2S
CH3OH
H
HS
H
H
HS
CH3
O
H
H
HS
CH3
O
OH
H
SH
CH2
CH3SH+H2O
①
②
③
④
⑤
催化剂
催化剂
催化剂
催化剂
催化剂
7.(2020年北京丰台 二模)甲硫醇是一种重要的原料和化工试剂,硫化氢与甲醇合成甲硫醇的催化过程如下。下列说法中不正确的是( )
A.CH3SH中碳元素化合价为﹣2价
B.过程⑤中,形成了O—H键和C—H键
C.该催化剂可有效提高反应物的平衡转化率
D.硫化氢与甲醇合成甲硫醇的反应类型为取代反应
8.(2020年北京丰台 二模)氨和二氧化碳合成尿素的合成反应分两步进行:
第一步:2NH3(l)+CO2(g) NH2COONH4 (l) △H1=﹣100.5 kJ·mol-1
第二步:NH2COONH4 (l) CO(NH2)2(s)+H2O(l) △H2=﹢27.6 kJ·mol-1
下列说法中不正确的是( )
A.第一步反应随着温度的升高,平衡常数增大
B.1 mol H2O和1 mol NH3中含有的质子数相等
C.通入过量的CO2可提高NH3的转化率
D.合成尿素的总的热化学方程式为:
2NH3(l)+CO2(g) CO(NH2)2(s)+H2O(l) △H=﹣72.9 kJ·mol-1
9.(2020年北京丰台 二模)下列实验中的颜色变化,与氧化还原反应相关的是( )
A
B
C
D
实验
向FeCl3溶液中滴加KSCN溶液
将密闭的NO2瓶放入冷水中
将SO2通入含有淀粉的碘水中
向Mg(OH)2沉淀中滴加FeCl3溶液
现象
溶液变为红色
红棕色变浅
蓝色褪去
白色沉淀变为红褐色
10.(2020年北京丰台 二模)下列实验操作或装置能达到目的的是( )
NaOH溶液
NO2
A.实验室制取乙酸乙酯
B.苯萃取碘水中I2,
分出水层后的操作
C.检验CH3CH2Br消去反应的产物乙烯
D.收集NO2气体
11.已知:4CO(g)+2NO2(g)4CO2(g)+N2(g) ΔH=-1200 kJ·mol−1。在2 L恒容密闭容器中,按照下表中甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%。下列说法中正确的是( )
甲
乙
0.2 mol NO2
0.1 mol NO2
0.4 mol CO
0.2 mol CO
A.放热反应,一定能自发进行
B.该温度下,反应的平衡常数为5
C.达平衡时,NO2的浓度:甲>乙
D.达平衡时,N2的体积分数:甲<乙
12.(2020年北京丰台 二模)石油专用管发生CO2 腐蚀的主要电化学反应过程包括金属溶解和析氢,最终形成腐蚀产物FeCO3。下列说法中不正确的是( )
A.金属溶解发生在负极,析氢发生在正极
B.生成腐蚀产物的反应可能有:Fe2+ +HCO3-+e-FeCO3 +H+
C.腐蚀过程总反应的化学方程式为:CO2+H2O+Fe FeCO3+H2
D.温度、溶液酸碱度、压强等都会影响腐蚀的速率
13.(2020年北京丰台 二模)用亚硫酸盐(X)吸收烟气中的SO2。已知吸收过程中含硫组分物质的量分数(δ)与溶液pH的变化关系如下图所示。下列说法中不正确的是( )
A.若X为Na2SO3,当吸收液pH=1.85时:c(Na+)=c(HSO3-)+c(H2SO3)
B.若X为Na2SO3,当吸收液呈中性时:2c(SO32-)+c(HSO3-)=c(Na+)
C.若X为 (NH4)2SO3,(NH4)2SO3溶液呈碱性,说明水解程度:SO32-> NH4+
D.若X为 (NH4)2SO3,图中b点溶液中n(HSO3-)∶n(NH4+)= 1∶3
14.(2020年北京丰台 二模)某小组同学用下图装置进行铜与浓硫酸反应时,发现试管中有黑色物质产生。同学猜测,黑色物质中可能含有CuO、Cu2S和CuS,针对产生的黑色物质,该小组同学继续进行实验探究,获得数据如下表。下列说法不正确的是( )
硫酸浓度/ mol·L﹣1
黑色物质出现
的温度∕℃
黑色物质消失
的温度∕℃
15
约150
约236
16
约140
约250
18
约120
不消失
A.硫酸浓度越大,黑色物质越易出现、越难消失
B.黑色物质消失过程中有SO2、H2S生成
C.硫酸浓度为16 mol·L﹣1时,先升温至250℃以上,再将铜丝与浓硫酸接触,可以
避免产生黑色物质
D.取黑色物质洗涤、干燥后,加稀硫酸充分混合,固体质量不变,说明黑色物质中不
含CuO
第二部分
本部分共5小题,共58分。
15.(8分)(2020年北京丰台 二模)气态亚硝酸(HNO2或HONO)是大气中的一种污染物。
(1)亚硝酸的电离平衡常数Ka=6.0×10﹣6,其电离方程式为 。
(2)亚硝酸分子中各原子最外层电子均达到稳定结构,其电子式为 。
(3)亚硝酸进入人体可以与二甲胺[(CH3)2NH]迅速反应生成亚硝酸胺[CH3)2N-N=O],
亚硝酸胺是最重要的化学致癌物之一。
① 亚硝酸与二甲胺反应生成亚硝酸胺的一种反应机理如下。
CH3-N-CH3
H
CH3-N-CH3
HONOH
CH3-N-CH3
NO
HONO+
过程ⅰ和过程ⅱ的反应类型分别为: 、消去反应。
反应过程
能量
过渡态2
过程ⅰ
过程ⅱ
② 上述反应机理的反应过程与能量变化的关系如下图。
亚硝酸与二甲胺反应生成亚硝酸胺的反应ΔH 0(填“>”或“<”)。反应难度更大的是过程 (填“ⅰ”或“ⅱ”)。
16.(10分)(2020年北京丰台 二模)高氯酸盐(ClO4-
)有高稳定性和强氧化性,常作为氧化剂用于工业生产。
(1)高氯酸盐中氯元素的化合价为 。
(2)下列叙述中可说明氯元素比硫元素非金属性强的是 。
① HCl比H2S稳定 ② HClO4的酸性比H2SO3的强
③ Cl2可与Na2S发生置换反应
(3)NH4ClO4是复合火箭推进剂的重要成分,实验室可通过反应NaClO4+NH4ClNH4ClO4+NaCl制取。相关物质的溶解度曲线如右图。
①结合溶解度,分析该反应能够发生的原因 。
② 从反应后热的混合液中获得较多NH4ClO4晶体的实验操作依次为 、蒸发浓缩、冷却结晶、过滤、冰水洗涤。
(4)高氯酸盐是一种新型的无机污染物,ClO4-的主要危害是与碘离子竞争进入人体甲状腺,影响甲状腺的正常功能。利用电化学催化法,酸性环境中,可将ClO4-还原为Cl-,该电极反应式为 。
(5)已知,加热时Cu(ClO4)2的分解方式有以下两种:
2Cu(ClO4)2 2CuO+7O2↑+2Cl2↑ Cu(ClO4)2CuCl2+4O2↑
取一定质量的Cu(ClO4) 2·6H2O样品,加热至某温度使其完全分解,若测得V(O2)∶V(Cl2)=5∶1,则分解所得固体产物中CuO与CuCl2的物质的量之比为 。
17.(15分)(2020年北京丰台 二模)双功能手性催化剂在药物合成中起到重要的作用。其中一种催化剂I的合成路线如下:
已知:
(1)A可与Na反应可生成H2,则A中的官能团名称是_________。
(2)下列关于A的说法中,正确的是_________。
a.与乙醇互为同系物
b.与B在一定条件下可发生缩聚反应
c.发生消去反应的试剂和条件是:NaOH的醇溶液、加热
(3)写出B→C的化学方程式:_______________________________________________。
(4)D的结构简式是______________________。
(5)E→F的反应类型是_______________________。
(6)已知:,NH3和物质K发生反应可以制备试剂a ,K的结构简式是________________。
(7)F与对苯二胺()在一定条件下可发生缩聚反应制备尼龙MXD6
的衍生品,该反应的化学方程式是_________________________________________。
(8)H的结构简式是_________________。
18.(11分)(2020年北京丰台 二模)铅蓄电池是最常见的二次电池,以废旧铅蓄电池中的铅膏(主要含PbO、PbO2、PbSO4等)为原料回收铅,对保护环境和发展循环经济意义重大。某工艺流程如下:
(1)已知铅蓄电池总反应:Pb+PbO2+2H2SO42PbSO4+2H2O,充电时,阳极的电极反应式为____________________________。
(2)过程①体现Na2SO3的 性。
(3)由滤液A可获得Na2SO4·10H2O粗品,检验粗品中SO42-离子的实验方法是________________________________________________________。
(4)结合化学用语解释过程②中PbSO4转化为PbCO3的原因__________________________。
(5)反应温度对过程②转化率(脱硫率)的影响如图1所示,实际生产中温度选择在50℃,若温度过高,脱硫率下降的原因可能是:________________________________________。
图1 图2
(6)将PbO 、PbCO3粗品置于一定浓度HCl和浸取液中溶解,得到含Na2PbCl4的电
解液,如图2电解可得高纯Pb,同时再生浸取液。请结合化学用语解释浸取液再生的原理________________________________________________。
19.(14分)(2020年北京丰台 二模)某小组同学探究Cu和H2O2的反应。
【猜想预测】
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
【实验探究】
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10 小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:____________________。
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2+ + 4NH3 [ Cu(NH3)4] 2+ ,[ Cu(NH3)4] 2+为深蓝色;
Cu(OH)2可溶于氨水形成深蓝色溶液。
装置
序号
试剂a
现象
ⅱ
20 mL 30% H2O与4 mL
5 mol/L H2SO4 混合液
Cu表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡
ⅲ
20 mL 30% H2O2与4 mL
5 mol/L氨水混合液
溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物
(2)实验ⅱ中:溶液变蓝的原因是________________________________(用化学用语解释);经检验产生的气体为氧气,产生氧气的原因是____________________________________。
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用右图装置继续实验。
已知:电压大小反映了物质氧化还原性强弱的差异;
物质氧化性与还原性强弱差异越大,电压越大
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变。
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论: 。
利用该方法也可证明酸性增强可提高H2O2的氧化性,导致Cu溶解速率加快。
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是___________________________________________________。
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:_____________________________________________________
_______________________________________________________________________。
(6)基于以上实验,影响Cu与H2O2反应速率的因素有____________________________。
【参考答案】
第一部分
本部分共14小题,每小题3分,共42分。在每小题列出的四个选项中,选出最符合题目要求的一项。
1
2
3
4
5
6
7
A
C
A
B
D
C
C
8
9
10
11
12
13
14
A
C
A
C
B
A
B
第二部分
本部分共5小题,共58分。
15.(8分)
(1)HNO2 H++NO2-(2分) (2)(2分)
(3)①加成反应(2分) ② <(1分) 过程ⅰ(1分)
16.(10分)
(1)+7(2分) (2)①③ (2分)
(3)①80℃时,氯化钠溶解度小于其他物质(生成物溶解度小于反应物)(1分)
②趁热过滤(1分)
(4)ClO4-+ 8H++8e-Cl-+ 4H2O (2分) (5)8∶3(2分)
17.(15分)
(1)羟基 (1分) (2)b(2分)
(3)HOOC—CH2—COOH + 2C2H5OHC2H5OOC—CH2—COOC2H5 + 2H2O(2分)
(4)(2分)(5)取代(2分)
(6)(2分)
(7)(2分)
(8)(2分)
18.(11分)
(1)PbSO4-2e-+2H2O PbO2+4H++SO42-(2分) (2)还原(1分)
(3)取少量晶体,加足量盐酸,再滴加BaCl2溶液,若产生白色沉淀,则阴离子为SO42-。(2分)
(4)PbSO4 +CO32﹣PbCO3+SO42-(2分)
(5)温度过高,碳酸铵分解(2分)
(6)阴极PbCl42-+2e-Pb+4Cl-,H+离子在电压作用下穿过质子交换膜向阴极室定
向移动,形成HCl和NaCl混合液。(2分)
19.(14分)
(1)Cu+H2O2 Cu (OH)2↓(2分)
(2)Cu+H2O2 +2H+ Cu2++2H2O(2分)
产生的铜离子催化了过氧化氢分解;或铜离子氧化了过氧化氢(2分)
(3)加入氨水,提高了Cu的还原性(2分)
(4)Cu(NH3)42+对H2O2分解有很好的催化作用(2分)(aq)
(5)Cu (OH)2(aq)Cu2+(aq)+2OH-(aq),加入少量NH4Cl,NH3+H2O NH3·H2O NH4++OH-,平衡逆移,使c(NH3)增大,Cu2++4NH3 Cu(NH3)42+,使c(Cu2+)减小,Cu (OH)2(aq)Cu2+(aq)+2OH-(aq),正移,沉淀溶解,无沉淀。(2分)
(6)酸碱性、产物微粒的种类(2分)