- 482.00 KB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
惠东高级中学高二年级2018-2019学年度10月段考
化学科目试题(满分:150分)
注意事项:
1. 本试卷分两部分,第一部分100分,第二部分50分,全卷共150分。
2. 考试时间100分钟。
第一部分(共100分)
一、 选择题(本题包括20小题,每题3分,共60分。每题只有一个选项符合题意)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 Na-23 Mg-24 Fe-56 Cu-64 Zn-65 Ag-108
1.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了 ( )
A.该反应是吸热反应 B.该反应是放热反应
C.铁粉和硫粉在常温下容易发生反应 D.硫化亚铁的总能量高于铁粉和硫粉的总能量
2.已知1molSiO2含有4mol Si—O。有关键能数据如表,晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)=SiO2(s);ΔH=-989.2kJ·mol-1,则表中x的值为 ( )
化学键
Si—O
O=O
Si—Si
键能/kJ·mol-1
x
498.8
176
A.460 B.920 C.1165.2 D.423.3
3.合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4 (g)+ 2H2O (g) CO2(g)+4H2 (g) 已知,破坏1mol化学键需要吸收的热量如下表所示:
化学键
C—H
O—H
C=O
H—H
吸收热量(kJ/mol)
414
464
803
436
试通过计算判断,下列有关甲烷转化成氢气过程的能量变化示意图正确的是( )
4.废电池的污染引起人们的广泛重视,废电池中对环境形成污染的主要物质是( )
A.锌 B.汞 C.石墨 D.二氧化锰
5.以下现象与电化腐蚀无关的是 ( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿 B.生铁比软铁芯容易生锈
C. 锈质器件附有铜质配件,在接触处易生铁锈 D.银质奖牌久置后表面变暗
6.家用炒菜铁锅用水清洗放置后出现红棕色的锈斑,在此变化过程中不发生的化学反应是 ( )
A、4Fe(OH)2+2H2O+O2=4Fe(OH)3↓ B、2Fe+2H2O+O2=2Fe(OH)2↓
C、2H2O+O2+4e―=4OH- D、Fe-3e―=Fe3+
7.某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是( )
8.利用电解法可将Fe、Zn、Ag、Au等杂质的粗铜提纯,下列叙述正确的是( )
A.电解时以纯铜作阳极 B.电解时阳极发生还原反应
C.纯铜连接电源负极,电极反应是Cu﹣2e-=Cu2+
D.电解后,电解槽底部会形成含少量Ag、Au等金属阳极泥
9.观察下列几个装置示意图,有关叙述正确的是( )
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源正极相连
C.装置③中外电路电子由a极流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
10.用惰性电极电解下列溶液,一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),能使溶液完全复原的是( )
A.CuCl2 (CuO) B.NaOH (NaOH) C.CuSO4 (CuO) D.NaCl (NaOH)
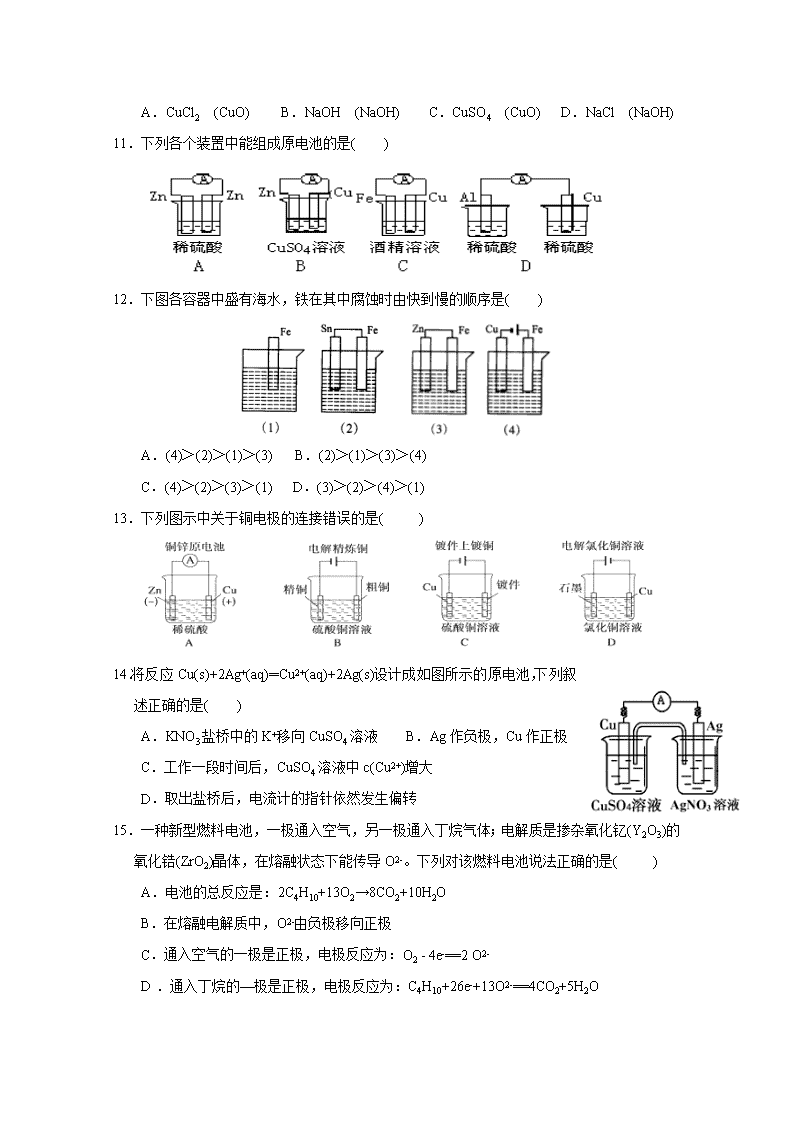
11.下列各个装置中能组成原电池的是( )
12.下图各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是( )
A.(4)>(2)>(1)>(3) B.(2)>(1)>(3)>(4)
C.(4)>(2)>(3)>(1) D.(3)>(2)>(4)>(1)
13.下列图示中关于铜电极的连接错误的是( )
14.将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成如图所示的原电池,下列叙述正确的是( )
A.KNO3盐桥中的K+移向CuSO4溶液 B.Ag作负极,Cu作正极
C.工作一段时间后,CuSO4溶液中c(Cu2+)增大
D.取出盐桥后,电流计的指针依然发生偏转
15.一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是( )
A.电池的总反应是:2C4H10+13O2→8CO2+10H2O
B.在熔融电解质中,O2-由负极移向正极
C.通入空气的一极是正极,电极反应为:O2 - 4e-==2 O2-
D.通入丁烷的—极是正极,电极反应为:C4H10+26e-+13O2-==4CO2+5H2O
16.某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为: 2H2+O2=2H2O,下列有关说法错误的是 ( )
A.电子通过外电路从a极流向b极
B.b极上的电极反应式为:O2+4H++4e-=2H2O
C.H+由b极通过固体酸电解质传递到a极
D.每转移0.1 mol电子,标准状况下需消耗1.12 L的H2
17.结合如图判断,下列叙述正确的是( )
A.图Ⅲ盐桥的原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深
B.Ⅰ和Ⅱ中负极反应均是Fe﹣2e﹣═Fe2+ C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e﹣═4OH﹣
D.Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,Ⅱ有蓝色沉淀
18.在标准状况下,用铂电极电解CuSO4溶液,当阴极产生12.8g铜时,阳极放出的气体是( )
A.1.12L H2 B.1.12L O2 C.2.24L H2 D.2.24L O2
19.下列热化学方程式叙述正确的是(△H的绝对值均正确)( )
A.(燃烧热)
B.(中和热)
C.2S(s)+3O2(g)=2SO3(g)△H =-269KJ/mol(燃烧热)
放电
充电
D.2NO2(g)=O2(g) + 2NO(g) △H=+116.2kJ/mol (反应热)
20.汽车的启动电源常用铅蓄电池,电池反应如下:PbO2 + Pb + 2H2SO4 2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
A.PbO2放电时是电池的负极,充电时是电池的阳极。
B.负极的电极反应式为:Pb + SO– 2e – = PbSO4
C.放电时,PbO2得电子,被氧化 D.电池放电时,溶液酸性增强
一、 选择题(本题包括10小题,每题4分,共40分。每题只有一个选项符合题意)
21.化学反应N2+3H22NH3的能量变化如图所示,该反应的热化学方程式是( )
A. N2(g)+3H2(g)2NH3(l) △H= 2(a﹣b﹣c)kJ/mol
B. B.N2(g)+3H2(g)2NH3(g)△H=2(b﹣a)kJ/mol
C.0.5N2(g) +1.5H2(g)NH3(l)△H=(b+c﹣a)kJ/mol
D.0.5N2(g)+1.5H2(g)NH3(g)△H=(a+b)kJ/mol
22.下列依据热化学方程式得出的结论正确的是( )
A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ· mol-1说明2 mol H2(g)和1 mol O2(g)的能量总和小于2 mol H2O(g)的能量
B.已知C(s,石墨)===C(s,金刚石) ΔH>0,则金刚石比石墨稳定
C.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,则含20 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量
D.已知2C(s)+2O2(g)===2CO2(g) ΔH1 2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1>ΔH2
24.某混合溶液中只含有两种溶质NaCl和H2SO4,且n(NaCl): n(H2SO4)=3:1。若以石墨电极电解该溶液,下列推断中不正确的是 ( )
A.阴极产物为H2 B.阳极先析出Cl2,后析出O2
C.电解液的pH不断增大,最终大于7 D.整个电解的过程实质是电解水
25.金属镍有广泛的用途。粗镍中含少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度镍(已知:氧化性Fe2+