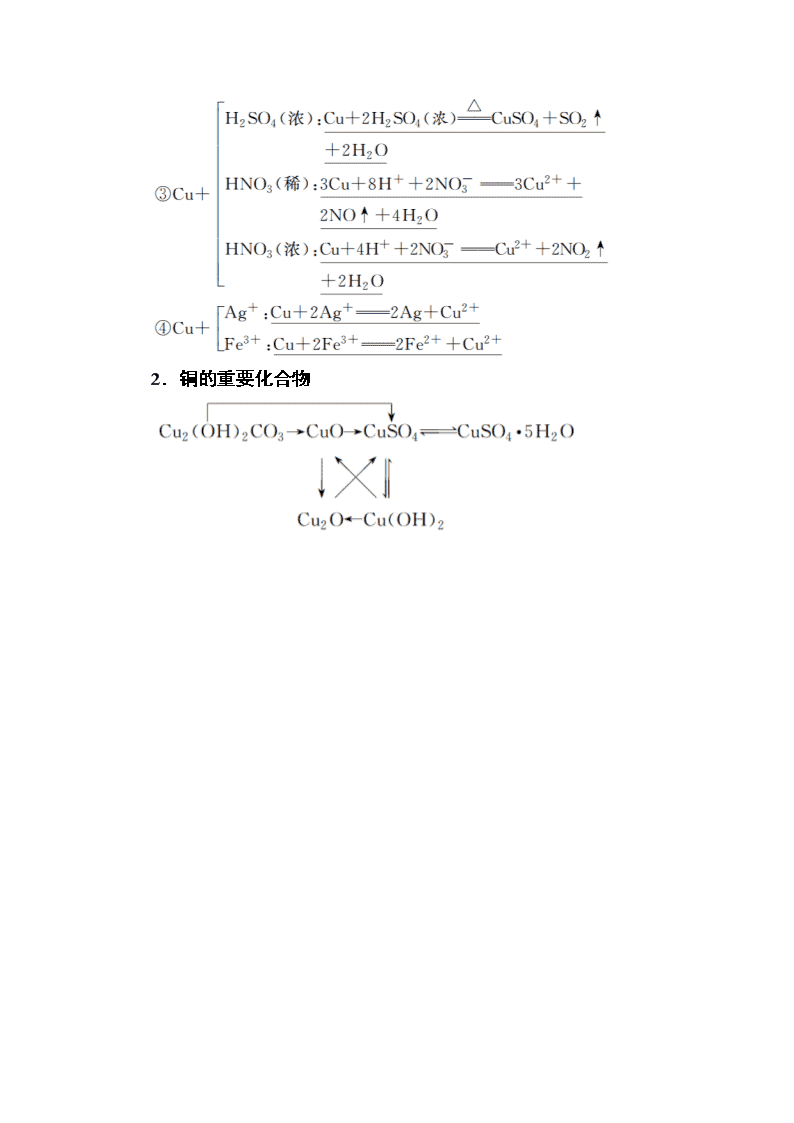- 1.37 MB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
第四节 金属材料及金属矿物的开发利用
最新考纲:1.了解常见金属活动性顺序。2.了解合金的概念及其重要应用。3.了解铜及其重要化合物的制备方法。4.掌握铜及其重要化合物的主要性质及其应用。
核心素养:1.证据推理与模型认知:具有证据意识,能基于证据对金属材料性质提出可能的假设,通过分析推理加以证实或证伪;能运用模型解释化学现象,揭示现象的本质和规律。2.科学探究与创新意识:能对金属的性质提出有探究价值的问题;能从问题和假设出发,确定探究目的,设计探究方案,进行实验探究。
知识点一 铜及其化合物
1.铜的性质
(1)物理性质:铜是紫红色金属,具有良好的导电性、导热性和延展性。
(2)化学性质
写出图中有关反应的化学方程式或离子方程式:
①2Cu+O2+CO2+H2O===Cu2(OH)2CO3
②2Cu+SCu2S
2.铜的重要化合物
(1)氧化铜和氧化亚铜
名称
氧化铜
氧化亚铜
颜色
黑色
砖红色
与酸反应(H+)
CuO+2H+===Cu2++H2O
Cu2O+2H+===Cu2++Cu+H2O
与H2反应
CuO+H2Cu+H2O
Cu2O+H22Cu+H2O
转化关系
4CuO2Cu2O+O2↑
(2)氢氧化铜
a.物理性质:蓝色不溶于水的固体。
b.化学性质及应用
反应①的化学方程式:Cu(OH)2CuO+H2O
反应②的化学方程式:Cu(OH)2+2H+===Cu2++2H2O
(3)铜盐
①Cu2(OH)2CO3的名称为碱式碳酸铜,是铜绿、孔雀石的主要成分,是铜在潮湿空气中被腐蚀的结果,其受热分解的化学方程式为Cu2(OH)2CO32CuO+H2O+CO2↑。
②CuSO4·5H2O为蓝色晶体,俗称蓝矾、胆矾,其受热分解的化学方程式为CuSO4·5H2OCuSO4+5H2O,蓝色晶体受热转化为白色粉末。无水CuSO4遇水变蓝色(生成CuSO4· 5H2O),据此可用来检验水的存在。
判断正误(正确的打“√”,错误的打“×”)
1.CuO是黑色固体,与水反应生成Cu(OH)2( × )
提示:CuO不能与水反应生成Cu(OH)2。
2.电解CuCl2溶液的方程式:CuCl2Cu2++2Cl-( × )
提示:电解CuCl2溶液发生反应:CuCl2Cu+Cl2↑。
3.H2还原CuO时,应先加热,后通H2( × )
提示:氢气还原氧化铜时,应“先通氢,后点灯”,以免加热时发生爆炸危险。
4.CuSO4·5H2O失去结晶水属于物理变化( × )
提示:硫酸铜晶体失去结晶水属于化学变化。
5.Cu2O遇硝酸会被氧化成Cu2+( √ )
6.利用无水硫酸铜遇水变成蓝色这一性质,来检验水的存在( √ )
提示:无水硫酸铜能与水作用生成蓝色的CuSO4·5H2O,能作水的检测剂。
7.铜锈是铜被空气中的氧气缓慢氧化生成的氧化物( × )
提示:Cu2(OH)2CO3是铜锈的主要成分。
8.农业上配制波尔多液时可在铁桶或铝桶中进行( × )
提示:波尔多液的成分含有硫酸铜,能与单质铁或铝发生置换反应而降低药效,故不能在铁桶或铝桶中配制。
1.铜离子为重金属离子,能使蛋白质变性,从而达到杀死细菌的目的,常用CuSO4作游泳池的消毒剂。
2.铜及其化合物的颜色
物质
颜色
物质
颜色
Cu
紫红色
CuSO4
白色
CuO
黑色
CuSO4·5H2O
蓝色
Cu2O
红色
Cu2(OH)2CO3
绿色
Cu2S
黑色
Cu(OH)2
蓝色
在无机物的综合推断题中,常利用颜色来区别或检验铜及其化合物。
3.通常利用反应:2Cu+O22CuO除去混合气体中的少量O2。
4.铜为变价金属,与Cl2反应生成CuCl2,与S反应生成Cu2S,由此可知氧化性:Cl2>S。
5.Cu与稀H2SO4不反应,但在通入O2的条件下,可逐渐溶解:2Cu+O2+2H2SO4===2CuSO4+2H2O。
1.(2020·河北石家庄二中模拟)铜在自然界多以化合态的形式存在于矿石中。常见的铜矿石有:黄铜矿(CuFeS2)、斑铜矿(Cu5FeS4)、辉铜矿(Cu2S)、孔雀石[CuCO3·Cu(OH)2]。下列说法不正确的是( C )
A.可用稀盐酸除去铜器表面的铜绿
B.硫酸铜溶液可用作游泳池的消毒剂
C.工业上常采用电解法制取粗铜
D.在上述几种含铜化合物中,铜的质量分数最高的是Cu2S
解析:CuSO4是重金属盐,能使蛋白质变性,B项正确;工业上常用电解法精炼铜,C项不正确。
2.下列有关CuSO4溶液的叙述正确的是( A )
A.该溶液中Na+、NH、NO、Mg2+可以大量共存
B.通入CO2气体产生蓝色沉淀
C.与H2S反应的离子方程式:Cu2++S2-===CuS↓
D.与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O===Cu(OH)2↓+2NH
解析:A项,CuSO4溶液显酸性,Na+、NH、NO、Mg2+可以大量共存,A项正确;B项,CO2与CuSO4溶液不发生反应,违背了强酸制弱酸的原理,B项错误;C项,H2S属于弱电解质,书写离子反应方程式时,要写化学式,C项错误;D项,CuSO4溶液与过量浓氨水反应生成四氨基合铜离子[Cu(NH3)4]2+,D项错误。
3.已知CuO经高温灼烧生成Cu2O,Cu2O与H+发生反应:Cu2O+2H+===Cu+Cu2++H2O。将经高温灼烧后的CuO样品投入足量的热的稀硝酸溶液中,下列有关说法中正确的是( C )
A.如果溶液变为蓝色、同时有紫红色固体出现,说明样品全部生成了Cu2O
B.溶液中最终可能有紫红色固体出现
C.这种实验的结果无法说明CuO分解的程度
D.如果溶液中出现蓝色,最终没有紫红色固体出现,说明CuO没有分解
解析:由于Cu2O和Cu都能够与热的稀硝酸反应,所以不论CuO是否完全分解,溶液中最终不可能有紫红色固体出现,所以C正确。
4.新制氢氧化铜存在平衡:Cu(OH)2+2OH-Cu(OH)(深蓝色)。某同学进行下列实验:
下列说法不正确的是( D )
A.①中出现蓝色沉淀
B.③中现象是Cu(OH)2+2OH-Cu(OH)正向移动的结果
C.④中现象证明葡萄糖具有还原性
D.对比②和④可知Cu(OH)2氧化性强于Cu(OH)
解析:CuSO4溶液与NaOH溶液反应可生成蓝色沉淀Cu(OH)2,A正确。新制Cu(OH)2存在平衡:Cu(OH)2+2OH-Cu(OH),加入NaOH,氢氧根离子的浓度增大,平衡正向移动,B正确。③中加入葡萄糖溶液有砖红色的沉淀生成,说明葡萄糖中含有醛基,所以葡萄糖具有还原性,C正确。④中氧化葡萄糖的是Cu(OH),而②中未生成砖红色沉淀,可知氧化性:Cu(OH)2
相关文档
- 2020高中化学专题3常见的烃第一单2021-07-077页
- 【人教版】2021年高中化学必修2(全2021-07-07154页
- 【化学】四川省成都市蓉城高中教育2021-07-0710页
- 高中化学作业12水的电离和溶液的酸2021-07-078页
- 人教版高中化学选修5课件 第2章 本2021-07-0729页
- 人教版高中化学选修4练习:模块综合2021-07-0714页
- 高中化学必修一的每章知识点总结2021-07-0711页
- 2020高中化学必修2知识点归纳总结2021-07-0731页
- 2020版高中化学课时作业11综合测试2021-07-0714页
- 高中化学必修1第4章第3节第1课时练2021-07-077页