- 458.15 KB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考点一 反应热的有关概念
考点清单
基础知识
一、反应热(焓变)
1.定义:化学反应过程中放出或吸收的①
热量
叫反应热,在恒压条件下,
它等于反应前后体系的焓变。
2.符号:②
Δ
H
。
3.单位:③
kJ/mol或kJ·mol
-1
。
4.测量:可用量热计测量。
5.表示方法:吸热反应的Δ
H
④
>
0,放热反应的Δ
H
⑤
<
0。
6.产生原因:化学反应过程中旧键断裂吸收的能量与新键形成放出的能量
不相等,故化学反应均伴随着能量变化。
二、燃烧热和中和反应的反应热
1.燃烧热
(1)定义:101 kPa时,⑥
1 mol
纯物质
完全燃烧
生成⑦
稳定
的氧化物
时所放出的热量,叫该物质的燃烧热。
(2)表示意义
CH
4
(g)+2O
2
(g)
CO
2
(g)+2H
2
O(l) Δ
H
=-890.31 kJ/mol,表示101 kPa条件下,
1 mol CH
4
完全燃烧生成CO
2
(g)和H
2
O(l)时⑧
放出
的热量是⑨
890.31 kJ
。
2.中和反应的反应热
(1)定义:在稀溶液中,酸跟碱发生⑩
中和
反应生成
1 mol
H
2
O时
所释放的热量,叫中和反应的反应热。
(2)热化学方程式:H
+
(aq)+OH
-
(aq)
H
2
O(l) Δ
H
=-57.3 kJ·mol
-1
。
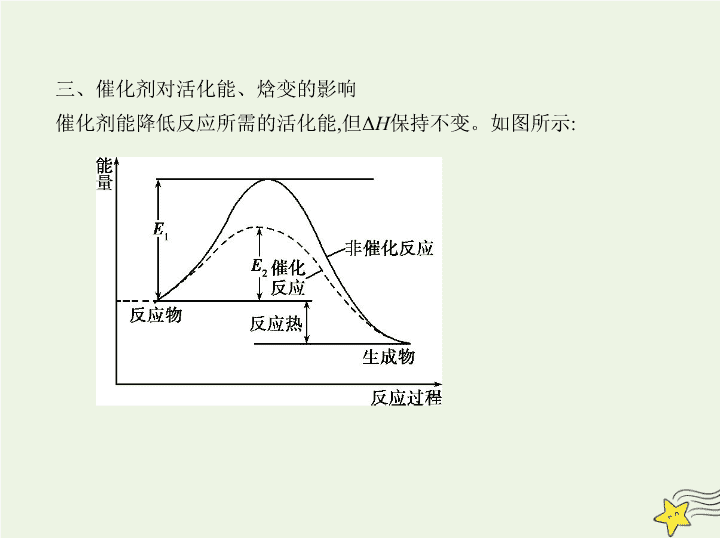
三、催化剂对活化能、焓变的影响
催化剂能降低反应所需的活化能,但Δ
H
保持不变。如图所示:
核心精讲
一、放热反应和吸热反应的比较
类型比较
放热反应
吸热反应
定义
有热量放出的化学反应
吸收热量的化学反应
形成原因
反应物具有的总能量大于生成物具有的总能量
反应物具有的总能量小于生成物具有的总能量
与化学键强弱的关系
生成物分子成键时释放出的总能量大于
反应物分子断键时吸收的
总能量
生成物分子成键时释放出的总能量小于反应物分子断键时吸收的总能量
表示方法
Δ
H
<0
Δ
H
>0
图示
实例
H
2
(g)+Cl
2
(g)
2HCl(g) Δ
H
=-184.6 kJ·mol
-1
C(s)+H
2
O(g)
CO(g)+H
2
(g) Δ
H
=+131.3 kJ·mol
-1
二、常见的放热反应和吸热反应
1.常见的放热反应
①活泼金属与水或酸的反应,例如:
2Na+2H
2
O
2NaOH+H
2
↑
2Al+6HCl
2AlCl
3
+3H
2
↑
②酸碱中和反应,例如:
2KOH+H
2
SO
4
K
2
SO
4
+2H
2
O
CH
3
COOH+NaOH
CH
3
COONa+H
2
O
③燃烧反应,例如:
2CO+O
2
2CO
2
CH
3
CH
2
OH+3O
2
2CO
2
+3H
2
O
SO
3
+H
2
O
H
2
SO
4
CaO+H
2
O
Ca(OH)
2
CuSO
4
+5H
2
O
CuSO
4
·5H
2
O
2.常见的吸热反应
①一些分解反应,例如:
CaCO
3
CaO+CO
2
↑
CuSO
4
·5H
2
O
CuSO
4
+5H
2
O
②一些复分解反应,例如:
2NH
4
Cl(s)+Ba(OH)
2
·8H
2
O(s)
BaCl
2
+2NH
3
↑+10H
2
O
③一些置换反应,例如:
C(s)+H
2
O(g)
CO+H
2
④一些化合反应,例如:
CO
2
+C
2CO
3.反应条件与放热反应、吸热反应的关系
不同的化学反应发生的条件不同,放热反应和吸热反应均能在一定条件下
发生。反应开始需要加热的反应可能是吸热反应,也可能是放热反应。吸
热反应开始时加热,反应后需要不断加热才能维持反应继续进行;放热反应
开始时加热,反应后会放出一定的热量,此热量能够使反应继续进行,则反
应过程中不需要再加热,如煤的燃烧,一旦热量足够使煤燃烧起来,之后煤
就可以继续燃烧下去,不再需要外界加热。由此可见,反应是吸热还是放热
与反应的条件没有必然的联系,而是取决于反应物和生成物具有的总能量
(或焓)的相对大小。
④一些化合反应,例如:
考点二 热化学方程式 盖斯定律及其应用
基础知识
一、热化学方程式
1.定义:表示参加反应物质的量和①
反应热
的关系的化学方程式。
2.书写要求
(1)注明反应的温度和压强(25 ℃、101 kPa下进行的反应可不注明)。
(2)注明反应物和生成物的状态:固态(②
s
或注明晶型)、液态(③
l
)、气态(④
g
)、溶液(aq)。
(3)热化学方程式中的化学计量数只表示物质的量,而不代表⑤
分子个数
,因此可以写成分数。
二、盖斯定律及其应用
1.
内容
:
不管化学反应是一步完成还是分几步完成
,
其反应热是相同的
,
即化
学反应的反应热只与反应体系的⑥
始态
和⑦
终态
有关
,
而与反应
的途径无关。
2.应用:很多反应很难直接测其反应热,这时可利用盖斯定律来间接计算。
1.反应热大小比较方法
(1)同一反应的生成物状态不同时
A(g)+B(g)
C(g) Δ
H
1
<0
A(g)+B(g)
C(l) Δ
H
2
<0
C(g)
C(l) Δ
H
3
<0
因为Δ
H
3
=Δ
H
2
-Δ
H
1
,Δ
H
3
<0,所以Δ
H
2
<Δ
H
1
。
也可以按以下思路分析:
C(g)
C(l)
知能拓展
C(l)
因为Δ
H
1
+Δ
H
3
=Δ
H
2
,Δ
H
1
<0,Δ
H
2
<0,Δ
H
3
<0,所以Δ
H
2
<Δ
H
1
。
(2)同一反应的反应物状态不同时
S(g)+O
2
(g)
SO
2
(g) Δ
H
1
<0
S(s)+O
2
(g)
SO
2
(g) Δ
H
2
<0
S(g)
S(s) Δ
H
3
<0
因为Δ
H
2
+Δ
H
3
=Δ
H
1
,Δ
H
1
<0,Δ
H
2
<0,Δ
H
3
<0,所以Δ
H
1
<Δ
H
2
。
(3)两个有联系的不同反应相比
C(s)+O
2
(g)
CO
2
(g) Δ
H
1
<0
C(s)+
O
2
(g)
CO(g) Δ
H
2
<0
C(s)
CO
2
(g)
C(s)
CO(g)
CO
2
(g)
因为Δ
H
2
+Δ
H
3
=Δ
H
1
,Δ
H
1
<0,Δ
H
2
<0,Δ
H
3
<0,所以Δ
H
1
<Δ
H
2
。
并且据此可写出下面的热化学方程式:
CO(g)+
O
2
(g)
CO
2
(g) Δ
H
=Δ
H
1
-Δ
H
2
。
2.反应热的计算方法
(1)应用盖斯定律计算反应热
某化学反应无论一步完成,还是分几步完成,反应的总热效应相同。即反应
热只与反应体系的始态和终态有关,而与反应途径无关,这就是盖斯定律。
此定律的主要应用是用已知反应的反应热来推知相关反应的反应热。
注意 应用盖斯定律进行简单计算的注意事项
①设计合理的反应过程。
②当反应方程式乘或除某数时,Δ
H
也应乘或除该数。
③反应方程式进行加减运算时,Δ
H
也同样要进行加减运算,且计算过程中
要带“+”“-”。
④应用盖斯定律进行计算并比较反应热的大小时,同样要把Δ
H
看作一个
整体。
⑤在设计的反应过程中常会遇到同一物质固、液、气三态的相互转化,状
态由固→液→气变化时,会吸热;反之会放热。
⑥当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相
反。运用盖斯定律的关键在于分析总反应可由哪些中间过程构成,化简要
细心。
(2)根据化学键键能计算
Δ
H
=反应物的键能总和-生成物的键能总和
(3)根据反应物和生成物的能量计算
Δ
H
=生成物具有的总能量-反应物具有的总能量。
例1 (2019安徽定远期末,5)肼(N
2
H
4
)在不同条件下分解产物不同,200 ℃时
在Cu表面分解的机理如图1。已知200 ℃时:
反应Ⅰ:3N
2
H
4
(g)
N
2
(g)+4NH
3
(g) Δ
H
1
=-32.9 kJ/mol
反应Ⅱ:N
2
H
4
(g)+H
2
(g)
2NH
3
(g) Δ
H
2
=-41.8 kJ/mol
图1
下列说法不正确的是
( )
A.图1所示过程①、②都是放热反应
B.反应Ⅱ的能量过程示意图如图2所示
图2
C.断开3 mol N
2
H
4
(g)中的化学键吸收的能量小于形成1 mol N
2
(g)和4 mol
NH
3
(g)中的化学键释放的能量
D.200 ℃时,肼分解生成氮气和氢气的热化学方程式为N
2
H
4
(g)
N
2
(g)+
2H
2
(g) Δ
H
=+50.7 kJ/mol
解题导引 理解能量变化与断键、成键的关系。书写热化学方程式应注
明物质的状态和焓变。
解析 A项,由已知信息“反应Ⅰ”知,过程①为放热反应;根据盖斯定律:
(Ⅰ)-2
×
(Ⅱ)得N
2
H
4
(g)
N
2
(g)+2H
2
(g) Δ
H
=-32.9 kJ/mol-2
×
(-41.8 kJ/mol)
=+50.7 kJ/mol,过程②为吸热反应,故A错误。B项,反应Ⅱ为放热反应,反应
物能量高于生成物能量,故B正确。C项,由反应Ⅰ知断开3 mol N
2
H
4
(g)中的
化学键吸收的能量小于形成1 mol N
2
(g)和4 mol NH
3
(g)中的化学键释放的
能量,故C正确。D项,根据A项分析可知D正确。
答案 A
例2 (2018河北邯郸质检,13)工业上,在一定条件下利用乙烯和水蒸气反
应制备乙醇。化学原理:CH
2
CH
2
(g)+H
2
O(g)
CH
3
CH
2
OH(g) Δ
H
。
已知几种共价键的键能如下表所示:
下列说法中错误的是
( )
A.上述合成乙醇的反应是加成反应
B.相同时间段内,反应中用三种物质表示的反应速率相等
C.碳碳双键的键能小于碳碳单键键能的2倍
D.上述反应中,Δ
H
=-96 kJ·mol
-1
化学键
C—H
C
C
H—O
C—C
C—O
键能/kJ·mol
-1
413
615
463
348
351
解题导引 Δ
H
=反应物键能总和-生成物键能总和。键能是从能量角度衡
量化学键强弱的物理量。
解析 题述反应中,Δ
H
=615 kJ·mol
-1
+413 kJ·mol
-1
×
4+463 kJ·mol
-1
×
2-348 kJ·
mol
-1
-413 kJ·mol
-1
×
5-463 kJ·mol
-1
-351 kJ·mol
-1
=-34 kJ·mol
-1
,D项错误。
答案 D
1.盖斯定律的考查与节能减排、工业三废资源化处理、开发利用新能源
等社会热点问题相联系,并运用所学的化学知识和方法解决生产、生活中
简单的化学问题;在实践中逐步形成节约成本、循环利用、保护环境等观
念,体现了科学态度与社会责任这一化学学科核心素养。
例1 (2017江苏单科,8,2分)通过以下反应可获得新型能源二甲醚(CH
3
OCH
3
)。下列说法不正确的是
( )
①C(s)+H
2
O(g)
CO(g)+H
2
(g) Δ
H
1
=
a
kJ·mol
-1
②CO(g)+H
2
O(g)
CO
2
(g)+H
2
(g) Δ
H
2
=
b
kJ·mol
-1
③CO
2
(g)+3H
2
(g)
CH
3
OH(g)+H
2
O(g) Δ
H
3
=
c
kJ·mol
-1
④2CH
3
OH(g)
CH
3
OCH
3
(g)+H
2
O(g) Δ
H
4
=
d
kJ·mol
-1
实践探究
A.反应①、②为反应③提供原料气
B.反应③也是CO
2
资源化利用的方法之一
C.反应CH
3
OH(g)
CH
3
OCH
3
(g)+
H
2
O(l)的Δ
H
=
kJ·mol
-1
D.反应2CO(g)+4H
2
(g)
CH
3
OCH
3
(g)+H
2
O(g)的Δ
H
=(2
b
+2
c
+
d
) kJ·mol
-1
思路分析 反应①、②的生成物中CO
2
和H
2
是反应③的反应物。反应③
是将CO
2
转化为CH
3
OH,变废为宝。已知的4个热化学方程式中的水都是气
态,没有H
2
O(g)→H
2
O(l)的反应热,因此无法计算CH
3
OH(g)
CH
3
OCH
3
(g)+
H
2
O(l)的焓变。
答案 C
题目价值 本题以新能源二甲醚的合成为背景,将化工流程简化为热化学
方程式来考查学生对能量的转化关系、化学反应焓变的概念、盖斯定律
的运用等知识的理解、掌握及应用。引导学生主动关心与环境保护、资
源开发等有关的社会热点问题,形成与环境和谐共处、合理利用自然资源
的观念。
2.结合化学反应中能量变化的本质是化学键的断裂与形成,通过实验历程
图来展示反应的实质,考查学生对图表信息的加工处理能力。
例2 (2018北京理综,7,6分)我国科研人员提出了由CO
2
和CH
4
转化为高附
加值产品CH
3
COOH的催化反应历程。该历程示意图如下。下列说法不正
确的是
( )
A.生成CH
3
COOH总反应的原子利用率为100%
B.CH
4
→CH
3
COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
思路分析 根据反应历程知,该反应为CH
4
+CO
2
CH
3
COOH。根据
CH
4
和CH
3
COOH的结构式,判断C—H键发生断裂并形成了C—C键。根据
历程图可判断,①的能量高于②的能量,因此①→②放出能量。此反应没有
副反应发生,则原子利用率为100%。
答案 D
题目价值 本题以高附加值产品CH
3
COOH的合成历程图为背景,分析物
质化学变化和伴随发生的能量转化与物质微观结构之间的关系。考查
“原子经济”的概念、催化剂对化学反应速率和平衡的影响、物质结构
式和结构简式的理解和掌握。
相关文档
- 2021高考化学一轮复习专题五化学反2021-07-0624页
- 高二化学教案【专题四】化学反应中2021-07-064页
- 高中化学58个精讲3化学反应中的能2021-07-057页
- 2020年高考化学真题模拟题专项汇编2021-07-0527页
- 2018届二轮复习化学反应中的能量变2021-07-0558页
- 天津专用2020高考化学二轮复习热点2021-07-034页
- 北京版2021高考化学一轮复习专题九2021-07-0319页
- 2018届二轮复习化学反应中的能量变2021-07-0347页
- 广东省2021高考化学一轮复习专题五2021-07-0224页
- 2018届二轮复习化学反应中的能量变2021-07-0241页