- 385.50 KB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学反应速率
过氧化氢化学式为H2O2,俗称双氧水。外观为无色透明液体,是一种强氧化剂,由于其还原产物为水,因此在工业上称为绿色氧化剂。其水溶液适用于医用伤口消毒及环境消毒和食品消毒。在一般情况下会分解成水和氧气,但分解速度极慢,改变条件可以加快反应速度,例如升高温度、加入适当的催化剂(MnO2、某些金属离子如Fe3+、Cu2+等)。
问题1:0.1 g MnO2粉末加入50 mL H2O2溶液中,测得在标准状况下放出气体的体积和时间的关系如图所示。若溶液的体积保持50 mL不变,计算前3 min H2O2的平均速率。(素养角度——证据推理与模型认知)
提示:前3 min H2O2反应放出50 mL O2,H2O2的分解反应为2H2O22H2O+O2↑,则Δn(H2O2)=×2≈0.004 46 mol,v(H2O2)=≈0.03 mol·L-1·
min-1。
问题2:为比较Fe3+和Cu2+对H2O2分解的催化效果,某实验小组的同学设计了如图所示的实验装置进行实验。
有同学认为上述实验设计不合理,不能得出相应的结论。请简述理由并提出改进措施。(素养角度——科学探究与创新意识)
提示:二者的阴离子不同,对实验会造成干扰。为消除阴离子不同造成的干扰,可将0.1 mol·L-1的FeCl3溶液改为0.05 mol·L-1的Fe2(SO4)3溶液,或者将0.1 mol·L-1的CuSO4溶液改为0.1 mol·L-1的CuCl2溶液。
问题3:某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2溶液、0.1 mol·L-1Fe2(SO4)3溶液、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。
参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。(素养角度——科学探究与创新意识)
物理量
实验序号
V[0.1 mol·L-1
Fe2(SO4)3]/mL
……
1
a
……
2
a
……
提示:探究时一定要注意变量的控制,即只改变一个变量,才能说明该变量对反应的影响。表格中给出了硫酸铁的量,且体积均相等。而探究的是不同浓度的双氧水分解的速率,所以必须要有不同浓度的双氧水,但题给试剂中只有30%的双氧水,因此还需要蒸馏水,要保证硫酸铁的浓度相同,
必须保证两组实验中双氧水和蒸馏水的总体积相同,且两组实验中双氧水和蒸馏水的体积不同两个条件。同时还要记录两组实验中收集相同体积氧气所需时间或相同时间内收集氧气的体积大小。
v(H2O2)/mL
v(H2O)/mL
v(O2)/mL
t/s
1
b
c
e
d
2
c
b
e
f
或
v(H2O2)/mL
v(H2O)/mL
t/s
v(O2)/mL
1
b
c
e
d
2
c
b
e
f
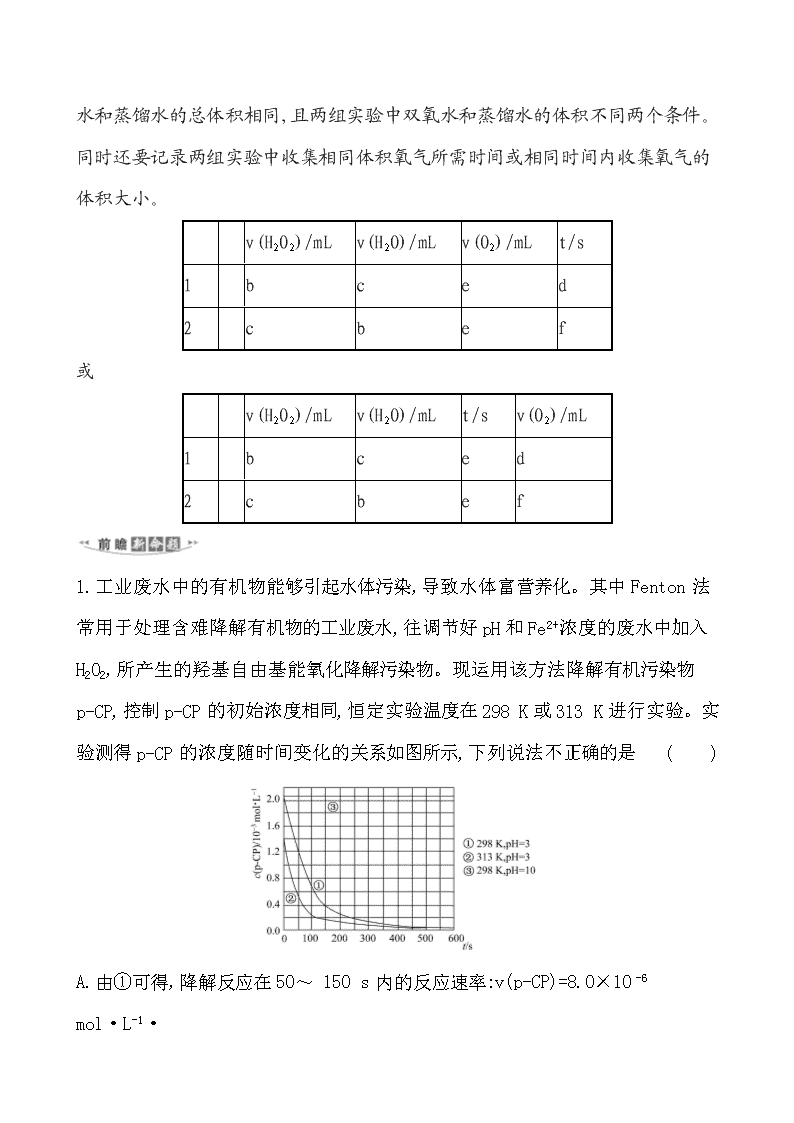
1.工业废水中的有机物能够引起水体污染,导致水体富营养化。其中Fenton法常用于处理含难降解有机物的工业废水,往调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K进行实验。实验测得p-CP的浓度随时间变化的关系如图所示,下列说法不正确的是 ( )
A.由①可得,降解反应在50~ 150 s内的反应速率:v(p-CP)=8.0×10-6 mol·L-1·
s-1
B.升高温度,有利于加快降解反应速率,但温度过高反应速率又会变慢
C.③目的为探究溶液的pH对降解反应速率的影响
D.298 K下,有机物p-CP降解速率pH=10时比pH=3时快
【解析】选D。根据图象可知,曲线①中50 s时的浓度为1.2×10-3 mol·L-1,
150 s时浓度为0.4×10-3 mol·L-1,则50~ 150 s内的平均反应速率为v(p-CP)
===8.0×10-6 mol·L-1·s-1,故A正确;温度较高时,过氧化氢不稳定易分解,所以温度过高时反而导致降解反应速率减小,升高温度,有利于加快降解反应速率,但温度过高反应速率又会变慢,故B正确;③目的为探究溶液的pH对降解反应速率的影响,通过图象曲线变化可知,当pH=10时,随着时间的变化,其浓度基本不变,即反应速率趋向于零,故C正确;根据曲线③可以得出,该反应在pH=10的溶液基本停止,故有机物p-CP降解速率pH=10时比pH=3时慢,故D错误。
2.(2020·黄冈模拟)1799年英国化学家汉弗莱·戴维发现一氧化二氮(N2O)气体具有轻微的麻醉作用,而且对心脏、肺等器官无伤害,后被广泛应用于医学手术中。
(1)在一定温度下的恒容容器中,反应2N2O(g)2N2(g)+O2(g)的部分实验数据如下:
反应时间
/min
0
10
20
30
40
50
c(N2O)/mol·L-1
0.10
0.09
0.08
0.07
0.06
0.05
反应时间
/min
60
70
80
90
100
c(N2O)/mol·L-1
0.04
0.03
0.02
0.01
0.00
①在0~ 20 min时段,反应速率v(N2O)为 mol·L-1·min-1。
②若N2O起始浓度c0为0.150 mol·L-1,则反应至30 min 时N2O的转化率α= 。
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1 T2(填“>”“=”或“<”)。当温度为T1、起始压强为p0,反应至t1 min时,体系压强p= (用p0表示)。
(2)碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g)2I(g) (快反应)
第二步 I(g)+N2O(g)N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是 (填标号)。
A.温度升高,k值增大
B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大
D.I2浓度与N2O分解速率无关
【解析】(1)①根据表格数据,在0~ 20 min时段,反应速率v(N2O)==
=1.0×10-3 mol·L-1·min-1;
②由表可知,每隔10 min,c(N2O)的变化量相等,故单位时间内c(N2O)的变化与N2O的起始浓度无关,每10 min均减小0.01 mol·L-1,若N2O起始浓度c0为0.150 mol·
L-1,则反应至30 min时转化的N2O的浓度为0.01 mol·L-1×3=0.03 mol·L-1,则N2O的转化率α=×100%=20.0%;
③其他条件相同时,温度升高化学反应速率加快,N2O分解半衰期减小,由图可知,压强相同时,半衰期T2>T1,则温度T1>T2;当温度为T1、起始压强为p0,设起始时的物质的量为1 mol,则,
2N2O(g)2N2(g)+O2(g)
起始量(mol) 1 0 0
t1 min时(mol) 0.5 0.5 0.25
t1 min时总物质的量为(0.5+0.5+0.25) mol=1.25 mol,根据等温等容条件下,压强之比等于物质的量之比,体系压强p=p0=1.25p0,
(2)温度升高,化学反应速率增大,因v=k·c(N2O)·[c(I2)]0.5,则温度升高,k值增大,故A正确;化学反应速率由反应最慢的反应决定,则第二步对总反应速率起决定作用,故B错误;第二步反应为慢反应,第三步反应为快反应,所以第二步活化能比第三步大,故C正确;含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5,所以N2O分解速率与I2浓度有关,故D错误。
答案:(1)①1.0×10-3 ②20.0% ③> 1.25p0
(2)AC
【加固训练】
1.Na2FeO4是一种常见的水处理剂,用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,某兴趣小组设计如下对比实验探究温度、浓度、pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是 ( )
实验编号
温度(℃)
pH
①
25
1
②
45
1
③
25
7
④
25
1
A.实验①在15 min内,M的降解速率为1.33×10-5 mol·L-1·min-1
B.若其他条件相同,实验①②说明升高温度,M的降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验①④说明M的浓度越小,降解速率越快
【解析】选D。根据化学反应速率的表达式,v(M)= mol·L-1·min-1=
1.33×10-5 mol·L-1·min-1,故A项正确;①②不同的是温度,②的温度高于①,在相同的时间段内,②中M的浓度变化大于①,说明②中M的降解速率大,故B
项正确;①③温度相同,③的pH大于①,在相同的时间段内,①中M浓度变化大于③,说明①的降解速率大于③,故C项正确;①④M的浓度不同,0~ 15 min内,④中M的浓度变化小于①,说明M的浓度越小,降解速率越慢,故D项错误。
2.氮氧化物是一种常见的大气污染物,能够引起光化学烟雾、酸雨等环境问题,因此应对大气中的氮氧化物进行处理。某研究小组利用甲烷消除NO2污染进行研究,其反应为CH4+2NO2N2+CO2+2H2O。在2 L密闭容器中,控制不同温度,分别加入0.50 mol CH4和1.2 mol NO2,测得n(CH4)随时间变化的有关实验数据见下表。下列说法正确的是( )
组别
温度
时间/min
(n/mol)
0
10
20
40
50
①
T1
n(CH4)
0.50
0.35
0.25
0.10
0.10
②
T2
n(CH4)
0.50
0.30
0.18
0.15
A.组别①中,0~ 20 min内,NO2的降解速率为0.025 mol·L-1·min-1
B.由实验数据可知实验控制的温度T1>T2
C.40 min时,表格中T2对应反应已经达到平衡状态
D.0~ 10 min内,CH4的降解速率①>②
【解析】选C。①中0~ 20 min内,v(CH4)=(0.5 mol-0.25 mol)/(2 L×20 min)
=0.006 25 mol·L-1·min-1,NO2的降解速率为v(NO2)=2v(CH4)=0.012 5 mol·L-1·min-1,故A错误;温度越高反应速率越大,由实验数据可知0~ 20 min内,实验①中CH4物质的量的变化量为0.25 mol,实验②中CH4物质的量的变化量为0.32 mol,则实验②温度高,由实验数据可知实验控制的温度T1”“<”或“=”)E2。
(2)在373 K时,向体积为2 L的恒容真空容器中通入0.40 mol NO2,发生反应:2NO2(g)N2O4(g) ΔH=-57.0 kJ·mol-1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min
0
20
40
60
80
φ(NO2)
1.0
0.75
0.52
0.40
0.40
①0~ 20 min内,v(N2O4)= 。
②上述反应中,v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373 K时,k1、k2的数学关系式为 。改变温度至T1时k1=k2,则
T1 373 K(填“>”“<”或“=”)。
【解析】(1)根据盖斯定律分析,①+②即可得到反应2NO(g)+O2(g)2NO2(g),故对应的反应热之间的关系为ΔH=ΔH1+ΔH2;因为反应2NO(g)+O2(g)2NO2(g)为①+②的结果,所以其平衡常数K=K1K2;反应慢的速率决定总反应速率,则决定2NO(g)+O2(g)2NO2(g)的反应速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2;
(2)①设0~ 20 min内生成N2O4的物质的量是x mol。
2NO2(g)N2O4(g)
开始( mol·L-1): 0.2 0
转化( mol·L-1): x
20 min( mol·L-1): (0.2-x)
=0.75,解得:x=0.08,v(N2O4)= mol·L-1÷20 min=2.0×10-3 mol·L-1·min-1;
②设平衡时N2O4的浓度为x mol·L-1。
2NO2(g) N2O4(g)
开始: 0.2 mol·L-1 0
转化: 2x mol·L-1 x mol·L-1
平衡: (0.2-2x) mol·L-1 x mol·L-1
=0.4,x=0.075,v正(NO2)∶v逆(N2O4)=2∶1,即k1·c2(NO2)∶[k2·c(N2O4)]=
2∶1,k1×0.052∶(k2×0.075)=2∶1,所以k1=60k2。若改变温度至T1时k1=k2,则根据平衡时k1·c2(NO2)∶[k2·c(N2O4)]=2∶1可知c(NO2)较原平衡增大,c(N2O4)较原平衡减小,说明平衡逆向移动,该反应正反应放热,所以T1>373 K。
答案:(1)ΔH1+ΔH2 K1K2 ② < (2)①2×10-3 mol·L-1·min-1 ②k1=60k2 >
关闭Word文档返回原板块
相关文档
- 2020届高考化学一轮复习化学反应中2021-07-0617页
- 2020届高考一轮复习化学反应的方向2021-07-0630页
- 2020届高考化学一轮复习化学能与热2021-07-0642页
- 2021届高考化学一轮复习化学平衡图2021-07-068页
- 2020届高考化学一轮复习化学平衡常2021-07-0612页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-0614页
- 2020届高考化学一轮复习化学反应速2021-07-069页
- 2020届高考化学一轮复习化学能与热2021-07-0616页
- 2020届高考化学一轮复习化学有关计2021-07-0618页
- 2020届高考化学一轮复习化学与自然2021-07-0613页