- 451.50 KB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
建议用时:40分钟 满分:100分
一、选择题(每题6分,共72分)
1.(2018·广东省二模)《物理小知识》中对镀金法有如下叙述:“以汞和金涂银器上,成白色,入火则汞去,而金存,数次即黄。”其中“入火则汞去”是指( )
A.蒸发 B.升华 C.分液 D.分馏
答案 A
解析 镀金法是将黄金溶于汞中,均匀地涂到干净的金属器物表面,加热使汞蒸发,黄金在金属表面固结,形成光亮的金黄色镀层,故选A。
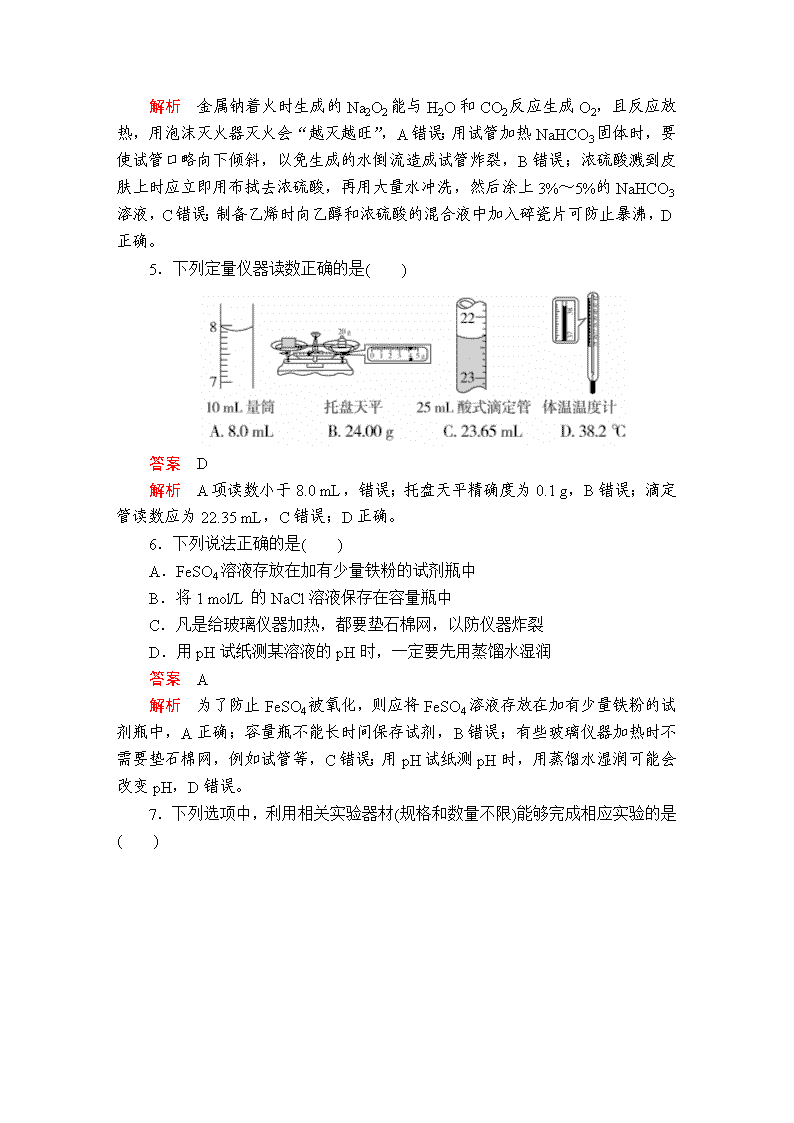
2.(2018·福州市期末)以下标示适合贴在无水乙醇试剂瓶上的是( )
答案 A
解析 无水乙醇具有可燃性,属于易燃液体,不属于剧毒物,不属于有害垃圾,不属于腐蚀品,故A项正确。
3.(2018·陕西省质检)《开宝本草》中记载:“此即地霜也,所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”。文中对硝酸钾提取没有涉及的操作方法是( )
A.溶解 B.蒸发 C.升华 D.结晶
答案 C
解析 “扫取以水淋汁后,乃煎炼而成”的意思是将硝酸钾固体溶解,过滤得到滤液,然后蒸发结晶得到硝酸钾固体,没有涉及升华的操作,故选C项。
4.进行化学实验时应强化安全意识。下列做法正确的是( )
A.金属钠着火时使用泡沫灭火器灭火
B.用试管加热碳酸氢钠固体时使试管口竖直向上
C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
D.制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片
答案 D
解析 金属钠着火时生成的Na2O2能与H2O和CO2反应生成O2,且反应放热,用泡沫灭火器灭火会“越灭越旺”,A错误;用试管加热NaHCO3固体时,要使试管口略向下倾斜,以免生成的水倒流造成试管炸裂,B错误;浓硫酸溅到皮肤上时应立即用布拭去浓硫酸,再用大量水冲洗,然后涂上3%~5%的NaHCO3溶液,C错误;制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片可防止暴沸,D正确。
5.下列定量仪器读数正确的是( )
答案 D
解析 A项读数小于8.0 mL,错误;托盘天平精确度为0.1 g,B错误;滴定管读数应为22.35 mL,C错误;D正确。
6.下列说法正确的是( )
A.FeSO4溶液存放在加有少量铁粉的试剂瓶中
B.将1 mol/L的NaCl溶液保存在容量瓶中
C.凡是给玻璃仪器加热,都要垫石棉网,以防仪器炸裂
D.用pH试纸测某溶液的pH时,一定要先用蒸馏水湿润
答案 A
解析 为了防止FeSO4被氧化,则应将FeSO4溶液存放在加有少量铁粉的试剂瓶中,A正确;容量瓶不能长时间保存试剂,B错误;有些玻璃仪器加热时不需要垫石棉网,例如试管等,C错误;用pH试纸测pH时,用蒸馏水湿润可能会改变pH,D错误。
7.下列选项中,利用相关实验器材(规格和数量不限)能够完成相应实验的是( )
答案 B
解析 A项,制备乙酸乙酯需要加热,缺少酒精灯,不能完成实验,故错误;B项,MnO2作催化剂,加速H2O2的分解,所给器材能够完成实验,故正确;C项,缺少胶头滴管,故错误;D项,缺少泥三角,故错误。
8.(2018·湖北重点中学联考)下列溶液配制实验的描述完全正确的是( )
A.在实验室,学生一般无需查阅资料即可用一定体积75%的硝酸来配制250 mL 2 mol·L-1的硝酸溶液
B.实验室在配制FeCl3溶液时,常将FeCl3固体先溶于较浓的盐酸中再加水稀释
C.用浓盐酸配制1∶1(体积比)的稀盐酸(约6 mol·L-1)通常需要用容量瓶等仪器
D.用pH=1的盐酸配制100 mL pH=2的盐酸所需全部玻璃仪器有100 mL容量瓶、烧杯、玻璃棒、胶头滴管
答案 B
解析 准确配制250 mL 2 mol·L-1 HNO3溶液,要知道浓HNO3的物质的量浓度或密度,用酸式滴定管准确量取所需浓HNO3的体积,A错误;FeCl3易水解,配制其溶液时,常将FeCl3固体溶解在较浓的盐酸中,再加水稀释,B正确;用浓盐酸配制体积比为1∶1的稀盐酸,是粗略配制一定浓度的溶液,不需要容量瓶,C错误;用pH=1的盐酸配制100 mL pH=2的盐酸,还需要酸式滴定管,用于量取pH=1的盐酸,D错误。
9.(2018·山西重点中学联考)室温下用下列实验装置进行相应实验,能达到实验目的的是( )
A.图甲验证浓硫酸具有强氧化性
B.图乙制取干燥的NH3
C.图丙干燥、收集并吸收多余SO2
D.图丁准确量取一定体积K2Cr2O7标准溶液
答案 B
解析 铜与浓硫酸反应需要加热,故A错误;氧化钙与水的反应是放热反应,可加快浓氨水中氨气的逸出,故可用浓氨水和生石灰制取氨气,而干燥管中碱石灰可以干燥氨气,B正确;装置丙中收集不到干燥的二氧化硫气体,因为二氧化硫不能用碱石灰干燥,故C错误;K2Cr2O7溶液具有强氧化性,应改用酸式滴定管,故D错误。
10.下列实验操作正确的是( )
A.用玻璃棒蘸取CH3COOH溶液点在湿润的pH试纸上,测定该溶液的pH
B.中和滴定时,滴定管用所盛装的反应液润洗2~3次
C.用装置甲分液,放出水相后再从分液漏斗下口放出有机相
D.用装置乙加热分解NaHCO3固体
答案 B
解析
测定溶液pH时,不可将pH试纸润湿,A错误;滴定管用水洗净后,要用待装液润洗,B正确;分液漏斗中下层液体从下口放出,上层液体从上口倒出,C错误;NaHCO3加热分解有H2O生成,若试管口朝上,水会倒流到试管底部,使试管炸裂,所以试管口应稍向下倾斜,D错误。
11.(2018·湖南六校联考)下列有关实验装置进行的相应实验,能达到实验目的的是( )
A.用图1所示装置除去乙烯中少量的SO2气体
B.用图2所示仪器量取20.00 mL 0.10 mol·L-1稀硫酸
C.用图3所示装置能验证HCl气体在水中的溶解性
D.用图4所示装置从碘的CCl4溶液中分离出碘
答案 C
解析 A项,乙烯也会被酸性KMnO4溶液氧化,错误;B项,图2为碱式滴定管,不能量取稀硫酸,错误;C项,加水,HCl极易溶于水,圆底烧瓶内压强迅速减小,气球鼓起来,正确;D项,碘易溶于CCl4,不能用分液的方法分离,可以通过蒸馏分离,错误。
12.(2018·呼和浩特市二模)用下列实验装置完成对应的实验,能达到实验目的的是( )
答案 A
解析 浓硫酸使蔗糖脱水炭化,蔗糖颜色会变黑,浓硫酸将生成的C氧化后本身被还原为二氧化硫,二氧化硫能使溴水褪色,A项正确;收集氨气的试管不能用单孔塞,应该塞一团棉花,B项错误;验证NaHCO3和Na2CO3的热稳定性,应将NaHCO3、Na2CO3的放置位置颠倒一下,C项错误;采用CCl4萃取I2时,应该用梨形分液漏斗,D项错误。
二、非选择题(共28分)
13.(14分)现有下列仪器或装置,请回答下列问题:
(1)仪器①的名称是________________,②的名称是________________。
(2)用上图仪器组装成气体发生装置:用KClO3和MnO2制O2应选的装置是________(填字母,下同);用H2O2与MnO2制O2,并控制产生O2的速率,应选的装置是________。
(3)若用装置X进行“排空气法”收集制取的O2,氧气应从________(填“b”或“c”,下同)端通入。若瓶中装满水,用排水法收集氧气,氧气应从________端通入。
(4)若用F装置进行CO还原Fe2O3的实验,实验室制取CO的方法一般采取甲酸脱水法(HCOOHCO↑+H2O),用纯净的CO完成该实验。
①除F、X外还需要的装置有________,X中应加入的试剂是________,X与其他导管连接的顺序是________(填导管口的字母)。
②实验时,a处可能的现象为__________________________________ ______________________________________;
F装置中气球的作用是_______________________________________ _________________________________。
答案 (1)长颈漏斗 分液漏斗 (2)AE BD (3)c b (4)①DG 浓硫酸 dcbe ②红棕色粉末逐渐变黑 收集尾气,防止污染空气
解析 (2)KClO3和MnO2制O2属于“固十固气体”,因而要选用E装置为气体发生装置;H2O2与MnO2制O2属于“固十液―→气体”且要控制产生气体的速率,只能用分液漏斗控制加入的H2O2的量。
(3)使用X收集氧气时,用“排空气法”,由于O2的密度比空气的大,应从长管进气;用排水法收集气体,应从短管进气。
(4)根据反应原理可知,制取CO属于“液十液气体”,用分液漏斗控制加入浓硫酸的量,应选D、G为气体发生装置,X的作用是除去CO中的水蒸气,洗气时气体流向为“长进短出”。
14.(2018·重庆市调研)(14分)高氯酸铵(NH4ClO4)为白色晶体,是强氧化剂,常用作火箭发射的推进剂。已知:①NH4ClO4在400 ℃时开始分解,产物为N2、Cl2、O2、H2O;②Mg3N2易水解。请用下图所示装置设计实验证明分解产物中含有Cl2、H2O以及装置A中生成了Mg3N2(装置不重复使用)。
(1)写出高氯酸铵分解的化学方程式:__________________________。
(2)高氯酸铵分解选择的装置是________(填字母)。
(3)按气流从左到右,装置的连接顺序是:分解装置→________→________→________→________→________。
(4)C中所放的试剂是__________,G的作用是____________。
(5)能证明有Cl2产生的现象是____________________________。
(6)要证明装置A中生成了Mg3N2需要进行的实验操作以及对应的实验现象是__________________________________________________________________。
(7)某实验室存放的高氯酸铵样品中含有少量杂质,已知可用蒸馏法测定NH4ClO4的含量,其测定流程如下(杂质不参加反应),则样品中NH4ClO4的含量(w)为________。
答案 (1)2NH4ClO4N2↑+2O2↑+Cl2↑+4H2O (2)B (3)CFEGA (4)无水CuSO4 吸收水(干燥) (5)F中溶液由无色变为橙色(或黄色)
(6)取少量A中反应后的固体于试管中,加水,将湿润的红色石蕊试纸放在试管口,试纸变蓝色 (7)94%
解析 (1)NH4ClO4在400 ℃时开始分解,产物为N2、Cl2、O2、H2O,反应的化学方程式:2NH4ClO4N2↑+2O2↑+Cl2↑+4H2O。
(2)高氯酸铵为固体,且有水产生,故要用到固固加热装置且试管口要略向下倾斜,正确答案为B。
(3)高氯酸铵分解产物中N2、Cl2、O2、H2O。先通过装置C验证水蒸气,然后进入装置F中验证氯气,然后气体进入装置E中,除去氯气,G中装有浓硫酸,进行气体的干燥,最后氮气与镁反应生成氮化镁,故装置的连接顺序是:分解装置→C→F→E→G→A。
(4)根据上述分析可知C中所放的试剂是无水CuSO4,检验水蒸气。G中装有浓硫酸,吸收水。
(5)氯气有氧化性,能够把溴离子氧化为溴单质,F中溶液由无色变为橙色(或黄色),能证明有Cl2产生。
(6)Mg3N2易水解,与水发生反应生成氢氧化镁和氨气,因此只要检验氨气的存在即可证明装置A中生成了Mg3N2。
(7)NH4ClO4与氢氧化钠反应生成氨气,氨气被过量的硫酸吸收变为硫酸铵,剩余的硫酸用氢氧化钠溶液进行滴定,根据酸碱中和规律:溶液中剩余的氢离子的物质的量等于消耗的氢氧化钠的物质的量=(1.0×20.00×10-3) mol=0.02 mol,故用来吸收氨气的氢离子的物质的量为(30.00×1.0×2×10-3-0.02) mol=0.04 mol,则氨气的物质的量=0.04 mol,高氯酸铵的物质的量=0.04 mol,高氯酸铵的质量=0.04 mol×117.5 g/mol=4.7 g,则样品中NH4ClO4的含量(w)为×
100%=94%。