- 695.98 KB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2017
届高考化学二轮总复习
共价键 专题练习
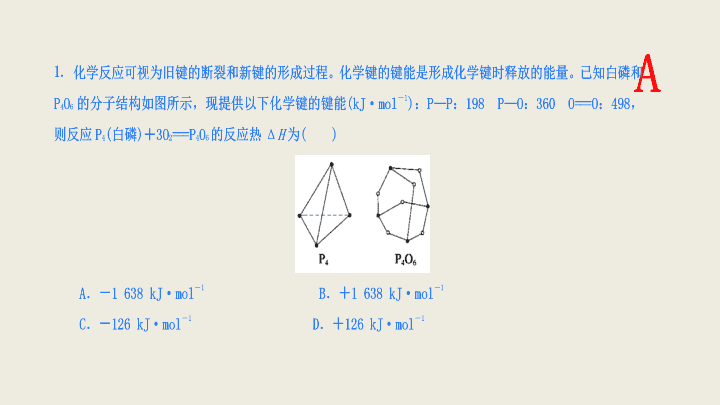
A
【
解析
】
反应中的键能包括:断裂
1 mol P
4
和
3 mol O
2
分子中共价键吸收的能量和形成
1 mol P
4
O
6
中共价键放出的能量。由各物质的分子结构知
1 mol P
4
含
6 mol P—P
键,
3 mol O
2
含
3 mol O===O
键,化学反应的反应热
Δ
H
=反应物的总键能
—
生成物的总键能。故
Δ
H
=
(198 kJ·mol
-
1
×6
+
498 kJ·mol
-
1
×3)
-
360 kJ·mol
-
1
×12
=-
1 638 kJ·mol
-
1
。
【
答案
】A
2.
关于键长、键能和键角,下列说法不正确的是
(
)
A
.键角是描述分子立体结构的重要参数
B
.键长的大小与成键原子的半径和成键数目有关
C
.键能越大,键长越长,共价化合物越稳定
D
.键角的大小与键长、键能的大小无关
【
解析
】
键长越短,键能越大,共价化合物越稳定,
C
项不正确。
【
答案
】C
C
3.
能够用键能的大小作为主要依据来解释的是
(
)
A
.常温常压下氯气呈气态,而溴单质呈液态
B
.硝酸是挥发性酸,而硫酸、磷酸是不挥发性酸
C
.稀有气体一般难发生化学反应
D
.空气中氮气的化学性质比氧气稳定
【
解析
】
共价分子构成物质的状态取决于分子间作用力的大小,与分子内共价键的键能无关;物质的挥发性与分子内键能的大小无关;稀有气体是单原子分子,无化学键,难发生化学反应的原因是它们的价电子已形成稳定结构;氮气比氧气稳定,是由于
N
2
分子中共价键的键能
(946 kJ·mol
-
1
)
比
O
2
分子中共价键的键能
(497.3 kJ·mol
-
1
)
大,在化学反应中更难断裂。
【
答案
】D
D
4.
能够用键能的大小作为主要依据来解释的是
(
)
A.
常温常压下氯气呈气态而溴单质呈液态
B.
硝酸是挥发性酸
,
而硫酸、磷酸是不挥发性酸
C.
稀有气体一般难于发生化学反应
D.
空气中氮气的化学性质比氧气稳定
【
解析
】
共价分子构成物质的状态取决于分子间作用力的大小
,
与分子内共价键的键能无关
;
物质的挥发性与分子内键能的大小无关
;
稀有气体是单原子分子
,
无化学键
,
难于发生化学反应的原因是它们的价电子已形成稳定结构
;
氮气比氧气稳定是由于
N
2
分子中共价键的键能
(946 kJ·mol
-1
)
比
O
2
分子中共价键的键能
(497.3 kJ·mol
-1
)
大
,
在化学反应中更难于断裂。
【
答案
】D
D
【
解析
】
根据碳碳双键中含有
1
个
π
键
,
由于
π
键电子云重叠程度小
,
不如
σ
稳定
,
所以双键的键能小于单键键能的
2
倍
,
选项
C
正确。
【
答案
】C
C
6.
根据等电子原理,下列各对粒子中,空间结构相似的是
(
)
A
.
SO
2
与
O
3
B
.
CO
2
与
NO
2
C
.
CS
2
与
NO
2
D
.
PCl
3
与
BF
3
【
解析
】
由题中信息可知,只要算出分子中各原子的最外层电子数之和即可判断。
B
的最外层电子数为
3
;
C
的最外层电子数为
4
;
N
、
P
的最外层电子数为
5
;
O
、
S
的最外层电子数为
6
。
【
答案
】A
A
7.
能说明
BF
3
分子中的
4
个原子在同一平面的理由是
(
)
A.
两个键之间夹角为
120°
B.B—F
键为非极性共价键
C.3
个
B—F
键的键能相同
D.3
个
B—F
键的键长相等
【
解析
】
当
F—B—F
键角为
120°
时
,BF
3
分子中的
4
个原子共面且分子构型为平面三角形。分子的空间构型由分子化学键的键长和键角决定。
【
答案
】A
A
B
9.
已知
N
2
+
O
2
===2NO
为吸热反应,
Δ
H
=+
180 kJ·mol
-
1
,其中
N
≡
N
、
O===O
键的键能分别为
946 kJ·mol
-
1
、
498 kJ·mol
-
1
,则
N—O
键的键能为
(
)
A
.
1 264 kJ·mol
-
1
B
.
632 kJ·mol
-
1
C
.
316 kJ·mol
-
1
D
.
1 624 kJ·mol
-
1
【
解析
】
180 kJ·mol
-
1
=
946 kJ·mol
-
1
+
498 kJ·mol
-
1
-
2
E
N
-
O
,所以
E
N
-
O
=
632 kJ·mol
-
1
。
【
答案
】B
B
10.
以下说法正确的是
(
)
A
.共价化合物内部可能有极性键和非极性键
B
.原子或离子间相互的吸引力叫化学键
C
.非金属元素间只能形成共价键
D
.金属元素与非金属元素的原子间只形成离子键
【
解析
】
全部由共价键形成的化合物是共价化合物,则共价化合物内部可能有极性键和非极性键,例如乙酸、乙醇中,
A
正确;相邻原子之间强烈的相互作用是化学键,包括引力和斥力,
B
不正确;非金属元素间既能形成共价键,也能形成离子键,例如氯化铵中含有离子键,
C
不正确;金属元素与非金属元素的原子间大部分形成离子键,但也可以形成共价键,例如氯化铝中含有共价键,
D
不正确。
【
答案
】A
A
11.
下列说法正确的是
(
)
A
.含有共价键的化合物一定是共价化合物
B
.分子中只有共价键的化合物一定是共价化合物
C
.由共价键形成的分子一定是共价化合物
D
.只有非金属原子间才能形成共价键
【
解析
】
A
项,某些单质如
(H
2
)
与某些离子化合物如
(Na
2
O
2
)
也含有共价键,
A
错;
B
项,分子中只有共价键的化合物一定是共价化合物,
B
对;
C
项,由共价键形成的分子也可能是非金属单质,
C
错;
D
项,除非金属原子之间可以形成共价键外,电负性之差小于
1.7
的金属与非金属元素的原子之间也可以形成共价键,故
D
错。
【
答案
】B
B
12.
从实验测得不同物质中氧氧之间的键长和键能的数据:
其中
x
、
y
的键能数据尚未测定,但可根据规律性推导键能的大小顺序为
w>z>y>x
;该规律性是
(
)
A
.成键的电子数越多,键能越大
B
.键长越长,键能越小
C
.成键所用的电子数越少,键能越大
D
.成键时电子对越偏移,键能越大
B
13.
下列说法中正确的是
(
)
A
.分子的结构是由键角决定的
B
.共价键的键能越大,共价键越牢固,由该键形成的分子越稳定
C
.
CF
4
、
CCl
4
、
CBr
4
、
CI
4
中
C—X
键的键长、键角均相等
D
.
H
2
O
分子中两个
O—H
键的键角为
180°
【
解析
】
分子的结构是由键参数
——
键角、键长决定的,故
A
项错误;由于
F
、
Cl
、
Br
、
I
的原子半径不同,故
C—X
键的键长不相等,
C
项错误;
H
2
O
分子中的键角为
105°
,故
D
项也错。
【
答案
】B
B
14.
下列事实不能用键能的大小来解释的是
(
)
A
.
N
元素的电负性较大,但
N
2
的化学性质很稳定
B
.稀有气体一般难发生反应
C
.
HF
、
HCl
、
HBr
、
HI
的稳定性逐渐减弱
D
.
F
2
比
O
2
更容易与
H
2
反应
【
解析
】
本题主要考查键参数的应用。由于
N
2
分子中存在三键,键能很大,破坏共价键需要很大的能量,所以
N
2
的化学性质很稳定,稀有气体都为单原子分子,分子内部没有化学键,卤族元素从
F
到
I
原子半径逐渐增大,其氢化物中的键长逐渐变长,键能逐渐变小,所以稳定性逐渐减弱。由于
H—F
键的键能大于
H—O
键的键能,所以二者更容易生成
HF
。
【
答案
】B
B
D
【
解析
】
H
只有一个未成对电子
,
可以形成
1
个共价键
,C
和
Si
最外层有
4
个电子
,
可以形成
4
个共价键
,N
最外层有
5
个电子
,
可以形成
3
个共价键
,O
、
S
、
Se
最外层有
6
个电子
,
可以形成
2
个共价键。逐一分析
,D
中的
C
、
Si
成键不合理。
[
来源
【
答案
】D
16.
下列事实不能用键能的大小来解释的是
(
)
A.
氮元素的电负性较大
,
但
N
2
的化学性质很稳定
B.
惰性气体一般难发生反应
C.HF
、
HCl
、
HBr
、
HI
的稳定性逐渐减弱
D.F
2
比
O
2
更容易与
H
2
反应
【
解析
】
本题主要考查键参数的应用。由于
N
2
分子中存在
N
≡
N
三键
,
键能很大
,
破坏共价键需要很大的能量
,
所以
N
2
的化学性质很稳定
,
惰性气体都为单原子分子
,
分子内部没有化学键
,
卤族元素从
F
到
I
的原子半径逐渐增大
,
其氢化物中的键长逐渐变长
,
键能逐渐变小
,
所以稳定性逐渐减弱。由于
H—F
的键能大于
H—O,
所以二者比较更容易生成
HF
。
【
答案
】B
B
【
答案
】
(1)184.9
(2)A
多
18.
1919
年,
Langmuir
提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)
根据上述原理,仅由第二周期元素组成的共价分子中,互为等电子体的是:
________
和
________
,
________
和
__________
;
(2)
此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与
NO
互为等电子体的分子有:
________
、
________
。
【
解析
】
(1)
仅由第二周期元素组成的共价分子中,即
C
、
N
、
O
、
F
组成的共价分子,如:
N
2
与
CO
电子总数均为
14
,
CO
2
与
N
2
O
电子总数均为
22
。
(2)
依题意,只要原子数相同,价电子总数也相同,即可互称为等电子体,
NO
为三原子,其价电子总数为:
(5
+
6×2
+
1)
,
SO
2
、
O
3
也为三原子,各分子价电子总数均为
6×3
=
18
。
【
答案
】
(1)N
2
CO
CO
2
N
2
O
(2)SO
2
O
3
【
解析
】
同种原子之间形成的共价键是非极性键,特殊共价键是中间
O
原子提供的
2
个电子,和旁边两个
O
原子各提供的一个电子,形成一个三原子四电子大
π
键。
O
2
与
O
3
是同素异形体。等电子体的分子结构相似,
O
3
与
SO
2
是等电子体。
O
3
分子的两端的原子各有
2
对孤对电子,中间的原子有一对孤对电子,共有
5
对孤对电子。
【
答案
】
(1)σ
大
π
(2)
同素异形体
(3)C
(4)5
(5)1
4
1
4
2
【
解析
】
本题主要考查键能的定义以及键能与化学键稳定性的关系。
(1)
键能是指气态基态原子形成
1 mol
化学键释放的最低能量
,
新键形成释放能量
,
则旧键断裂必然吸收能量
,
根据能量守恒定律断开
1 mol Cl—Cl
键吸收的能量等于形成
1 mol Cl—Cl
键释放的能量。
(2)
键能越大
,
化学键越稳定
,
越不容易断裂
,
化学性质越稳定
,
因此最稳定的单质为
N
2
,
最不稳定的单质是
I
2
,
最稳定的化合物是
H
2
O,
最不稳定的化合物是
HI
。
(3)Δ
H=E(
反应物键能之和
)-E(
生成物键能之和
)=(436+243-2×432) kJ·mol
-1
=-185 kJ·mol
-1
。
【
答案
】
(1)
吸收
243
(2)N
2
I
2
H
2
O
HI
(3)Δ
H=-185 kJ·mol
-1